肿瘤标志物CD146
日期:2019-09-29 11:45:04
CD146是一种Ca2+非依赖性细胞黏附分子的膜糖蛋白,该蛋白首次鉴定为肿瘤标志物是因为CD146在黑素瘤中高表达,但在对应的正常对照组中却没有。正是这一发现让CD146受到了肿瘤研究领域的关注。目前,大量研究已证实CD146在黑色素瘤、前列腺癌、乳腺癌、肝癌、尿路上皮癌和妇科肿瘤中表达并与这些肿瘤的发生发展、转移、治疗和预后密切相关。本文从结构、功能、信号通路及相关肿瘤等方面对CD146进行介绍。希望能给刚进入这个研究领域的小伙伴们一点帮助。
1. CD146的结构
CD146又称黑色素瘤细胞黏附分子(MCAM)或细胞表面糖蛋白MUC18,是一种单链的膜贯通性糖蛋白,属于免疫球蛋白超家族(Igsf)成员,与许多细胞黏附分子(cell adhesion molecule,CAM)有同源性[1]。
CD146为单拷贝基因,位于人11号染色体长臂上,跨越大约14,000bp的染色体区域,编码一个相对分子质量为11.3kDa的糖基化蛋白[2]。不同物种(人、小鼠和鸡)中CD146基因的外显子-内含子结构相似[3] [4]。mRNA全长包含16个外显子,hCD146的第一个外显子编码区包括5’UTR端的26bp和超过三分之一的信号肽。第一个可变区(variable region)和三个C-2恒定区由两个外显子编码。第二个可变区由三个外显子编码。第16个外显子包含了1kb长的5’-UTR编码区。
如图1a所示,CD146基因含有三个poly(A)信号[5]。hCD146的TATA-和CAAT-box-less核心启动子区起始于第一个ATG上游的第505bp氨基酸,富含GC并且包含转录因子SP1、AP-2和CREB共识别的几个结合基序[6][7]。由于转录因子AP-2在胚胎发育中是至关重要,而CD146启动子区域含有多个AP-2结合位点,这也暗示CD146在发育过程中可能会通过AP-2使其转录水平上调。
不同物种间的CD146蛋白序列具有高度的统一性。如图1a所示,成熟的CD146蛋白包括一个胞外区、一个跨膜区和胞质尾区3部分。其胞外区含有特征性的免疫球蛋白结构域,包括2个可变区和3个恒定区(V-V-C2-C2-C2)。其胞质尾区含有潜在的蛋白激酶识别部位,CD146活化后,可通过其胞质区与p59fyn形成复合物。p59fyn作为Src家族激酶,促使酪氨酸激酶p125PAK磷酸化并增强其与桩蛋白(paxillon)的联系。
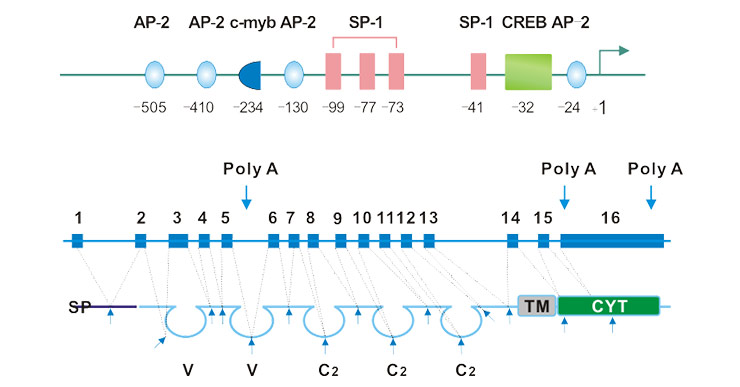
Fig. 1. Schematic representation of the exon–intron and promoter structure of the CD146 gene.
2. CD146的功能
前面有提到,C146又被称为MCAM。MCAM通常是作为层黏连单板α4的受体起作用,是血管壁中普遍存在的基质分子。也就是所说,MCAM可在血管壁组分细胞中高表达,包括血管内皮细胞、平滑肌细胞和周细胞。MCAM作为黏附分子中的一员,通过与其配体相互作用,介导细胞间及细胞与基质间的作用是黏附分子的基本功能特征。在CD146结构部分已经介绍,CD146活化后,可通过其胞质区与p59fyn形成复合物。活化的p59fyn可进一步引起酪氨酸激酶p125PAK磷酸化并与桩蛋白(paxillon)结合,这也表明CD146可通过其胞内结构域对细胞外到细胞内的信号进行传导和交流,有助于局部黏连聚集、细胞骨架重组、维持细胞结构和调节细胞的功能。
CD146除了具有黏附分子特性,最近的研究表明CD146在多种细胞生理过程中表现活跃,包括发育、信号转导、细胞迁移、间充质干细胞分化、血管生成和免疫应答。其中,目前研究最多的是参与肿瘤的血管形成和转移。肿瘤的生长和扩散转移与其微血管生成和数量增加密切相关,无论是原发肿瘤还是转移肿瘤在生长扩散过程中都依赖血管生成[8]。正常状态下,血管生成会处于平衡状态。这种平衡在肿瘤微环境中会被打破。目前,CD146调节肿瘤血管形成的机制可能包括激活基质金属蛋白酶2(MMP-2),该酶可降解基底膜和细胞外基质,激活生长因子,主要是血管内皮细胞生长因子(VEGF),有利于肿瘤转移和肿瘤血管形成[9]。
3. CD146信号通路
前面已经说过,CD146除了在细胞-细胞粘附中起作用外,CD146还参与内皮细胞外信号向胞内的信号传导,并参与肌动蛋白细胞骨架重排。这里,我们罗列了几条与CD146功能相关的信号通路。
3.1 CD146/ p125FAK
如图2所示,CD146通过其胞内区p59fyn(Src家族激酶)结合而启动蛋白激酶磷酸化级联反应。活化后的p59fyn会磷酸化PKC-γ的下游激酶,下游激酶的磷酸化会触发细胞内的Ca2+释放。这会进一步活化并诱导P130、Pyk2和桩蛋白的磷酸化及结合,同时促进p125FAK的活化,这一系列的反应会促进肌动蛋白的极化作用。这条CD146介导的信号通路解释了CD146促进正常细胞运动并通过将外部信号传递给下游信号蛋白进行细胞骨架重塑来增加肿瘤细胞侵袭性的机制[10][11]。

Figure 2. CD146 stimulates p125 (FAK) in human endothelial cells
3.2 CD146/Id-1
细胞传导中,CD146可上调Id-1基因表达,这一机制被认为是CD146促成黑素瘤转移的潜在机制。Id-1是包括黑素瘤在内的几种常见恶性肿瘤致癌基因。如图4所示,过表达的CD146可通过下调ATF-3来上调Id-1,ATF-3是Id-1的转录抑制因子[12][13]。但有关于CD146上调Id-1表达是存在于所有恶性肿瘤中还是仅限于黑素瘤目前尚不清楚。
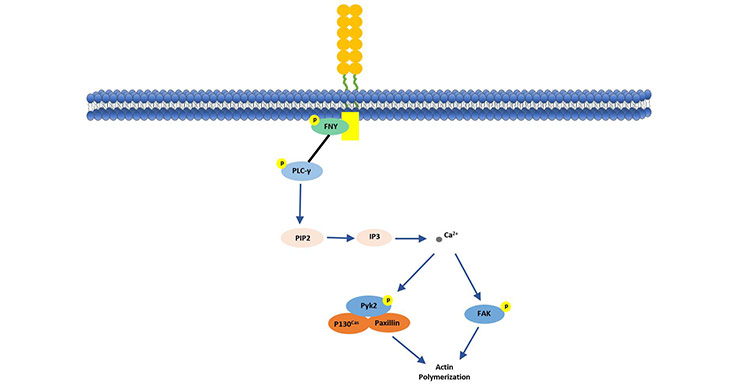
Figure3. Expression of Id-1 is regulated by CD146
3.3 CD146/NFκB/P38
目前,已有多项研究报道CD146是肿瘤血管生成的新靶点。这一结论引发了肿瘤研究者们对CD146诱导血管生成潜在机制的积极探索。相关研究表明,在CD146介导的信号通路中,CD146会在细胞表面形成CD146-CD146二聚体。过表达的CD146通过上调转录因子Slug来增强EMT。转录因子Slug可控制多个EMT相关元件(如MMP-9)的转录[14]。另外,除了作用于Slug,CD146还可以作为VEGF配体的共同受体与VEGFR-2结合,增强VEGFR / NFκB信号传导[15]。这个机制的发现为CD146在癌症转移中的关键作用进一步提供了明确的证据。
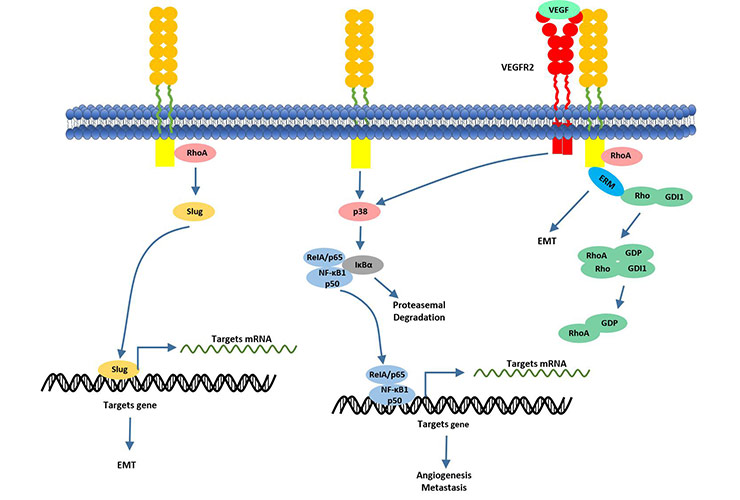
Figure4. CD146 actives NF-κB transcriptional factor via activating of P38 kinase
4. CD146与肿瘤
近些年来,人们对CD146与肿瘤的认识已经从黑色素瘤逐步扩展到了其他癌种,包括前列腺癌、肺癌、乳腺癌和绒毛膜上皮癌等等。
4.1 CD146与黑色素瘤
CD146最初是从人类黑素瘤细胞cDNA文库中克隆而来的。目前已在恶性黑色素瘤中开展了多项研究。在黑色素瘤形成过程中,由于转录因子AP-2(activator protein-2)的表达缺失,致使CD146基因中受AP-2调控的TATA和CAAT盒失控,G+C过度克隆,导致CD146过度表达。随着研究的进一步深入,研究者们发现并非所有的恶性黑色素瘤细胞系都有CD146表达。大约70%的黑色素瘤表达CDl46。皮肤黑色素瘤的恶性程度与其病灶的垂直厚度有着直接的关系。在原发性肿瘤中,CDl46的表达随垂直厚度增加而增加,在大多数进展期或转移的肿瘤中,CD146有较高表达,但在低转移性浅层肿瘤(厚度<0.75mm)中的表达率很低。
4.2 CD146与前列腺癌
前列腺癌的发病率位居世界男性恶性肿瘤之首,其病死率也仅次于肺癌而位居第二。近年来我国的前列腺癌的发病率呈上升趋势。Wu等在体外实验中,用半定量RT-PCR和 Western blot分析测定出CD146 mRNA及其蛋白在原代培养的前列腺上皮细胞和正常的前列腺腺体中表达较少,而在DUl45、PC-3、TSU-PR1 3种前列腺细胞株和前列腺上皮内瘤(PIN)中高表达。CD146在用4种细胞株中的表达与E-钙粘素和α-连接素的表达呈负相关。利用免疫组织化学的方法分析表明CDl46在PIN和前列腺癌中高表达。但CD146的表达在前列腺癌前病变和前列腺癌上皮中比在正常前列腺组织和良性前列腺增生更显著。其表达阳性程度与前列腺恶性转化和进展有关[16]。
4.3 CD146与乳腺癌
CD146在乳腺癌中的表达水平与其他肿瘤不同,已发表的报道中有不同观点。Shih等报道,正常及良性增生性乳腺导管上皮100%(14/14)表达CD146,乳腺癌组织仅有17%(12/72)表达CD146 [17]。乳腺癌中CD146低表达与黑色素瘤中CD146过表达恰恰相反。而在Zabouo等人的报道中表明,在人乳腺癌中,CD146的表达增强了乳腺癌细胞的侵袭能力,预示着患者的预后不良[18]。另外,在不同细胞类型肿瘤及不同独立研究中CD146的表达水平的不一致,这也反映了肿瘤生物学的总体复杂性。
References
[1] Johnson JP, Rothbacber U, et al. The progression associated antigen MUCl8: A unique member of the immunoglobulin supergone family [J]. Melanoma Ree. 1993, 3(5):337-340.
[2] Shih IM. The role of CDl46 (Mel-CAM) in biology and pathology [J]. J Pathol. 1999, 89(1):4-11.
[3] O. Vainio, D. Dunon, et al. an adhesion molecule expressed by c-kit+ hemopoietic progenitors [J]. J. Cell Biol. 1996, 135:1655-1668.
[4] K. Kohama, Y. Tsukamoto, et al. Molecular cloning and analysis of the mouse gicerin gene [J]. Neurochem. Int. 2005, 46: 465-470.
[5] C. Sers, K. Kirsch, et al. Genomic organization of the melanoma-associated glycoprotein MUC18: implications for the evolution of the immunoglobulin domains [J]. Proc. Natl. Acad. Sci. USA. 1993, 8514–8518.
[6] C.S. Mintz-Weber, J.P. Johnson. Identification of the elements regulating the expression of the cell adhesion molecule MCAM/MUC18. Loss of AP-2 is not required for MCAM expression in melanoma cell lines [J]. J. Biol. Chem. 2000, 275:34672-34680.
[7] Zhaoqing Wang, Xiyun Yan. CD146, a multi-functional molecule beyond adhesion [J]. Cancer Letter. 2013, 330:150-162.
[8] Satyamoorthy K, Muyrers J, et al. Mel-CAM-specific genetic suppressor elements inhibit melanoma growth and invasion through loss of gap junctional communication [J]. Oneogene. 2001, 20(34):4676-4684.
[9] Yan X, Lin Y, et al. A novel anti-CD146 monoclonal antibody, AA98, inhibitors angiogenesis and tumor growth [J]. Blood. 2003, 102(1):194-191.
[10] F. Anfosso, N. Bardin, et al. Activation of human endothelial cells via S-endo-1 antigen (CD146) stimulates the tyrosine phosphorylation of focal adhesion kinase p125 (FAK) [J]. J. Biol. Chem. 1998, 273: 26852–26856.
[11] F. Anfosso, N. Bardin, et al. Outside-in signaling pathway linked to CD146 engagement in human endothelial cells [J]. J. Biol. Chem. 276 (2001) 1564–1569.
[12] G. Li, J. Kalabis, et al. Bogenrieder, M. Herlyn, Reciprocal regulation of MelCAM and AKT in human melanoma [J]. Oncogene. 2003, 22:6891–6899.
[13] M. Zigler, G.J. Villares, et al. Expression of Id-1 is regulated by MCAM/MUC18: a missing link in melanoma progression [J]. Cancer Res. 2011, 71:3494–3504.
[14] Q. Zeng, W. Li, et al. CD146, an epithelial-mesenchymal transition inducer, is associated with triple-negative breast cancer [J]. Proc. Natl. Acad. Sci. USA. 2012, 109:1127-1132.
[15] N. Murukesh, C. Dive, et al. Biomarkers of angiogenesis and their role in the development of VEGF inhibitors [J]. Br. J. Cancer. 2010, 102: 8-18.
[16] Wu GJ, Peng Q, et al.Ectopical expression of hanum MUCl8 increases metastasis of human promate eAlnoer cells [J]. Gene. 2004, 327(2):20l-213.
[17] Shih lM, Hsu MY, et al. The cell-cell adhesion receptor Mel-CAM acts as a tumor suppressor in breast carcinoma [J]. Am J Pathol. 1997, 151(3):745-751.
[18] Zabouo G, lmbert AM, et al. CDl46 expression is associated with a poor prognosis in human breast tumors and with enhanced motility in breast cancer cell lines [J]. Breast Cancer Res. 2009, 11(1):R1-R14.
s上一篇: 线粒体内膜蛋白OMA1
下一篇: 关于甲状腺瘤,这些信息你必须知道!














