Virus-Like Particles (VLPs)技术平台
Virus-like particles (VLPs) 是一类类似于病毒的纳米级颗粒,它们的结构与真实病毒相似,但不含病毒基因,因此具有较高的生物安全性 [1]。近年来,VLP技术平台在生物技术领域得到了广泛关注,尤其在疫苗开发、药物载体、基因治疗和免疫调节等领域取得了显著进展 [2]。
1. VLP的结构与分类
VLPs是由病毒结构蛋白组装形成的颗粒,其大小和形状与天然病毒相似 [3]。根据其来源和结构特点,VLP可以分为多种类型,包括RNA病毒类、DNA病毒类和嵌合病毒类 [4]。VLPs具有天然病毒的免疫原性,但不具有感染性和复制能力,因此可以作为安全有效的疫苗载体 [5]。
2. VLP技术平台的生产方式
VLP技术平台可以通过多种宿主细胞系统进行生产,如昆虫细胞、哺乳动物细胞和植物细胞等 [6]。其中,昆虫细胞系统是最常用的生产方式,具有较高的生产效率和易于规模化生产的优势 [7]。此外,植物细胞系统也具有生产绿色、环保、低成本和快速响应流行病的优势 [8]。
哺乳动物细胞表达系统是VLP技术平台生产中的另一重要选择。相较于昆虫细胞和植物细胞系统,哺乳动物细胞表达系统更接近人体细胞的生理环境,因此在蛋白质翻译、修饰和折叠等方面具有更高的保真度。这使得在哺乳动物细胞中表达的VLP具有更接近天然病毒的免疫原性和生物活性 [9]。
常用的哺乳动物细胞表达系统包括CHO (Chinese Hamster Ovary) 细胞、HEK293 (Human Embryonic Kidney 293) 细胞和BHK (Baby Hamster Kidney) 细胞等。其中,CHO细胞是目前工业生产中最常用的哺乳动物细胞表达系统,具有较高的生产效率和可扩展性。然而,相较于昆虫细胞和植物细胞系统,哺乳动物细胞生产成本较高,且生产过程中可能存在病原体污染的风险 [10]。
j9九游会登录入口首页生物基于哺乳动物细胞表达系统的VLP技术平台,改进了生产工艺,可显著提高表达水平,减少细胞毒性。
3. VLPs在表达重组蛋白方面的优势
VLPs在表达重组蛋白方面具有多种优势,主要表现在以下几个方面:
高度模拟天然病毒结构:VLPs的大小、形状和病毒表面蛋白的空间构象与天然病毒非常相似 [11]。这使得VLPs能够高度模拟天然病毒在生物体内的行为,从而有效地诱导免疫应答。
安全性:由于VLPs不含病毒基因,因此不具有感染性和复制能力,具有较高的生物安全性 [12]。这使得VLPs成为疫苗研究和药物输送领域的理想候选物。
高免疫原性:VLPs的多价性和高度模拟天然病毒的表面蛋白使其具有高免疫原性。在疫苗研究中,VLPs可以有效地激活B细胞和T细胞免疫应答,从而产生强烈的免疫保护作用 [13]。
可塑性:通过基因工程手段,可以将外源抗原融合到VLPs的结构蛋白中,生成嵌合VLPs。这种设计使得外源抗原能够以VLPs的形式在体内呈现,从而提高免疫原性 [14]。
多样性:VLPs可以通过多种宿主细胞系统进行生产,包括细菌、酵母、昆虫细胞、哺乳动物细胞和植物细胞等。这为实现VLPs在不同领域的应用提供了广泛的选择 [15]。
可以看出,VLPs在表达重组蛋白方面具有诸多优势,使其在疫苗研究、药物输送和免疫调节等领域具有广泛的应用潜力。
4. VLPs在表达跨膜蛋白方面的优势
VLPs在表达跨膜蛋白方面具有显著的优势,主要表现在以下几个方面:
空间构象保持:跨膜蛋白具有复杂的三维结构,其功能通常依赖于在细胞膜上正确的空间构象。与其他表达系统相比,VLPs能够更好地模拟天然病毒的膜环境,有助于维持跨膜蛋白的正确空间构象和生物活性 [16]。
蛋白质翻译与修饰:VLPs可以通过哺乳动物细胞表达系统进行生产,这种系统在蛋白质翻译、折叠和修饰方面具有较高的保真度,有助于跨膜蛋白的正确表达和功能 [17]。
免疫原性增强:VLPs可以作为免疫原递送载体,将跨膜蛋白以天然病毒的形式呈现给免疫系统。这种方法可以提高跨膜蛋白的免疫原性,激发更强烈的免疫应答 [18]。
功能性筛选:利用VLPs表达跨膜蛋白,可以方便地进行功能性筛选,如跨膜蛋白亲和力的测定或者抗体亲和力的优化。这有助于研究跨膜蛋白的生物学功能和开发相关药物 [19]
VLPs在表达跨膜蛋白方面的优势,有助于解决跨膜蛋白研究中的关键问题,如蛋白质表达、功能性筛选和免疫原性等。
5. j9九游会登录入口首页生物VLPs技术平台
j9九游会登录入口首页生物专门搭建了基于HEK293表达系统的包膜VLP技术平台,所制备的包膜VLP在其固有的囊泡膜上显示正确折叠的多次跨膜蛋白,展示完整的生物活性。
平台优势:
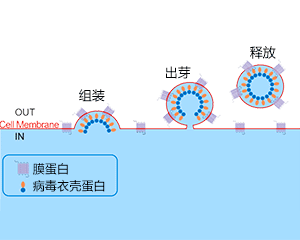
- 展示多次跨膜蛋白的天然构象,具有完整生物活性
- 可提高免疫原性,打破机体自身的免疫耐受
- 包膜VLP中靶抗原丰度高于过表达细胞
- 大小为30-300nm,可用于各种展示库筛选
- 可用于免疫/ELISA/SPR/BLI/CAR-T阳性率检测,助力于先导分子发现
案例展示:
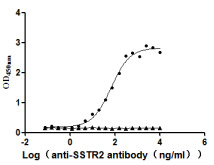
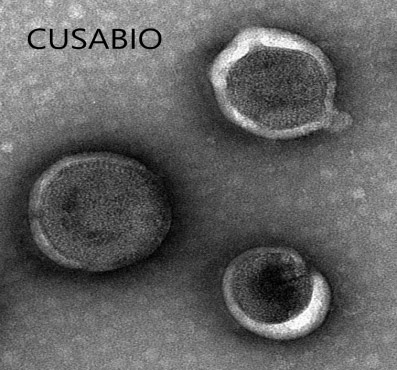
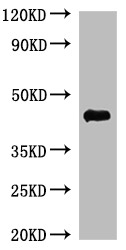
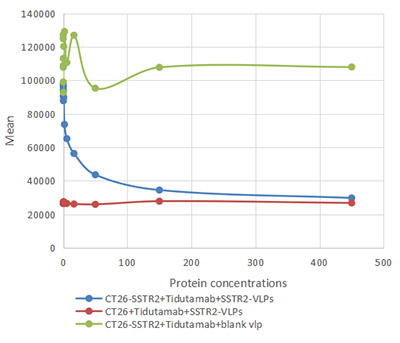
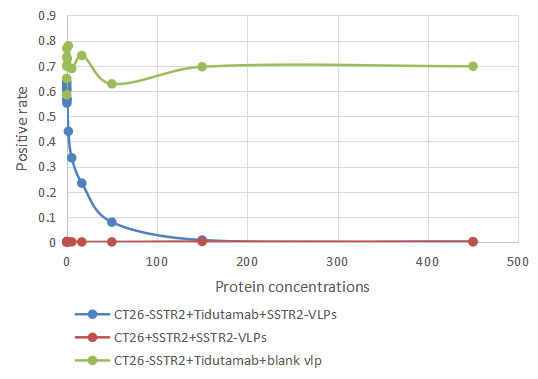
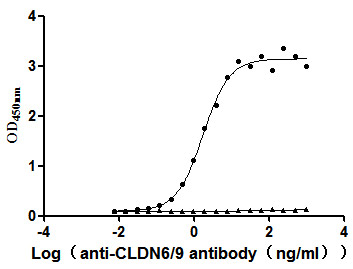
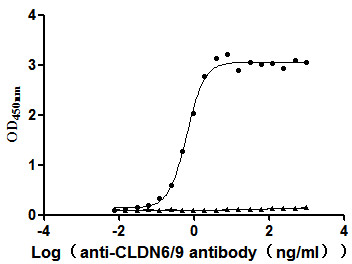
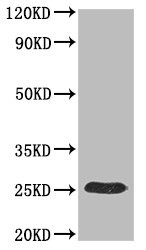
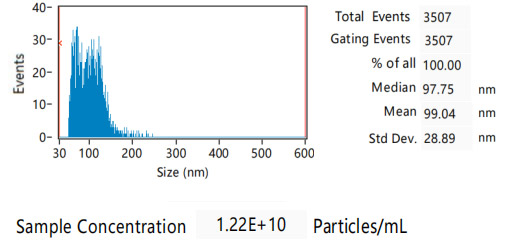

更多VLP表达重组蛋白产品:
参考文献:
[1] Roldão, A., et al. (2010). Virus-like particles in vaccine development. Expert Review of Vaccines, 9(10), 1149-1176.
[2] Naskalska, A., Pyrc, K. (2015). Virus like particles as immunogens and universal nanocarriers. Polish Journal of Microbiology, 64(1), 3-13.
[3] Lua, L. H., et al. (2014). Bioengineering virus-like particles as vaccines. Biotechnology and Bioengineering, 111(3), 425-440.
[4] Noad, R., & Roy, P. (2003). Virus-like particles as immunogens. Trends in Microbiology, 11(9), 438-444.
[5] Grgacic, E. V., & Anderson, D. A. (2006). Virus-like particles: passport to immune recognition. Methods, 40(1), 60-65.
[6] Vicente, T., et al. (2011). Large-scale production and purification of VLP-based vaccines. Journal of Invertebrate Pathology, 107, S42-S48.
[7] Mena, J. A., & Kamen, A. A. (2011). Insect cell technology is a versatile and robust vaccine manufacturing platform. Expert Review of Vaccines, 10(7), 1063-1081.
[8] Yusibov, V., et al. (2011). Clinical development of plant-produced recombinant pharmaceuticals: vaccines, antibodies and beyond. Human Vaccines, 7(3), 313-321.
[9] Swartz, J. R. (2012). Advances in Escherichia coli production of therapeutic proteins. Current Opinion in Biotechnology, 12(2), 195-201.
[10] Wurm, F. M. (2004). Production of recombinant protein therapeutics in cultivated mammalian cells. Nature Biotechnology, 22(11), 1393-1398.
[11] Bachmann, M. F., & Jennings, G. T. (2010). Vaccine delivery: a matter of size, geometry, kinetics and molecular patterns. Nature Reviews Immunology, 10(11), 787-796.
[12] Plummer, E. M., & Manchester, M. (2011). Viral nanoparticles and virus-like particles: platforms for contemporary vaccine design. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 3(2), 174-196.
[13] Roldão, A., Mellado, M. C. M., Castilho, L. R., Carrondo, M. J. T., & Alves, P. M. (2010). Virus-like particles in vaccine development. Expert Review of Vaccines, 9(10), 1149-1176.
[14] Lua, L. H. L., Connors, N. K., Sainsbury, F., Chuan, Y. P., Wibowo, N., & Middelberg, A. P. J. (2014). Bioengineering virus-like particles as vaccines. Biotechnology and Bioengineering, 111(3), 425-440.
[15] Grgacic, E. V. L., & Anderson, D. A. (2006). Virus-like particles: passport to immune recognition. Methods, 40(1), 60-65.
[16] Brune, K. D., & Howarth, M. (2018). New routes and opportunities for modular construction of particulate vaccines: stick, click, and glue. Frontiers in Immunology, 9, 1432.
[17] Castilho, A., Beihammer, G., Pfeiffer, C., & Goritzer, K. (2018). An in planta-produced fusion protein eliciting robust antibody response against the major grass pollen allergens Phl p 1 and Phl p 5a. Plant Biotechnology Journal, 16(10), 1736-1745.
[18] Noad, R., & Roy, P. (2003). Virus-like particles as immunogens. Trends in Microbiology, 11(9), 438-444.
[19] Schwarz, B., & Douglas, T. (2015). Development of virus-like particles for diagnostic and prophylactic biomedical applications. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 7(5), 722-735.
[20] Chroboczek, J., Szurgot, I., & Szolajska, E. (2014). Virus-like particles as vaccine. Acta Biochimica Polonica, 61(3), 531-539.











