Oct4--胚胎干细胞多能性的看门人
日期:2019-10-21 15:41:55
Oct4(Octamer-binding transcription factor)因能与八聚体模体的DNA结合而命名,也被称为Oct3、POU5F1、Oct-3/4、Otf3或NF-A3,由Pou5f1基因编码,属于POU转录因子家族第Ⅴ亚家族。Oct4是胚胎干细胞多能性的看门人,对于维持胚胎干细胞的多潜能性和自我更新具有极其重要的作用,也是产生诱导多能干细胞的必要因子。此外,Oct4在多种肿瘤中高表达,Oct4可能参与恶性肿瘤的发生发展过程。
1. Oct4的组织特异性
Oct4表达于发育中的大脑,在皮质、嗅球、海马和小脑的特定细胞层中有高水平的表达。此外,Oct4基因还主要表达于胚胎干细胞、胚胎生殖细胞和胚胎/生殖细胞肿瘤。Oct4虽然在成人组织中表达水平较低,但其广泛表达于各种成体干细胞,主要包括:
- 乳腺、胰腺、胃、肝、肾和间充质等组织来源的干细胞;
- 外周血、乳房上皮、子宫内膜和毛囊滤泡等的祖细胞;
- 多能前体细胞等。
在体外,Oct4在未分化的胚胎干细胞(ES)、胚胎癌(EC)细胞和胚胎生殖细胞中高表达。随着这些细胞的分化,Oct4的表达下调[1]。
在人类,从未受精的卵母细胞到未压实的桑葚胚,Oct4 mRNA表达于胚胎发育的各个阶段[2]。
2. 什么是Oct4基因?
Oct4由Pou5fl基因编码产生,定位于人类染色体6p21.3,是转录因子家族POU中的一员。Oct4具有多个转录起始位点,转录不同的mRNA亚型(Isoform),从而翻译成多种蛋白质。
2.1 Oct4基因的亚型
人类Oct4基因通过选择性剪切可以产生三种亚型:Oct4A、Oct4B、Oct4B1[3] [4]。Oct4可翻译成四种蛋白亚型(Oct4A、Oct4B-190、Oct4B-265和Oct4B-164)[5]。
2.1.1 Oct4A
Oct4A转录物包含外显子1、2b、2d、3和4,其中外显子1是Oct4A的特有部分。
Oct4A由360个氨基酸组成,主要表达于未分化细胞的胞核,是多能干细胞特异转录因子,与细胞的未分化性状有关。
2.1.2 Oct4B
Oct4B包含外显子2a、2b、2d、3和4。与Oct4A相比,Oct4B无外显子1而特有外显子2a。
Oct4B由265个氨基酸组成,表达于多种非多能细胞的胞质,如终末分化的外周血单核细胞、膀胱肿瘤细胞等。Oct4B与Oct4A拥有相似的POU结合区域和羧基末端,但在氨基末端的转录激活区域存在差异[6]。Oct4B的氨基末端抑制与DNA的结合,并抑制Oct4激活物激活其转录的活性,从而失去对细胞多能性的调节功能。
2.1.3 Oct4B1
Oct4B1转录物和Oct4B高度相似,但含有额外的外显子2c。
OctB1主要表达于人ESC和胚胎癌细胞(embryonal carcinoma cell,ECC),随着细胞分化,表达迅速下调。
OctB1与Oct4B有相同的氨基末端和部分POU结合区域,其余的氨基酸序列不同。Oct4B1可增强细胞的抗凋亡潜能,调节细胞的多能状态。此外,Oct4B1与肿瘤的进展有关。
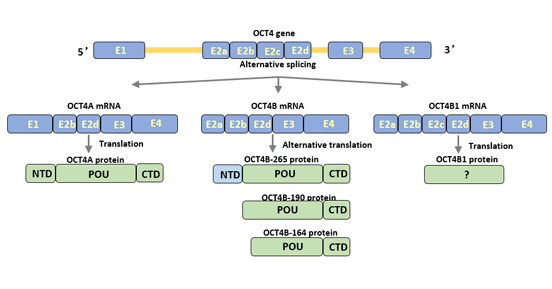
图1 Oct4基因的亚型及其结构
2.2 Oct4基因结构
Oct4 Isoform 1是转录的主要亚型之一,具有5个外显子,4个内含子,该基因编码的蛋白包含324个氨基酸,长度约为16.40Kb,相对分子量为18Kd。
Oct4包括3个结构域:N-转录域、POU结合域和C-转录域。
N端区域:该区域是转录激活区域,富含脯氨酸,具有与DNA的结合和激活转录功能,有助于稳定生物分子结构、降低细胞酸性及调节细胞氧化还原势等;
POU结合域:是一个保守的DNA结合结构域,它能与含八聚体基序(octamer motif)的DNA结合从而调控下游靶基因的转录。
POU结合域包含两个亚单位:N端和C端,N端是POU家族特有的保守结构域(POUs),富含脯氨酸和酸性残基;C端是传统的同源异型结构域(POUh),富含脯氨酸、丝氨酸和苏氨酸残基;POUs和POUh之间由连接肽相连。
C端区域:富含丝氨酸/苏氨酸,控制Oct4A在不同细胞类型中的反式激活功能。
2.3. Oct4假基因
目前共发现6个Oct4假基因,分别为Oct4pg1、Oct4pg2、Oct4pg3、Oct4pg4、Oct4pg5、Oct4pg6。这些假基因与Oct4 mRNA具有高度同源性,但并无Oct4的功能。Oct4假基因的存在能引起实验结果的假阳性,给肿瘤和干细胞Oct4的研究带来一定的困扰。
3. Oct4基因的调节
Oct4基因的上游调控元件包括一个近端增强子(PE)和远端增强子(DE),它们在不同发育阶段起不同作用。如近端增强子作用于外胚层干细胞时,远端增强子则作用于内细胞团、原始生殖细胞以及胚胎干细胞[7]。很多因子通过作用于这两个调控元件,来调节Oct4的表达,例如孤儿核受体超家族因子可以与PE结合,影响Oct4的表达。
此外,一些物质也可直接与Oct4启动子发生作用,参与Oct4的表达活化,比如说Paf1复合物。它作为Oct4的激活子,在维持胚胎干细胞Oct4的转录活化方面发挥重要作用。
Oct4还受到Sox2的调节。Sox2通过直接或者间接方式调节Oct4的表达,进而影响胚胎干细胞的多潜能性。
哺乳动物中主要通过磷酸化或磺酰化对Oct4蛋白活性进行调控。
比如说,通过蛋白激酶A和/或ERK MAPK磷酸化Oct4蛋白POU结合域中高度保守的残基Ser 229(小鼠)或Ser 236(人类)[8],可在空间上阻碍了DNA结合和同型二聚体组装。
Oct4参与多条信号通路的调节,包括转化生长因子(transforming growth factor,TGF)β通路、成纤维细胞生长因子(fibroblast growth factor,FGF)通路、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)通路、Wnt通路等。在心脏中胚层特定分化过程中,TGF-β信号通路与经典的Wnt信号通路联合诱导Oct4的产生[9]。
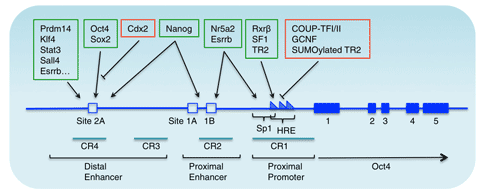
图2 小鼠Oct4基因的基因组结构和转录调控[10]
4. Oct4的功能
Oct4通过与启动子或增强子区域内的八聚体元件(ATGCAAAT)结合来调控靶基因的表达[11] [12]。这些靶基因主要包括YES1、FGF4、UTF1、ZFP206等控制哺乳动物胚胎发育相关的基因。通过调控其下游的靶基因而参与正常发育过程,尤其在早期胚胎发育中起重要作用。此外,Oct4的表达与干细胞的多能性有关。
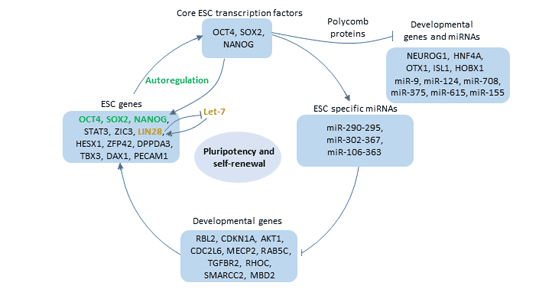
图3 Oct4的功能
4.1 Oct4与胚胎发育
胚胎干细胞(embryonic stem cell,ESC)是一类具有自我更新能力和多向分化潜能的细胞,它能够分化形成机体的各种类型的组织细胞。
Oct4是ESC中重要的转录因子,在维持ESC的多能性和自我更新能力方面发挥着举足轻重的作用。
Oct4通过激活多能性相关基因和抑制分化相关基因的表达,保持ESC的自我更新和维持其未分化状态。
Oct4在体内并非单独起作用,它与Nanog、Sox2共同构成了多能性调控网络的核心。并被认为位于细胞全能性调控网络的顶端。这三种转录因子结合到自身基因的启动子上[13],并激活自身基因的表达。
一方面,它们能激活那些与维持ES细胞自我更新相关基因的转录。比如Dppa4、Tdgf1、Oct4、Nanog和Lefty2均受Oct4、Sox2和Nanog的正向调控,并优先在ES细胞中表达。
另一方面,Oct4,Sox2和Nanog共同占据了分化和发育相关基因的启动子,并促进其失活[14]。
4.1.1 Oct4剂量对细胞命运的影响
Oct4作为转录调节因子在转录过程中具有双重调节作用(转录抑制和转录激活),既能维持干细胞的未分化状态,又能控制它向某一种细胞类型分化。
在胚胎发育过程中,Oct4的水平决定干细胞的分化或去分化,ES细胞的命运由Oct4的表达量精确调控。Oct4过表达时,胚胎干细胞分化为原始内胚层和中胚层细胞;当Oct4表达水平低时,ES细胞丧失多能性并分化为滋养层细胞;只有Oct4表达适量,胚胎干细胞才能维持其自我更新状态。
研究发现,缺乏Oct4的胚胎只能发育到囊胚阶段,其内细胞团细胞不具有多能性,而只能分化为滋养层细胞。并且该囊胚在植入时死亡[15]。
在成体干细胞,Oct4维持多能性的调节机制与ESC类似。
4.2 延缓细胞老化
Oct4基因能够阻止或者至少延迟老化的效果,或将给老龄化研究带来重大影响。Oct4基因在所有生物体的发育中有着重大意义,并且在细胞的一生中都保持活跃,它能保护血管内的动脉粥样硬化斑块,这些斑块的破碎就是心脏病和中风的根本原因。
4.3 Oct4在重新编程中的作用
通常认为细胞状态转变是从分化程度较低的状态转变为分化程度更高的状态,但研究表明,从体细胞到原始态多能性(naive pluripotency)的细胞状态转变也是可能的。该过程由Oct4,Sox2,Klf4和c-Myc等转录因子的过表达诱导。
其中Oct4被认为是重编程中不可缺少的核心转录因子。Oct4可调节细胞状态转变,如多能性的建立和胚胎生殖系的分化。Oct4过表达可产生诱导多能干细胞(iPS)。诱导多能干细胞(iPS)是从不同种类和类型的体细胞中获得的。
在上皮间质转化过程中,Oct4可通过抑制TGFβR3和TGFβ3以及激活miR-200 miRNA家族,从而能分别抑制上皮-间充质转化(EMT)调节因子Snail和Zeb2,最终促进间充质到上皮的转化(MET)。
在重编程过程中,Oct4、Sox2、Klf4起先锋作用。外源性OCT4A等重编程因子可直接或间接沉默体细胞基因,激活多能性基因。内源性OCT4A等多能基因可维持诱导多能干细胞的多能状态。
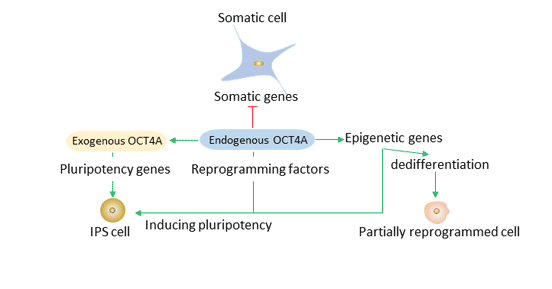
图4 Oct4在重新编程中的作用
4.4 Oct4和致瘤性
Oct4在胚胎生殖细胞肿瘤和成体细胞肿瘤中均存在高表达,这表明Oct4可能参与恶性肿瘤的发生发展过程。
Nanog和Oct4在乳腺癌组织中高度表达[16]。Oct4的表达与前列腺癌的分化程度相关[17]。Nanog、Oct4和CD133在口腔鳞状细胞癌中的高表达与患者的临床预后差相关。Oct4的表达是维持部分肺癌细胞具有干细胞样特性的关键所在[18]。
多个研究表明Nanog和Oct4在多种无限制、低分化、具有侵袭性的实体肿瘤中过度表达,且其表达下调可能抑制肿瘤的发生发展过程[19]。
Oct4过表达可导致不同类型癌症的致瘤性、肿瘤转移,甚至放化疗后远处复发[20] [21]。
因此,若以Oct4基因作为靶点,抑制它们的表达,降低肿瘤细胞的自我更新能力,那么肿瘤治疗可能取得理想疗效。
研究表明Oct4可能参与维持肿瘤干细胞的存活,沉默Oct4有望成为肿瘤干细胞靶向治疗的新途径。
Oct4在维持肿瘤干细胞的多能性和自我更新方面有重要作用,因此Oct4对肿瘤生长、转移和复发有重大影响。有研究表明,Oct4在人乳腺癌细胞系7(MeF7)细胞中高表达,通过RNAi技术沉默Oct4可促使肿瘤干细胞的凋亡。
References
[1] Cauffman G, Van de Velde H, Liebaers I, et al. Oct-4 mRNA and protein expression during human preimplantation development [J]. Molecular human reproduction, 2004, 11(3): 173-181.
[2]Hansis C, Grifo J A, Krey L C. Oct-4 expression in inner cell mass and trophectoderm of human blastocysts [J]. Molecular human reproduction, 2000, 6(11): 999-1004.
[3]Takeda J, Seino S, Bell G I. Human Oct3 gene family: cDNA sequences, alternative splicing, gene organization, chromosomal location, and expression at low levels in adult tissues [J]. Nucleic acids research, 1992, 20(17): 4613-4620.
[4]Atlasi Y, Mowla S J, Ziaee S A M, et al. OCT4 spliced variants are differentially expressed in human pluripotent and nonpluripotent cells [J]. Stem cells, 2008, 26(12): 3068-3074.
[5]Wang X, Dai J. Concise review: isoforms of OCT4 contribute to the confusing diversity in stem cell biology [J]. Stem cells, 2010, 28(5): 885-893.
[6]Cauffman G, Liebaers I, Van Steirteghem A, et al. POU5F1 isoforms show different expression patterns in human embryonic stem cells and preimplantation embryos [J]. Stem cells, 2006, 24(12): 2685-2691.
[7]Shi G, Jin Y. Role of Oct4 in maintaining and regaining stem cell pluripotency [J]. Stem cell research & therapy, 2010, 1(5): 39.
[8]Brumbaugh J, Hou Z, Russell J D, et al. Phosphorylation regulates human OCT4 [J]. Proceedings of the National Academy of Sciences, 2012, 109(19): 7162-7168.
[9]Li Y, Yu W, Cooney A J, et al. Brief report: Oct4 and canonical Wnt signaling regulate the cardiac lineage factor Mesp1 through a Tcf/Lef-Oct4 composite element [J]. Stem cells, 2013, 31(6): 1213-1217.
[10] Wu G, Sch?ler H R. Role of Oct4 in the early embryo development [J]. Cell regeneration, 2014, 3(1): 7.
[11] Sch?ler, H.R, Balling R, Hatzopoulos A K, et al. Octamer binding proteins confer transcriptional activity in early mouse embryogenesis [J]. The EMBO Journal, 1989, 8(9):2551-2557.
[12]YOUNGILYEOM, Ha H, Balling R, et al. Structure, expression and chromosomal location of the Oct-4 gene [J]. Mechanisms of Development, 1991, 35(3): 171-179.
[13]Niwa H. How is pluripotency determined and maintained? [J]. Development, 2007, 134(4): 635-646.
[14]Christophersen N S, Helin K. Epigenetic control of embryonic stem cell fate [J]. Journal of Experimental Medicine, 2010, 207(11): 2287-2295.
[15]Chambers I, Tomlinson S R. The transcriptional foundation of pluripotency [J]. Development, 2009, 136(14): 2311-2322.
[16] Liu C, Lu Y, Wang B, et al. Clinical implications of stem cell gene Oct-4 expression in breast cancer [J]. Annals of surgery, 2011, 253(6): 1165-1171.
[17]Miyazawa K, Tanaka T, Nakai D, et al. Immunohistochemical expression of four different stem cell markers in prostate cancer: High expression of NANOG in conjunction with hypoxia?inducible factor?1α expression is involved in prostate epithelial malignancy [J]. Oncology letters, 2014, 8(3): 985-992.
[18]Chen Y C, Hsu H S, Chen Y W, et al. Oct-4 expression maintained cancer stem-like properties in lung cancer-derived CD133-positive cells [J]. PloS one, 2008, 3(7): e2637.
[19]Huang Z J, You J, Luo W Y, et al. Reduced tumorigenicity and drug resistance through the downregulation of octamer-binding protein 4 and Nanog transcriptional factor expression in human breast stem cells [J]. Molecular medicine reports, 2015, 11(3): 1647-1654.
[20]Koo B S, Lee S H, Kim J M, et al. Oct4 is a critical regulator of stemness in head and neck squamous carcinoma cells [J]. Oncogene, 2015, 34(18): 2317.
[21]Boumahdi S, Driessens G, Lapouge G, et al. SOX2 controls tumour initiation and cancer stem-cell functions in squamous-cell carcinoma [J]. Nature, 2014, 511(7508): 246.
下一篇: 同源盒转录因子-NANOG














