共刺激/共抑制双重作用:B7-H3是“敌”是“友”?
日期:2019-11-29 11:32:16
在细胞免疫反应中,T细胞的增殖和活化不仅需要T细胞受体TCR识别APC或肿瘤细胞表面MHC提呈的第一信号,还需要共刺激分子提供的第二信号[1]。B7-CD28超家族是目前发现的共刺激分子家族之一,属于免疫球蛋白超家族。B7家族分子可提供刺激信号来增强和维持T细胞免疫应答,也可产生抑制信号来限制和减弱T细胞免疫反应。因此该家族在肿瘤疾病、器官移植和自身免疫病中发挥重要作用。
根据功能,B7家族可以分为3类[2]。
第二组:B7-H1 (PD-L1)和B7-DC (PD-L2)
第三组:B7-H3(CD276)和B7-H4 (B7x)组成。它们的受体尚未被确定,但被认为参与了共刺激和共抑制途径。
表1 B7家族成员列表
| B7分子 | 别名 | 受体 | 功能 |
|---|---|---|---|
| B7-1 | CD80 | CD28, CTLA-4 | 刺激 |
| B7-2 | CD86 | CD28, CTLA-4 | 刺激 |
| B7-H2 | ICOS-L | ICOS, CD28, CTLA-4 | 刺激 |
| B7-H1 | PD-L1, CD274 | PD-1, CD80 | 抑制 |
| B7-DC | PD-L2, CD273 | PD-1 | 抑制 |
| B7-H3 | CD276 | TLT-2(小鼠) | 刺激/抑制 |
| B7-H4 | B7x, B7S1 | / | 刺激/抑制 |
1. 什么是B7-H3?
B7-H3(B7 homolog 3 protein)又名CD276,是B7-CD28家族重要的免疫检查点分子。它是Chapoval 等人于2001年在人树突状细胞cDNA文库中鉴定到的B7家族成员[3]。B7-H3主要以膜蛋白和可溶形式存在,可溶的B7-H3(soluble B7-H3, sB7-H3)由膜蛋白经金属蛋白酶剪切而来[4]。此外,在外泌体和其他胞外小泡中也发现了B7-H3蛋白。
B7-H3是一种T细胞共抑制分子,具有部分共刺激功能。B7-H3可有效抑制T细胞和NK细胞功能,对骨发育也有作用。
B7-H3在多种恶性肿瘤中均有表达,与恶性肿瘤的生长、转移、复发、预后不良等因素密切相关。B7-H3可下调T辅助1型介导的免疫反应抑制CD4+T细胞活化,并抑制细胞因子的产生,因而可能发挥促进癌细胞免疫逃逸的作用。
2. B7-H3的结构
B7-H3是由316个氨基酸组成的I型跨膜糖蛋白,分子量为45-66 kDa,其与B7-H1(PD-L1)有相似的分子结构。它包含一个推定的28AA信号肽,一个由免疫球蛋白恒定(IgC)和可变(IgV)结构组成的217AA细胞外区域,一个跨膜区域和45个氨基酸的胞质结构域。该基因由10个外显子组成,其中4 - 7个外显子编码胞外IgV- IgC结构域。
目前发现B7-H3有两种存在形式:2Ig-B7-H3和4Ig-B7-H3。2Ig-B7-H3表达于鼠与人的细胞中,其有细胞外的IgV-IgC结构;4Ig-B7-H3仅表达于人细胞中,由串联重复的IgV-IgC-IgV-IgC结构组成。人类B7-H3的主要存在形式为4IgB7-H3,位于15号染色体。小鼠B7-H3基因则位于第9号染色体[5]。B7-H3是进化最保守的B7家族成员之一,因为它在从硬骨鱼类到哺乳动物的各种物种中普遍表达。
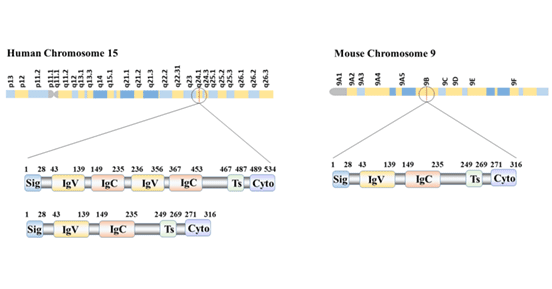
图1 B7-H3的结构和亚型
3. B7-H3的组织特异性
B7-H3转录本广泛表达于心脏、肝脏、胎盘、前列腺、睾丸、子宫、胰腺、小肠和结肠等组织。而B7-H3蛋白的表达更多地局限于细胞表面,例如活化的树突状细胞、单核细胞、T细胞、B细胞和NK细胞[6]。
B7-H3异常髙表达于多种癌细胞或组织中,包括胃癌、肺癌、前列腺癌、肾癌、胰腺癌、卵巢癌、乳腺癌、子宫内膜癌、肝癌、结肠直肠癌、口腔癌、膀胱癌、骨肉瘤及血液系统恶性疾病。
调节B7-H3表达的分子机制尚不清楚,但B7-H3蛋白的表达与miR-29水平成反比,且B7-H3上的miR-29结合位点在进化中是保守的。
4. B7-H3及其受体
人类B7-H3的受体尚未被发现。但在小鼠模型中,一个在髓样细胞(TREM)受体家族中表达的触发受体TLT-2被认为是小鼠B7-H3的一个潜在的受体[7]。
TLT-2是一种I型跨膜蛋白,具有单个IgV结构域,一个跨膜区域和一个短细胞质尾巴[8][9]。其中,IgV结构域具有两个潜在的N-糖基化位点,一个富含丝氨酸/苏氨酸的区域和多个预测的O-连接糖基化位点。人和小鼠TLT-2蛋白与80%相似的Ig域具有60%的同源性。
TLT-2已被证明是B7-H3的共刺激TCR。通过与B7-H3相互作用,将TLT-2转导至T细胞,导致IL-2和IFN-γ产生增加。用抗B7-H3或TLT-2的mAb阻断B7-H3和TLT-2之间的相互作用可有效抑制CD8 + T细胞介导的接触超敏反应[7]。
5. B7-H3与免疫反应
T细胞:B7-H3在免疫系统中可能发挥双重作用。一方面,B7-H3作为一种共刺激分子,对CD4+和CD8+细胞具有共刺激作用,诱导细胞免疫,并在T细胞受体信号传导下选择性增强干扰素-γ(IFNG)的产生。
另一方面,在人类和小鼠中的实验证明,B7-H3也具有共抑制作用[10],它可以抑制Treg细胞,从而使肿瘤逃逸免疫反应。这可能与NFAT、NF-κB和AP-1因子相关[11]。
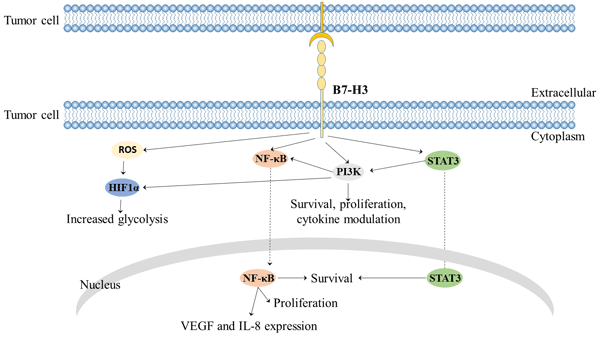
图2 B7-H3介导的信号通路
NK细胞:B7-H3可抑制组织培养中的NK细胞活性,从而降低NK细胞的功能。这表明NK细胞上应该有B7-H3的受体。
在神经胶质瘤中,较高的肿瘤等级与较高的B7-H3表达百分比相关。可溶性B7-H3和细胞结合的B7-H3均能够抑制NK细胞介导的裂解。
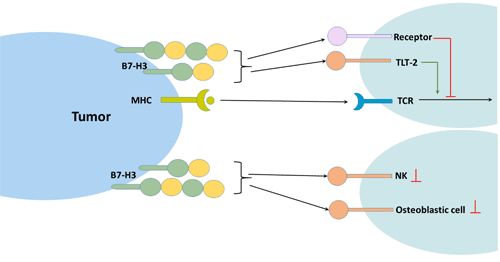
图3 B7-H3与免疫反应
6. B7-H3与肿瘤
B7-H3通过对T细胞的抑制作用,在肿瘤免疫逃逸中发挥重要作用,此外,它在非免疫系统中也起了重要作用。研究表明B7-H3参与了癌细胞转移潜能的调节,还可能影响肿瘤的増殖、侵袭等生物学特征。
B7-H3在膀腺癌、前列腺癌、黑色素瘤等肿瘤细胞系中的高表达被证明可促进肿瘤细胞的侵袭和转移。在黑素瘤细胞中,沉默B7-H3可降低细胞的基质凝胶侵袭能力。这可能是因为B7-H3沉默可降低与转移相关的蛋白的表达,例如基质金属蛋白酶(MMP)-2,信号转导和转录激活因子3(STAT3)以及分泌的白介素8(IL-8)的水平。
B7-H3分子在肺癌、大肠癌、膜腺癌等癌组织中高表达,并与肿瘤的扩散或预后较差具有相关性。
6.1 B7-H3与非小细胞肺癌(non-small cell lung cancer, NSCLC)
B7-H3在多种不同的非小细胞肺癌细胞系中表达[12]。对NSCLC患者的研究表明B7-H3对NSCLC的免疫系统具有抑制作用[13]。
B7-H3蛋白的高表达与预后差有关[14],而且B7-H3还可通过诱导单核细胞发展成抗炎细胞最终参与NSCLC的进展[15]。
B7-H1(CD80)和B7-H3之间的表达呈正相关,且它们的表达与NSCLC淋巴结转移有明显的相关性。B7-H3可能是一种潜在的诊断NSCLC侵袭和转移的标志物,不过还需要大量的临床数据来证明。
6.2 B7-H3与泌尿系统肿瘤
B7-H3在前列腺癌中异常表达,B7-H3可在前列腺癌细胞系PC-3的增殖、侵袭过程中起到作用[16],此外,B7-H3还可通过调节Treg细胞来抑制免疫反应,从而介导肿瘤逃逸免疫反应。较高的B7-H3表达与放疗后生化复发风险增加有关[17]。
此外,B7-H3在肾细胞癌肿瘤组织中和血管周围的肿瘤中高表达,在肾细胞癌中miR-187过表达可能通过降低B7-H3的mRNA水平,从而抑制肿瘤的增殖和转移[18]。
6.3 B7-H3与乳腺癌
在乳腺癌患者中,miR-29c能有效的抑制B7-H3表达[19]。
在小鼠乳腺癌模型的研究中发现,B7-H3通过活性氧簇来促进缺氧诱导因子-1(HIF1α)的稳定,进而促进肿瘤摄取葡萄糖及生长[20]。
B7-H3在原发性肿瘤中的表达与肿瘤大小和淋巴管的侵袭有显著的相关性。B7-H3是未来诊断乳腺癌的潜在检测因子[21]。
6.4 B7-H3与颅内肿瘤
B7-H3已被证实在大多数恶性神经外胚层肿瘤中有表达,B7-H3表达水平与组织学肿瘤分级呈正相关[22]。
6.5 B7-H3与肝细胞癌
在肝细胞癌组织中B7-H3表达明显增强,且与复发风险增高、病理类型差和预后不良有关。它的作用机制可能是B7-H3使肿瘤逃避T细胞相关的免疫反应。B7-H3所介导的STAT3信号通路可能通过诱导肿瘤相关巨噬细胞M2型极化,从而加速肝细胞癌的疾病进展。B7-H3在肝细胞癌患者血液中表达异常增高[23],证明了其在肝细胞癌中早期诊断及判断预后方面的重要作用。
7. 针对B7-H3的免疫疗法
B7-H3在多种肿瘤组织中高表达,并与肿瘤的进展密切相关。B7-H3胞质内的尾巴很短,没有已知的信号基序,其受体尚未被识别。尽管如此,B7-H3分子还是被认为是一种具有前景的免疫治疗研究方向。
目前的靶向治疗大多把B7-H3视为肿瘤中T细胞介导的免疫反应的负调节剂,对B7-H3的特异性阻断可提供一种类似于抗CTLA-4 mAb疗法的靶向治疗新方法。
B7-H3的人类癌症免疫治疗策略主要包括:
- 用mAb阻断B7-H3,中和T细胞,NK细胞及其他免疫细胞中的抑制性信号。
- NK细胞和其他免疫细胞的Fc受体参与引发B7-H3特异性ADCC,诱导肿瘤细胞死亡。
- CD3/B7-H3双特异性抗体与肿瘤表达的B7-H3结合,交联TCR复合物的CD3部分,激活肿瘤微环境中的T细胞,导致肿瘤细胞死亡。
- 小分子抑制剂可结合于B7-H3的特定区域,如IgV域的FG环,抑制肿瘤细胞与免疫细胞间的配体受体相互作用,从而阻断受体信号传导,恢复免疫细胞的效应功能。
- CAR-T细胞识别膜B7-H3并直接杀伤肿瘤细胞。
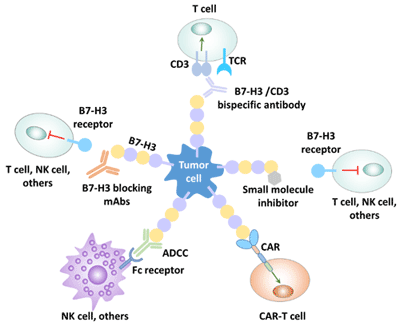
图4 B7-H3的人免疫治疗策略
正在研究的Enoblituzumab(MGA271)是B7-H3的单克隆抗体(mAb),通过抗体依赖性细胞介导的细胞毒作用(ADCC)发挥抗肿瘤活性。在一项临床Ⅰ期试验中(试验NCT01391143),证明该抗体具有良好的耐受性和抗肿瘤活性。
一种与8H9结合的抗体药物,一种标记为碘-131的单克隆抗体,在神经母细胞瘤的转移性中枢神经系统肿瘤患者的抢救治疗中取得临床成功。目前,针对腹膜癌、胶质瘤和晚期中枢神经系统癌(NCT01099644、NCT01502917和NCT00089245)患者的放射标记8H9的一期临床试验正在进行中。
抗B7-H3单抗MJ18在胰腺癌模型中,抑制了肿瘤的生长。
B7-H3 mAb与化学疗法的协同治疗取得了临床前成功。通过阻断B7-H3表达的治疗和抗肿瘤药物相结合,比单纯地应用抗肿瘤药物有更好的效果[24]。
B7-H3 CAR-T治疗胶质母细胞瘤目前处于Ⅱ期。
B7-H3蛋白
Recombinant Human CD276 antigen(CD276),partial (Active) (Code: CSB-MP733578HU)
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
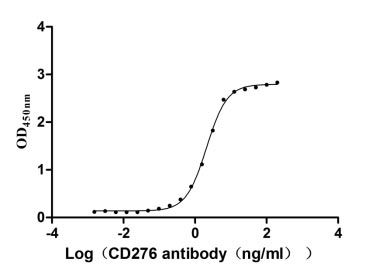
Immobilized CD276 at 2 μg/ml can bind Anti-CD276 rabbit monoclonal antibody, the EC50 of human CD276 protein is 1.961-2.243 ng/ml.
References
[1] Hodge J W, Greiner J W, Tsang K Y, et al. Costimulatory molecules as adjuvants for immunotherapy [J]. Front Biosci, 2006, 11(788-803).
[2] Seliger B, Marincola F M, Ferrone S, et al. The complex role of B7 molecules in tumor immunology [J]. Trends in molecular medicine, 2008, 14(12): 550-559.
[3] Chapoval A I, Ni J, Lau J S, et al. B7-H3: a costimulatory molecule for T cell activation and IFN-γ production [J]. Nature immunology, 2001, 2(3): 269.
[4] Zhang G, Hou J, Shi J, et al. Soluble CD276 (B7-H3) is released from monocytes, dendritic cells and activated T cells and is detectable in normal human serum [J]. Immunology, 2008, 123(4): 538-546.
[5] Sun M, Richards S, Prasad D V R, et al. Characterization of mouse and human B7-H3 genes [J]. The Journal of Immunology, 2002, 168(12): 6294-6297.
[6] Wang L, Kang F B, Shan B E. B7-H3-mediated tumor immunology: Friend or foe? [J]. International journal of cancer, 2014, 134(12): 2764-2771.
[7] Hashiguchi M, Kobori H, Ritprajak P, et al. Triggering receptor expressed on myeloid cell-like transcript 2 (TLT-2) is a counter-receptor for B7-H3 and enhances T cell responses [J]. Proceedings of the National Academy of Sciences, 2008, 105(30): 10495-10500.
[8] King R G, Herrin B R, Justement L B. Trem-like transcript 2 is expressed on cells of the myeloid/granuloid and B lymphoid lineage and is up-regulated in response to inflammation [J]. The Journal of Immunology, 2006, 176(10): 6012-6021.
[9] Allcock R J N, Barrow A D, Forbes S, et al. The human TREM gene cluster at 6p21. 1 encodes both activating and inhibitory single IgV domain receptors and includes NKp44 [J]. European journal of immunology, 2003, 33(2): 567-577.
[10] Veenstra R G, Flynn R, Kreymborg K, et al. B7-H3 expression in donor T cells and host cells negatively regulates acute graft-versus-host disease lethality [J]. Blood, 2015, 125(21): 3335-3346.
[11] Hofmeyer K A, Ray A, Zang X. The contrasting role of B7-H3 [J]. Proceedings of the National Academy of Sciences, 2008, 105(30): 10277-10278.
[12] Boland J M, Kwon E D, Harrington S M, et al. Tumor B7-H1 and B7-H3 expression in squamous cell carcinoma of the lung [J]. Clinical lung cancer, 2013, 14(2): 157-163.
[13] Mao Y, Li W, Chen K, et al. B7-H1 and B7-H3 are independent predictors of poor prognosis in patients with non-small cell lung cancer [J]. Oncotarget, 2015, 6(5): 3452.
[14] Chen L, Zhang G, Sheng S, et al. Upregulation of soluble B7-H3 in NSCLC-derived malignant pleural effusion: A potential diagnostic biomarker correlated with NSCLC staging [J]. Clinica Chimica Acta, 2016, 457: 81-85.
[15] Sun J, Mao Y, Zhang Y Q, et al. Clinical significance of the induction of macrophage differentiation by the costimulatory molecule B7-H3cancer [J]. Oncology letters, 2013, 6(5): 1253-1260.
[16] Yuan H, Wei X, Zhang G, et al. B7-H3 over expression in prostate cancer promotes tumor cell progression [J]. The Journal of urology, 2011, 186(3): 1093-1099.
[17] Parker A S, Heckman M G, Sheinin Y, et al. Evaluation of B7-H3 expression as a biomarker of biochemical recurrence after salvage radiation therapy for recurrent prostate cancer [J]. International Journal of Radiation Oncology Biology Physics, 2011, 79(5): 1343-1349.
[18] Zhao J, Lei T, Xu C, et al. MicroRNA-187, down-regulated in clear cell renal cell carcinoma and associated with lower survival, inhibits cell growth and migration though targeting B7-H3 [J]. Biochemical and biophysical research communications, 2013, 438(2): 439-444.
[19] Nygren M K, Tekle C, Ingebrigtsen V A, et al. Identifying microRNAs regulating B7-H3 in breast cancer: the clinical impact of microRNA-29c [J]. British journal of cancer, 2014, 110(8): 2072.
[20] Lim S, Liu H, Da Silva L M, et al. Immunoregulatory protein B7-H3 reprograms glucose metabolism in cancer cells by ROS-mediated stabilization of HIF1α [J]. Cancer research, 2016, 76(8): 2231-2242.
[21] Wilson K E, Bachawal S V, Abou-Elkacem L, et al. Spectroscopic photoacoustic molecular imaging of breast cancer using a B7-H3-targeted ICG contrast agent [J]. Theranostics, 2017, 7(6): 1463.
[22] Zhou Z, Luther N, Ibrahim G M, et al. B7-H3, a potential therapeutic target, is expressed in diffuse intrinsic pontine glioma [J]. Journal of neuro-oncology, 2013, 111(3): 257-264.
[23] Zhao L, Xie C, Liu D, et al. Early detection of hepatocellular carcinoma in patients with hepatocirrhosis by soluble B7-H3 [J]. Journal of Gastrointestinal Surgery, 2017, 21(5): 807-812.
[24] Zhang W, Wang J, Wang Y, et al. B7-H3 silencing by RNAi inhibits tumor progression and enhances chemosensitivity in U937 cells [J]. 2015.
上一篇: 《Nature》:和想象完全不一样?博士生、蛮难的!!!
下一篇: 补体激活调节剂CD46














