间充质干细胞的表面标记物
日期:2020-01-06 14:00:22
间充质干细胞(mesenchymal stem cells, MSCs)是一类存在于多种组织(如骨髓、脐带血和脐带组织、胎盘组织、脂肪组织等),具有多向分化潜力的成体干细胞。
它可以向多种间充质系列细胞(如成骨、成软骨及成脂肪细胞等)或非间充质系列细胞分化。
间充质干细胞具有低免疫原性,一般都不会引起宿主的免疫反应。这种特性使其在自身免疫性疾病以及各种替代治疗等方面具有广阔的临床应用前景。
1. 间充质干细胞来源与分布
间充质干细胞是1987年由Friedenstein等人 [1]利用自然贴壁法从获得的骨髓基质细胞中发现的。间充质干细胞(MSCs)的概念最早在1991年由Caplan提出。
MSCs这一类群细胞的异质性比较大,故无法定MSCs的发育起源。比如牙髓、皮肤等属于外胚层来源,骨髓、脂肪组织、围产期组织等则属于中胚层来源。
间充质干细胞广泛存在于人体各组织中,可来源于骨髓,胰腺,皮肤肺等多处器官组织。也在许多其他的组织中发现有间充质干细胞的存在,在滑膜、肝脏、肺脏、牙周质、胰腺、眼结膜、脂肪、肌腱、甚至在羊水及头皮组织中均可以培养出间充质干细胞。
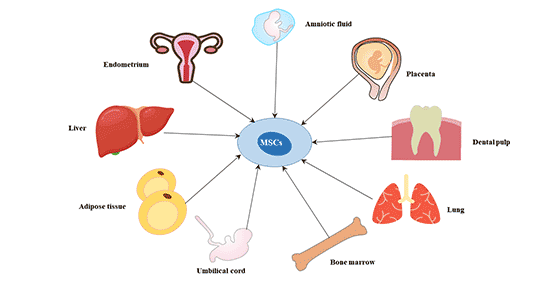
图1. 间充质干细胞的来源
2. 间充质干细胞的定义
自1991年MSCs的概念提出之后,在接下来的十年内报告MSCs的组织类型激增。这就需要对MSCs的定义有一个明确的标准。
2006年,国际细胞疗法协会(ISCT)制定了MSCs的定义的基本标准,也是MSC最低的鉴定标准:
- 在标准体外培养条件下呈贴壁生长状态。
- 大于或等于95%的细胞表达CD105、CD73和CD90,且表达CD45、CD34、CD14、CD11b、CD79a、CD19或HLA-Ⅱ类分子的细胞不应超过总数的2%[2]
- 在体外诱导条件下,具有分化为成骨细胞、软骨细胞及脂肪细胞的能力。
该标准存在的缺陷是对其在体内实验是否能真正分化未做要求,也没有检验其干性是否能维持。
不同来源的MSCs分子特征差异巨大[3]。Caplan建议将其改为医用信号细胞 (medicinal signaling cells,MSCs)[4]。
3. 间充质干细胞生物学特性
间充质干细胞是一类能够自我更新并具有多向分化潜能的典型细胞群体。在体外和体内通过不同方式诱导分化为脂肪组织细胞、软骨组织细胞、结缔组织细胞和骨组织细胞及神经干细胞。此外,研究表明,MSCs也可能被诱导分化为内胚层细胞(肺细胞,肌细胞和肠上皮细胞)及外胚层细胞(上皮细胞和神经元)[5] [6]。
间充质干细胞具有独特的细胞因子分泌功能,可分泌IL-6、IL-7、IL-8、IL-11、干细胞生长因子、粒细胞-巨噬细胞集落刺激因子、TGF-β等。
除了具有分化潜能外,间充质干细胞具有低免疫原性和免疫调节作用。
间充质干细胞免疫调节机制可由分泌可溶性细胞因子如IL-10、TGF-β1、前列腺素E2、肝细胞生长因子、IL-2等介导。诱导CD8+调节性T细胞发挥免疫抑制作用。人骨髓间充质干细胞可能干涉抗原呈递细胞的成熟。
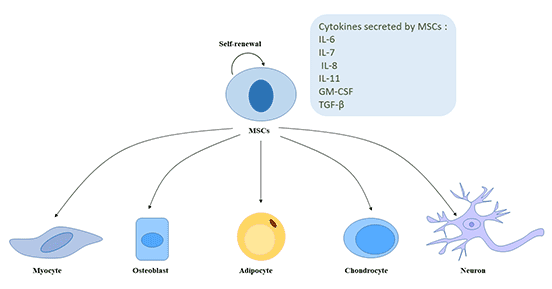
图2. 间充质干细胞的自我更新和多向分化潜能
4. 间充质干细胞的免疫调节作用
MSCs对免疫系统的作用以负向调控为主。
- 单核细胞:单核细胞可分化为M1型Mφ起促炎作用或分化为M2型Mφ起抗炎作用。MSCs分泌IL-1RA、IL-10、CCL-18促使M1向M2转化,通过影响Treg的形成,起到抗炎症与负向调节T细胞功能的作用。
- 中性粒细胞:在体内,MSCs能够通过加强中性粒细胞抗菌能力起到辅助清除细菌的作用,此外还能抑制中性粒细胞凋亡,延长中性粒细胞寿命。
- 树突状细胞:作为体内最主要的专职抗原提呈细胞,树突状细胞能够有效刺激T细胞和B细胞的活化,激发机体免疫应答。体外实验证实MSC能够显著地减少单核细胞向树突状细胞的分化,维持树突状细胞的未成熟的状态,从而使DC不能有效地活化初始T细胞和刺激T细胞增殖。
- T细胞:MSCs主要通过释放可溶性因子、细胞间的直接接触以及诱导Treg生成等三种方式抑制T细胞功能,这种抑制作用呈剂量依赖效应。
- B细胞:MSCs会分泌一种细胞因子抑制B细胞增殖。MSCs通过使B细胞的细胞周期滞留在G0/G1期来达到目的。MSCs能够产生趋化因子受体CXCR4/5/7来改变B细胞的趋化能力。
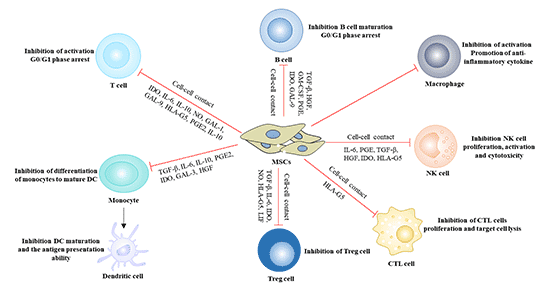
图3. 间充质干细胞的免疫调节作用
5. 间充质干细胞的细胞表面标记物
细胞的特定的功能与其表面标志物相关,细胞表面标记物可以体现细胞的一些基本特征[7]。间充质干细胞属混杂细胞群,其表面抗原也具有非专一性,表达了间质细胞、内皮细胞和表皮细胞的表面标志。目前人类间充质干细胞表面比较肯定存在的标记物有CD10,CD13,CD29,CD90和CD1,表面阴性的为CD14,CD34,CD45[8] [9]。
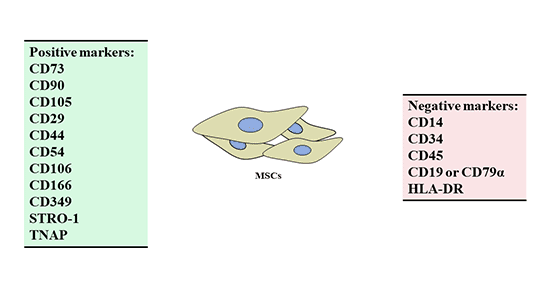
图4. 间充质干细胞阳性和阴性标记
CD29:CD29也被称为整合素β1,VLA-β链或gpIIa,为多种细胞外基质蛋白的受体,是分子量为130 kDa的单链I型糖蛋白,属于整合素家族。它广泛表达于大多数造血细胞和非造血细胞,包括白细胞(虽然在粒细胞水平较低)、血小板、成纤维细胞、内皮细胞、上皮细胞和肥大细胞。CD29作为纤维连接蛋白受体,参与多种细胞-细胞和细胞-基质相互作用,调节多种重要的生物学功能,包括胚胎发育、伤口修复、止血和防止细胞程序性死亡。它的表达与MSC的迁移有关。
CD44:CD44也称为Hermes、Pgp1、H-CAM或Hutch,是一种80-95 kDa的糖蛋白。它表达于白细胞、内皮细胞、肝细胞和间充质细胞。CD44在B和T细胞的记忆阶段高表达,被认为是一个有价值的记忆细胞亚群的标志物。
CD44是一种粘附分子,CD44抗原是一种细胞表面糖蛋白,CD44参与多种细胞功能,包括淋巴细胞活化、再循环和归巢、造血和肿瘤转移。
CD54:CD54也称为ICAM-1,是一种分子量为85-110 kDa的I型跨膜蛋白,是免疫球蛋白超家族的成员。它表达于活化的内皮细胞、高内皮微静脉、T、B细胞、单核/巨噬细胞、粒细胞和树突状细胞。ICAM-1的表达可从细胞表面释放。CD54可由IL-1和TNF-α诱导,并由血管内皮细胞、巨噬细胞和淋巴细胞表达。CD54在细胞粘附中发挥作用,并参与炎症和白细胞外渗。CD54也被证明是鼻病毒的主要细胞受体。
CD73:CD73是一种5′-核苷酸外切酶,又称NT5E。它是一种69 kDa GPI锚定的表面蛋白。CD73广泛表达于包括淋巴细胞、内皮细胞、平滑肌细胞、上皮细胞和成纤维细胞在内的多种细胞。CD73不仅可参与嘌呤核苷酸的补救合成途径,还可作为一种重要的免疫信号分子,参与跨膜信号转导及细胞的黏附。CD73在间充质干细胞表面的稳定表达是鉴别MSCs重要的表面标记之一。
CD90 (Thy1):CD90也称为Thy-1,是一种25-35kDa 的GPI锚定蛋白。它属于免疫球蛋白超级家族。人CD90表达于神经细胞、CD34+细胞亚群、胎肝细胞亚群、胎胸腺细胞亚群、成纤维细胞、活化内皮细胞和某些白血病细胞系。Thy-1与与细胞的黏附、分化、细胞间相互作用有关。它是人类微血管内皮细胞活化的标记,与新生血管的形成有关[10];也是鉴别人类MSCs的重要标记之一[11]。
CD105 (Endoglin):CD105也称为endoglin,是透明带蛋白(ZP)家族的一种90 kDa的I型跨膜糖蛋白糖蛋白。
Endoglin在足月胎盘增生的血管内皮细胞、软骨细胞和合体滋养层细胞上高表达,在造血干细胞、间充质干细胞和神经嵴干细胞、活化的单核细胞以及淋巴和髓系白血病细胞上表达较少。在血管生成的组织中,如肿瘤、伤口愈合或真皮炎症中,CD105在活化的内皮细胞上的表达增加。Endoglin是TGFβ超家族配体的III型受体。CD105在血管发生发展过程中起着重要的作用,它可以维持血管的完整性[12]。
CD106 (VCAM-1):CD106又称血管细胞黏附蛋白1(VCAM1),INCAM-100和L1CAM,其编码的蛋白是唾液酸糖蛋白,分子量为110kDa,由IL-1、TNF等细胞因子激活表达。
它是免疫球蛋白超家族成员,表达于炎症血管内皮细胞、巨噬细胞样细胞和树突状细胞上均有表达,在正常组织和炎症组织中均有表达。它的表达与MSC的干性维持有关[13]。
CD106介导白细胞-内皮细胞粘附和信号转导,可能在动脉粥样硬化和类风湿性关节炎的发生发展中起作用。
CD166 (ALCAM):CD166又称CD6配体或活化的白细胞粘附分子(ALCAM),属于免疫球蛋白超家族成员,是一种分子量为100-105kD的跨膜糖蛋白。
它表达于活化的T细胞、活化的单核细胞、上皮细胞、成纤维细胞和神经元。ALCAM/CD6相互作用可能参与T细胞的发育和调节。此外,ALCAM/CD6和ALCAM/NgCAM相互作用可能在神经系统中发挥作用。ALCAM在高转移性黑色素瘤细胞系中表达上调,并可能在肿瘤迁移中发挥作用。它还可以参与胚胎造血系统的发育和毛细血管的形成,并在维持MSCs多向分化潜能方面起着至关重要的作用[14]。
CD349 (Frizzled-9):CD349属于“卷曲”基因家族的成员,这些蛋白是Wnt信号蛋白的受体。FZD9基因位于7号染色体的Williams综合征常见缺失区,FZD9基因的杂合性缺失可能与Williams综合征的表型有关。FZD9主要在脑、睾丸、眼睛、骨骼肌和肾脏中表达。
STRO-1:Stro-1也是研究常用的标志物,但在很多研究中均未提及[15]。
作为寻找间充质基质/干细胞(mesenchymal stromal/stem cells,MSC)可靠标志物的实验研究的一部分,Stro-1抗体是利用人CD34+骨髓细胞脾内免疫小鼠产生的几株杂交瘤中的一株产生的。Stro-1被认为是最著名的MSCs标记物,其抗体主要用于流式细胞术以及对可能的MSCs进行染色。
TNAP:TNAP(组织非特异性碱性磷酸酶)抗原可以与W8B2抗体反应。TNAP选择性地表达在骨髓间充质干细胞上。
CD34:CD34是一种跨膜唾液黏蛋白,可能与黏附和抗黏附有关。它是间充质干细胞的阴性标志物,一直以来备受争议[16]。争议的点在于,分离得到的新鲜细胞(如内皮细胞)是表达CD34的,但是随着传代次数的增加CD34逐渐消失,造血干细胞中也存在类似情况[17]。也就是说MSCs不表达CD34是由细胞培养所致,并不符合其在体内的真实状态,所以是否应将CD34作为MSCs的阴性标志物应重新考虑。
5.1 不同来源MSC的标志物比较
目前临床应用较多的为骨髓来源MSC(bone marrow-MSC, BM-MSC)、脐带来源MSC(umbilical cord-MSC, UC-MSC)和脐血来源MSC(UCB-MSC),不同来源MSCs既存在一些共性,也具有一些不同的特性。
UC-MSC的大多数免疫标记物与BM-MSC的表达相似,不同的是,UC-MSC中HLA-ABC和CD106的表达低于BM-MSC。这提示UC-MSC比BM-MSC具有更低的免疫原性。CD106的低表达可能是UC-MSC与BM-MSC的鉴别点之一。
UCB-MSC和BM-MSC细胞表面标志物比较一致。它们均表达CD29、CD44及CD105等细胞黏附分子,而不表达CD13、CD14、CD34及CD45,其免疫表型不随着细胞传代的增加而改变。
6. 间充质干细胞的应用
间充质干细胞的特点:具有自我更新,多向分化潜能,在体外能传40代,并保持稳定的表型和多向分化潜能。此外,它具有低免疫原性。
因此,间充质干细胞可作为基因治疗的载体细胞,修复各种组织和器官,如骨、软骨、肌腱、皮肤、神经组织、心肌,也可用于器官或组织移植。
目前应用较多的有骨、软骨和关节损伤的修复,造血干细胞移植治疗移植物抗宿主病,自身免疫性疾病的治疗,脊髓损伤和神经系统疾病的治疗。
References
[1] Friedenstein A J, Chailakhyan R K, Gerasimov U V. Bone marrow osteogenic stem cells: in vitro cultivation and transplantation in diffusion chambers [J]. Cell proliferation, 1987, 20(3): 263-272.
[2] Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement [J]. Cytotherapy, 2006, 8(4): 315-317.
[3] Mendicino M, Bailey A M, Wonnacott K, et al. MSC-based product characterization for clinical trials: an FDA perspective [J]. Cell stem cell, 2014, 14(2): 141-145.
[4] Caplan A I. Mesenchymal stem cells: time to change the name! [J]. Stem cells translational medicine, 2017, 6(6): 1445-1451.
[5] Kopen G C, Prockop D J, Phinney D G. Marrow stromal cells migrate throughout forebrain and cerebellum, and they differentiate into astrocytes after injection into neonatal mouse brains [J]. Proceedings of the National Academy of Sciences, 1999, 96(19): 10711-10716.
[6] Pittenger M F, Mackay A M, Beck S C, et al. Multilineage potential of adult human mesenchymal stem cells [J]. science, 1999, 284(5411): 143-147.
[7] Lu L L, Liu Y, Yang S G, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials [J]. haematologica, 2006, 91(8): 1017-1026.
[8] Fakhry M, Hamade E, Badran B, et al. Molecular mechanisms of mesenchymal stem cell differentiation towards osteoblasts [J]. World journal of stem cells, 2013, 5(4): 136.
[9] Mohr S, Portmann-Lanz C B, Schoeberlein A, et al. Generation of an osteogenic graft from human placenta and placenta-derived mesenchymal stem cells [J]. Reproductive sciences, 2010, 17(11): 1006-1015.
[10] Saalbach A, Hildebrandt G, Haustein U F, et al. The Thy-1/Thy-1 ligand interaction is involved in binding of melanoma cells to activated Thy-1-positive microvascular endothelial cells [J]. Microvascular research, 2002, 64(1): 86-93.
[11] He J, Liu Y, Zhu T, et al. CD90 is identified as a candidate marker for cancer stem cells in primary high-grade gliomas using tissue microarrays [J]. Molecular & Cellular Proteomics, 2012, 11(6): M111. 010744.
[12] Gerlach J C, Johnen C, Ottoman C, et al. Method for autologous single skin cell isolation for regenerative cell spray transplantation with non-cultured cells [J]. The International journal of artificial organs, 2011, 34(3): 271-279.
[13] Phelps E A, García A J. Engineering more than a cell: vascularization strategies in tissue engineering [J]. Current opinion in biotechnology, 2010, 21(5): 704-709.
[14] Laschke M W, Harder Y, Amon M, et al. Angiogenesis in tissue engineering: breathing life into constructed tissue substitutes [J]. Tissue engineering, 2006, 12(8): 2093-2104.
[15] Kolf C M, Cho E, Tuan R S. Mesenchymal stromal cells: biology of adult mesenchymal stem cells: regulation of niche, self-renewal and differentiation [J]. Arthritis research & therapy, 2007, 9(1): 204.
[16] Lin C S, Ning H, Lin G, et al. Is CD34 truly a negative marker for mesenchymal stromal cells? [J]. Cytotherapy, 2012, 14(10): 1159-1163.
[17] Gangenahalli G U, Singh V K, Verma Y K, et al. Hematopoietic stem cell antigen CD34: role in adhesion or homing [J]. Stem cells and development, 2006, 15(3): 305-313.
上一篇: 【文献精选】2020,CUSABIO让您的科研Flag屹立不倒!
下一篇: 造血干细胞表面标志物











