Osteoprotegerin (OPG):作为生物标志物或治疗靶点的潜力如何?
日期:2020-12-22 14:45:36
2020年7月22日,发表在《细胞死亡与分化》杂志上的一项研究揭示了OPG在肿瘤方面的调控机制。该研究首次提出,OPG水平对p53介导的间充质干细胞成骨分化起着重要作用,同时也提示了一种关于肿瘤相关骨重塑的新型调控方法 [1]。尽管大量研究已证实OPG与骨吸收和骨重塑密切相关,但最近有研究发现,OPG可能在肿瘤生成和细胞凋亡等生物学进程中扮演重要的角色,其潜在价值有待进一步发掘。那么OPG是什么?它主要的作用是什么?OPG作为生物标志物或治疗靶点的潜力如何?
1. OPG的结构和功能
OPG是肿瘤坏死因子(TNF)受体超家族的成员之一,又称TNFRS11B或OCIF,属于Ⅱ型跨膜蛋白。OPG缺少跨膜和胞浆区域,但包含7个主要结构域,这7个结构域共形成3个功能区:①TNF受体结构区,包括结构域1-4,即4个富含半胱氨酸的结构区域,参与抑制破骨细胞生成;②致死结构区,包括结构域5-6,即2个死亡域同源区;③肝素结合结构区,即结构域7,一个肝素结合位点,它对OPG与蛋白多糖的相互作用非常重要。特别是结构域7中Cys-400的存在是OPG同源二聚体形成的关键(图1) [2,3]。
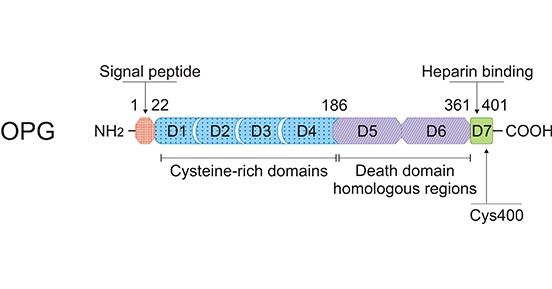
图1. OPG的蛋白质结构示意图
*本图来源于Cellular and molecular life sciences 出版物[3]。
OPG主要由骨髓基质细胞表达。此外,在免疫系统(如淋巴结、B细胞和树突状细胞(DCs))和血管系统(如心脏、动脉和静脉)中也检测到其表达 [4]。通常,OPG的表达与一些骨疾病密切相关。但更多的证据表明,OPG可以通过抑制TNF相关的细胞凋亡促进细胞存活 [5]。此外,一些体外、体内和临床研究也表明OPG在肿瘤中起到一定的作用 [6]。
2. OPG及其配体
OPG通过与其配体结合,直接或间接地发挥作用。RANKL是OPG配体之一,它最初被描述为“OPG配体/OPGL” [7]。RANKL作为TNF家族细胞因子的成员之一,以II型膜蛋白或可溶性蛋白RANKL的形式存在 [8]。它主要由活化的免疫细胞和成骨细胞表达 [9]。研究表明,RANKL常参与多种生物活动。例如,RANKL能促进单细胞前体细胞的分化,从而形成成熟的破骨细胞 [10];RANKL能增强成熟破骨细胞的骨吸收活性 [11]。此外,RANKL通过与其同源的高亲和力跨膜受体RANK相互作用,发挥其促骨细胞活性 [12]。
除RANKL外,OPG还能与另一个TNF家族成员TRAIL结合。与RANKL类似,TRAIL也是以II型膜蛋白或可溶性蛋白的形式表达 [13, 14]。现有证据表明,OPG/TRAIL水平可能与血管钙化有关,而血管钙化是糖尿病的主要原因 [15]。
比较OPG对RANKL和TRAIL的影响,如图2所示,TRAIL的促凋亡活性是由其4个膜受体中的2个(TRAIL-R1和TRAIL-R2)介导的。OPG可以有效地与RANKL或TRAIL结合,阻止RANKL或TRAIL与其相应的跨膜受体之间的关联。该过程可以抑制RANKL介导的破骨细胞生成以及TRAIL的促凋亡活性 [3]。
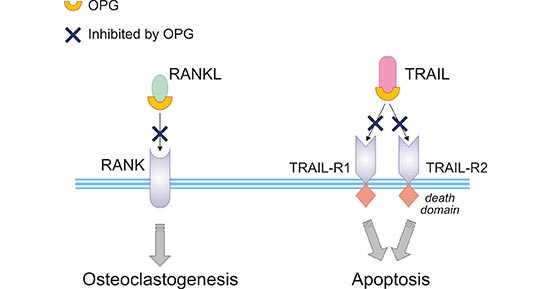
图2. OPG对RANKL和TRAIL的影响
*本图片来源于Cellular and molecular life science 出版物[3]。
3. OPG/RANKL/RANK调节机制
众所周知,OPG/RANKL/RANK是OPG的主要信号通路,主要参与破骨细胞的发生。如图3所示,成骨细胞首先产生RANKL,继而RANKL与成骨细胞前体表面的RANK结合,TRAF 2、5、6与RANK胞质域结合。随后,多个分子被激活,包括JNK、p38、ERK、Akt和NF-κB。进一步,激活的NF-κB移动到细胞核,最后与NFATc1相互作用,触发成骨细胞基因转录 [16]。
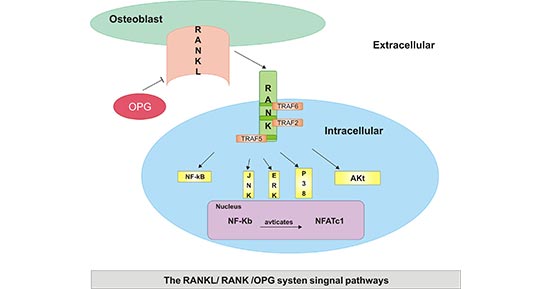
图3. OPG/RANKL/RANK生物活性的作用机制
*本图片来源于Molecular Medicine Reports 出版物[16]。
OPG/RANKL/RANK通路不仅在破骨细胞激活、形成和存活中起主导作用,而且还在其他组织中发挥作用,包括乳腺、大脑和淋巴结。OPG/RANKL/RANK通路的紊乱与人类某些疾病有关,包括绝经后骨质疏松症、类风湿性关节炎(RA)、骨肿瘤和某些骨转移性肿瘤。此外,该通路可能是淋巴结形成和自身免疫性疾病RA的关键调节因子,这进一步提示免疫通路可能与OPG/RANKL/RANK相互作用 [17-19]。
4. OPG在骨、血管和肿瘤疾病中的作用
OPG在调节骨相关疾病中具有重要地位。有研究评估了OPG在骨质疏松症、类风湿关节炎、牙周炎和幼年磷酸酶症(JPD)中的作用。骨质疏松症是一种由于破骨细胞活性增加而导致的低骨密度(BMD)为特征的疾病,而OPG能特异地抑制破骨细胞生成 [20]。类风湿性关节伴有软骨和骨质破坏,部分原因是破骨细胞生成增加所致 [21]。在牙周炎中观察到的骨吸收部分,与OPG的减少,破骨细胞活性增加有关 [22]。
此外,编码OPG的基因突变与JPD有密切关系 [23]。该病又称特发性高磷酸酶症,是一种罕见的常染色体隐性疾病,其特征是整个骨骼的骨重塑加快。如图4所示,患者的表现型取决于OPG基因内存在的突变 [2]。
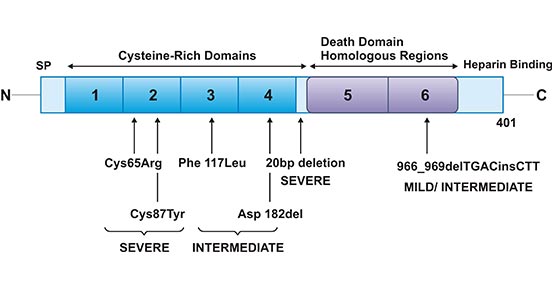
图4. 幼年高磷酸酶的OPG突变
*本图片来源于European journal of cell biology 出版物[2]。
另一方面,OPG与血管相关疾病的联系也被证实 [24]。例如,在类风湿关节炎患者中,通常发现OPG水平高,是冠状动脉疾病的高危人群 [25]。此外,临床发现OPG缺失的小鼠表现出主动脉和肾动脉的钙化 [26]。然而,最近研究报道,OPG与肾功能之间存在显著的反向关联。与这些数据一致的是,高表达的OPG与老年妇女肾功能衰退有密切关系 [27]。OPG有望作为肾脏病风险预测新标志。
近年,OPG在肿瘤发生中的作用引起了关注,尤其是在癌症诱发的骨病和肿瘤细胞存活方面。临床数据发现,在结直肠癌、胰腺癌以及头颈部鳞状细胞癌症中,OPG血清水平升高 [2]。也有研究发现,OPG血清水平的升高似乎与骨转移有关,包括乳腺癌、肺癌和前列腺癌 [6]。
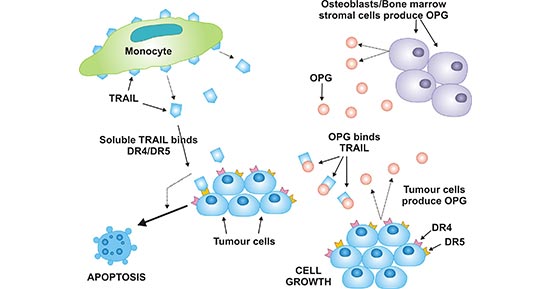
图5. OPG在肿瘤细胞生存中的潜在作用
*本图片来源于Clinical science 出版物[6]。
为进一步说明OPG在肿瘤细胞存活中的潜在作用,如图5所示,单核细胞产生的TRAIL与肿瘤细胞表面的DR4/DR5(TRAIL-R1/TRAIL-R2)结合,启动细胞凋亡。肿瘤细胞或破骨细胞/BMSCs产生的OPG与TRAIL结合,阻止TRAIL与DR4/DR5结合 [6]。OPG能够抑制TRAIL诱导的细胞凋亡,这表明OPG可能具有促进肿瘤发生的作用 [5]。然而矛盾的是,有证据表明OPG能够抑制癌症诱导的骨病 [2]。OPG是否能促进或抑制肿瘤进展仍有待充分阐明,并且可能在不同癌症类型和疾病阶段之间有所不同。
5. OPG的临床应用前景
总的来说,OPG在骨相关疾病中至关重要,包括骨质疏松症、幼年磷酸酶症(JPD)、关节炎、骨吸收。在血管相关疾病和肿瘤发生方面,OPG的作用似乎更为复杂,这使得OPG作为一种潜在的生物标记物或治疗靶点备受关注。换句话说,OPG抗体或者抗OPG产品在临床研究中的应用有望监测疾病相关的进展和并发症。在全球范围内,抗体治疗市场规模在2019年估值为1230.3亿美元,预计到2027年将达到350.1亿美元。到目前为止,仅有一项来自癌症患者接受重组OPG构建体(AMGN-0007)的临床试验的研究报告 [6],该研究显示,在涉及过度骨吸收的骨病方面,OPG的治疗效果显著。研究结果为OPG治疗某些疾病提供了可靠的证据。为进一步阐明OPG的保护或者是损害机制,OPG抗体或抗OPG抗体的开发,在长期内会有巨大的市场潜力。
OPG蛋白
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
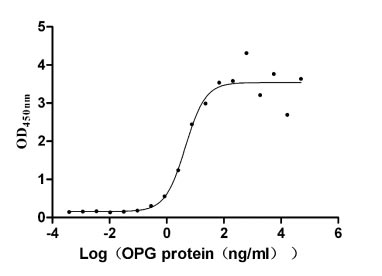
Immobilized TNFSF11 (CSB-MP023986HU1(F2)) at 10 μg/ml can bind human TNFRSF11B, the EC50 is 2.651-7.646 ng/ml.
参考文献:
[1] Velletri T, Huang Y, Wang Y, et al. Loss of p53 in mesenchymal stem cells promotes alteration of bone remodeling through negative regulation of osteoprotegerin [J]. Cell Death & Differentiation. 2020; 21:1-4.
[2] Reid P, Holen I. Pathophysiological roles of osteoprotegerin (OPG) [J]. European journal of cell biology. 2009; 88(1):1-7.
[3] Zauli G, Melloni E, Capitani S, Secchiero P. Role of full-length osteoprotegerin in tumor cell biology. Cellular and molecular life sciences [J]. 2009; 66(5):841-51.
[4] Deligiorgi MV, Panayiotidis MI, Griniatsos J, Trafalis DT. Harnessing the versatile role of OPG in bone oncology: counterbalancing RANKL and TRAIL signaling and beyond. Clinical & experimental metastasis [J]. 2020; 37(1):13-30.
[5] Lane D, Matte I, Laplante C, et al. Osteoprotegerin (OPG) activates integrin, focal adhesion kinase (FAK), and Akt signaling in ovarian cancer cells to attenuate TRAIL-induced apoptosis [J]. Journal of ovarian research. 2013; 6(1):82.
[6] Holen I, Shipman CM. Role of osteoprotegerin (OPG) in cancer [J]. Clinical science. 2006; 110(3):279-91.
[7] Theoleyre S, Wittrant Y, Tat SK, et al. The molecular triad OPG/RANK/RANKL: involvement in the orchestration of pathophysiological bone remodeling [J].Cytokine & growth factor reviews. 2004; 15(6):457-75.
[8] Theill LE, Boyle WJ, Penninger JM. RANK-L and RANK: T cells, bone loss, and mammalian evolution [J]. Annual review of immunology. 2002; 20(1):795-823.
[9] Feng W, Guo J, Li M. RANKL-independent modulation of osteoclastogenesis [J]. Journal of oral biosciences. 2019; 61(1):16-21.
[10] Kim, J.M., Jeong, D., Kang, H.K., et al. Osteoclast precursors display dynamic metabolic shifts toward accelerated glucose metabolism at an early stage of RANKL-stimulated osteoclast differentiation [J]. Cellular Physiology and Biochemistry. 2017; 6:935-946.
[11] Steeve KT, Marc P, Sandrine T, Dominique H, Yannick F. IL-6, RANKL, TNF-alpha/IL-1: interrelations in bone resorption pathophysiology [J]. Cytokine & growth factor reviews. 2004; 15(1):49-60.
[12] Sobacchi C, Menale C, Villa A. The RANKL-RANK axis: A bone to thymus round trip [J]. Frontiers in immunology. 2019; 10:629.
[13] Corallini F, Celeghini C, Rimondi E, et al. Trail down‐regulates the release of osteoprotegerin (OPG) by primary stromal cells. Journal of cellular physiology [J]. 2011; 226(9):2279-86.
[14] Wajant H, Moosmayer D, Wüest T, et al. Differential activation of TRAIL-R1 and-2 by soluble and membrane TRAIL allows selective surface antigen-directed activation of TRAIL-R2 by a soluble TRAIL derivative [J]. Oncogene. 2001; 20(30):4101-4106.
[15] Kawano N, Mori K, Emoto M, et al. Association of serum TRAIL levels with atherosclerosis in patients with type 2 diabetes mellitus [J]. Diabetes research and clinical practice. 2011; 91(3):316-320.
[16] Liu W, Zhang X. Receptor activator of nuclear factor-κB ligand (RANKL)/RANK/osteoprotegerin system in bone and other tissues [J]. Molecular Medicine Reports. 2015; 11(5):3212-8.
[17] Boyce BF, Xing L. The Rankl/Rank/Opg pathway [J]. Current osteoporosis reports. 2007; 5(3):98-104.
[18] Chen Gaoping, Kanishka Sircar, Armen Aprikian, et al. Expression of RANKL/RANK/OPG in primary and metastatic human prostate cancer as markers of disease stage and functional regulation [J]. Cancer. 2006; 107:289-298.
[19] Walsh MC, Choi Y. Biology of the RANKL–RANK–OPG system in immunity, bone, and beyond [J]. Frontiers in immunology. 2014; 5:511.
[20] Weitzmann MN. The role of inflammatory cytokines, the RANKL/OPG axis, and the immunoskeletal interface in physiological bone turnover and osteoporosis [J]. Scientifica. 2013.
[21] Van Tuyl LH, Voskuyl AE, Boers M, et al. OPG ratio and markers of bone and cartilage degradation predict annual radiological progression over 11 years in rheumatoid arthritis [J]. Annals of the rheumatic diseases. 2010; 69(9):1623-8.
[22] Crotti T, Smith MD, Hirsch R, et al. Receptor activator NF κB ligand (RANKL) and osteoprotegerin (OPG) protein expression in periodontitis [J]. Journal of periodontal research. 2003; 38(4):380-387.
[23] Brunetti G, Marzano F, Colucci S, et al. Genotype-phenotype correlation in Juvenile Paget disease: role of molecular alterations of the TNFRSF11B gene [J]. Endocrine. 2012; 42(2):266-71.
[24] Harper E, Forde H, Davenport C, et al. Vascular calcification in type-2 diabetes and cardiovascular disease: Integrative roles for OPG, RANKL and TRAIL [J]. Vascular pharmacology. 2016; 82:30-40.
[25] Venuraju SM, Yerramasu A, Corder R, Lahiri A. Osteoprotegerin as a predictor of coronary artery disease and cardiovascular mortality and morbidity [J]. Journal of the American College of Cardiology. 2010; 55(19):2049-61.
[26] Bucay N, Sarosi I, Dunstan CR, et al. Osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification [J]. Genes & development. 1998; 12(9):1260-8.
[27] Lewis JR, Lim WH, Zhu K, et al. Elevated osteoprotegerin predicts declining renal function in elderly women: a 10-year prospective cohort study [J]. American journal of nephrology. 2014; 39(1):66-74.











