TNFR1:癌症双重作用分子,或可作为新型冠状病毒(COVID-19)治疗靶点
日期:2021-02-04 15:18:42
2021年1月7日,发表在Cancer Research杂志上的一项研究表明TNFR1介导的细胞凋亡和坏死与白血病相关 [1]。作为一个热门的生物靶点,TNFR1具有双重作用,大量研究证实TNFR1的表达,能促进或抑制肿瘤细胞的凋亡,同时参与自身免疫性疾病。更引人关注的是,有研究数据显示,TNFR1抑制剂有望为成为治疗COVID-19候选方案。但TNFR1复杂的生物学功能,使得TNFR1靶向药物的研发面临重重挑战。去年2020年9月,全球顶级研究学者Marc Feldmann和Michael Shepard发起了一个项目,研发TNFR1特效抑制剂,该抑制剂可阻断TNFR1,用于急性炎症和多种癌症治疗。那么TNFR1是什么?它介导的信号通路是怎样的?TNFR1为何与COVID-19有关?靶向TNFR1药物研发的潜在价值如何?
1. TNFR1结构和功能
TNFR1属于肿瘤坏死因子(TNF)受体超家族成员之一,又称TNFRSF1A,CD120a或p55,是分子量为55 ku的I型跨膜糖蛋白 [2]。TNFR1包含胞外区、跨膜区和胞内区三个部分。胞外结构域含182个氨基酸,由4个富含半胱氨酸的结构域(CRD1-CRD2-CRD3-CRD4)组成。跨膜区位于细胞外结构域和细胞内结构域之间,长约22个氨基酸(残基183-205个)。胞内结构域长约223个氨基酸。其中,在胞外结构域有3个潜在的N-糖基化位点,其功能主要是与三聚体形式的TNF结合。N末端残基是亮氨酸。C末端含有80个保守氨基酸序列所构成的死亡结构域(Death domain,DD),是转导细胞死亡信号所必需的,且TNFR1的很多功能都与此结构域有关(图1) [3, 4]。
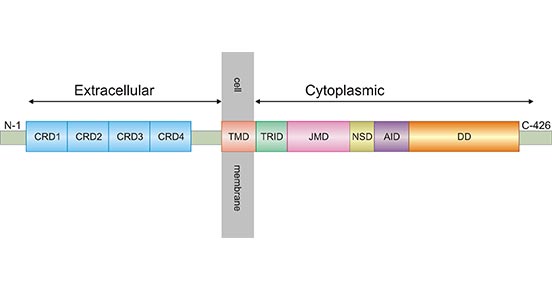
图1. TNFR1的蛋白质结构
*本图来源于ResearchGate 出版物[4]。
TNFR1广泛分布于正常细胞膜表面,也存在于多种肿瘤细胞表面 [5]。TNFR1主要介导凋亡信号,引起细胞凋亡,在抗肿瘤和抗病毒感染中发挥重要作用,同时也参与自身免疫性疾病,是诱导类风湿关节炎 [6]和系统性红斑性狼疮(SLE)关键因子 [7]。由于TNFR1参与到复杂的生物学过程,使得TNFR1精确的功能意义尚不清楚。
2. TNFR1的配体TNF
TNF是三个相同的单体亚单位组成的致密三聚体 [8]。TNF包含TNF-α和TNF-β两种,属于Ⅱ型膜蛋白。巨噬细胞分泌出来的TNF,即TNF-α。T淋巴细胞分泌的淋巴毒素,即TNF-β [9]。TNF总活性中,TNF-α的占比为70%~95%,所以,平时所指的TNF基本为TNF-α [10]。
TNFα在体内又以两种形式存在,分别是跨膜型TNF-α(tmTNF-α)和可溶型TNF-α(sTNF-α)。tmTNF-α为sTNF-α的前体形式,通过TNF转化酶(TACE,又称ADAM17)的剪切,分泌到细胞外,形成可溶性sTNF-α(图2)[11]。
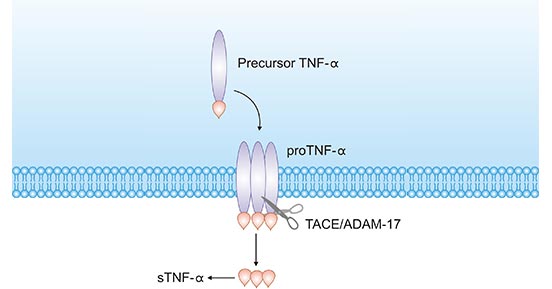
图2. tmTNF-α转化为sTNF-α过程
*本图来源于Ochsner Journal 出版物[11]。
两型TNFα与受体(TNFR1或TNFR2)相互作用而诱导生物效应,但因TNFR2缺乏死亡结构域,TNFR1便成为介导TNF-α活动的主要受体 [12, 13, 14]。TNFR1与TNF-α的胞外段结合后而引起胞内段构像的改变,使TNFR1激活 [15]。
3. TNFR1介导的信号通路
3.1 TNFR1-sTNF-α信号通路
TNFR1与sTNF-α结合,启动的下游信号通路已经非常明确。TNFR1作为sTNF-α的主要受体,其胞内段含有DD(death domain,死亡结构域)。在无sTNF-α刺激时,TNFR1的DD被死亡结构域的沉默子蛋白(SODD)占据,阻断TNFR相关死亡结构域蛋白(TRADD)与TNFR1的衔接,抑制TNFR1信号通路 [16]。当sTNF-α刺激后,sTNF-α与TNFR1结合,SODD从TNFR1的DD结构域脱落,TNFR1通过其暴露的DD结构域募集TRADD,TNFR1信号通路激活(图3)[17]。
当TNFR1/sTNF-α激活后,TRADD可以募集受体相关蛋白-1(RIP1)以及受体相关因子2(TRAF2),在胞膜上形成可激活NF-κB的信号复合物I(TNFR1-TRADD-RIP1-TRAF2),促进靶基因转录,抵抗凋亡,促进生存(图3)[4, 17]。
此外,TNFR1通过网格蛋白(clathrin)发生内化(internalization),内化后的TNFR1通过TRADD的DD和FAS相关结构死亡蛋白结构域蛋白(FADD)的DD结合,FADD可通过其死亡效应DED结构域与caspase-8的DED结合,在胞浆内形成信号复合物II,即DISC(death-inducing signalling complex,死亡诱导信号复合体),激活caspase-8,导致细胞凋亡或程序化坏死(necroptosis)(图3)[4, 17]。
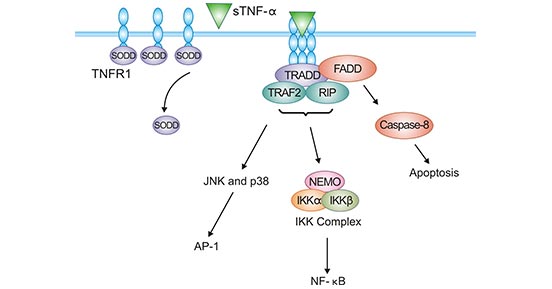
图3. TNFR1-sTNF-α信号通路
*本图来源于Cytokine 出版物[17]。
3.2 TNFR1-tmTNF-α信号通路
关于TNFR1-tmTNF-α的信号通路目前的研究机制尚不明确,有研究发现,TNFR1-tmTNF-α信号通路不同于TNFR1-sTNF-α,后者可介导生存或凋亡两种截然不同的信号途径。而TNFR1-tmTNF-α仅能介导细胞的凋亡,并不能激活NF-κB。虽然TNFR1与两型TNF结合都能引起凋亡,但两者的信号转导机制不同,细胞定位和影响因素也不同 [4]。
4. TNFR1在肿瘤疾病中的作用
近年来,越来越多的研究者发现,TNFR1广泛参与各种疾病的病理生理过程,尤其是在肿瘤中,其调控作用引起人们的重视。大量的数据表明,TNFR1在不同癌细胞中可以决定细胞不同的命运。虽然TNFR1包含死亡结构域,但通过不同的信号传导通路,TNFR1也可发挥促炎和致癌作用。所以TNFR1在癌症中,不总是发挥其应有的促凋亡生物学效应。
在恶性星形胶质瘤中,TNFR1和TNF结合,激活NF-κB通路,抑制肿瘤细胞的凋亡,研究提示TNFR1可能参与低度恶性星形细胞瘤的形成和恶性星形细胞瘤的发展 [18]。另有研究发现,在胃癌细胞中,TNFR1的表达水平与胃癌细胞的分化程度有关 [19];在大肠癌中,高表达TNFR1的病人存活率较高 [20]。最近一项研究发现,在肾透明细胞癌中,TNFR1表达,促进肿瘤样变,诱导耐药 [21]。而在一项小鼠模型实验中,研究人员评估了TNFR1在肝癌中的作用,数据显示TNFR1的缺失能显著降低小鼠肿瘤发生率,说明TNFR1介导的信号通路促进肝癌发生 [22]。
TNFR1参与到一个极其复杂的生物学过程,其对疾病的作用往往受到很多不可控因素(比如,患者个体化差异)的影响。目前对于TNFR1在人类全身各系统肿瘤中的表达研究还不是很深入,在造血系统、神经系统、泌尿生殖系统、消化系统以及头颈部的恶性肿瘤中,TNFR1均表达增强,其究竟是介导细胞增殖还是凋亡,需要更多的研究进一步阐明。因此,TNFR1抗体或者抗TNFR1抗体在肿瘤治疗中的意义重大。
5. TNFR1在COVID-19治疗中的潜在价值
自从新型冠状病毒(COVID-19)大流行开始以来,新型冠状病毒(COVID-19)已在地球上几乎每个国家被发现,全球超过200万人死亡。值得注意的是,在COVID-19患者中,研究者们发现了高水平的炎症和促炎性细胞因子,其中包括TNF,前面提到,TNF的功能主要通过TNFR1介导,所以单独阻断TNFR1来保持免疫系统功能,成为研究者们最为理想的途径。尽管目前市场上尚无抑制TNFR1的抗体药物,但令人兴奋的是,一项由葛兰素史克(GSK)公司研发的抗TNFR1药物(GSK-2862277)已进入临床二期,用于急性肺损伤。
事实上,制药工业界和学术界为治疗COVID-19正在做前所未有的努力中,强生、赛诺菲、辉瑞、默克等全球性公司正在开发近200种治疗药物,世界各国政府正投入巨额资金用于药物的研发。不断出现的市场需求,加上有机会解决人类最近记忆中最大的医学挑战之一-COVID-19,这让全球的医药企业都斗志激昂。尽管要真正了解COVID-19,还有很长的路要走,但是我们知道炎症是其中的重要组成部分,因此TNFR1抑制剂有望成为治疗冠状病毒患者的候选药物。
TNFR1蛋白
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
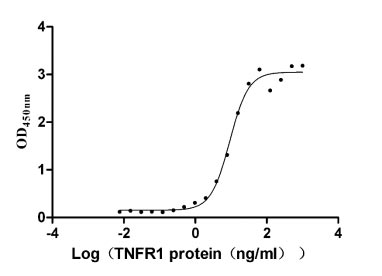
Immobilized TNF-α (CSB-YP023955HU) at 5 μg/ml can bind human TNFR1, the EC50 is 7.799-10.90 ng/ml.
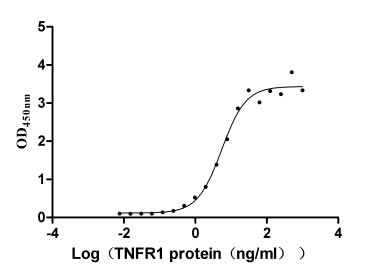
Immobilized LTA (CSB-MP013218HU) at 5 μg/ml can bind human TNFR1, the EC50 is 4.409-6.797 ng/ml.
参考文献:
[1] Ding, Husheng, et al. "CDK2-mediated upregulation of TNFa as a mechanism of selective cytotoxicity in acute leukemia." Cancer Research. 2021.
[2] Speeckaert, Marijn M., et al. "Tumor necrosis factor receptors: biology and therapeutic potential in kidney diseases." American journal of nephrology 36.3 (2012): 261-270.
[3] Gray, Patrick W., et al. "Cloning of human tumor necrosis factor (TNF) receptor cDNA and expression of recombinant soluble TNF-binding protein." Proceedings of the National Academy of Sciences 87.19 (1990): 7380-7384.
[4] Negm, Ola Hamdy El-Shahat. "Investigations of Signalling Pathways Activation by Mutant Tumour Necrosis Factor Receptors." (2011).
[5] Sedger, Lisa M., and Michael F. McDermott. "TNF and TNF-receptors: From mediators of cell death and inflammation to therapeutic giants–past, present and future." Cytokine & growth factor reviews 25.4 (2014): 453-472.
[6] Fischer, Roman, Roland E. Kontermann, and Olaf Maier. "Targeting sTNF/TNFR1 signaling as a new therapeutic strategy." Antibodies 4.1 (2015): 48-70.
[7] Deng, Guo-Min, et al. "Lupus serum IgG induces skin inflammation through the TNFR1 signaling pathway." The Journal of Immunology 184.12 (2010): 7154-7161.
[8] Jones, E. Y., D. I. Stuart, and NPC WALKER. "The structure of tumour necrosis factor-implications for biological function." Journal of Cell Science 1990.Supplement 13 (1990): 11-18.
[9] Li, Kang, et al. "The involvement of TNF-α and TNF-β as proinflammatory cytokines in lymphocyte-mediated adaptive immunity of Nile tilapia by initiating apoptosis." Developmental & Comparative Immunology 115 (2020): 103884.
[10] Wang, Xia, and Yong Lin. "Tumor necrosis factor and cancer, buddies or foes? 1." Acta Pharmacologica Sinica 29.11 (2008): 1275-1288.
[11] Shuh, Maureen, et al. "Tumor necrosis factor-α: life and death of hepatocytes during liver ischemia/reperfusion injury." Ochsner Journal 13.1 (2013): 119-130.
[12] Naudé, Petrus JW, et al. "Tumor necrosis factor receptor cross‐talk." The FEBS journal 278.6 (2011): 888-898.
[13] Gane, Jennie M., Robert A. Stockley, and Elizabeth Sapey. "TNF-α autocrine feedback loops in human monocytes: the pro-and anti-inflammatory roles of the TNF-α receptors support the concept of selective TNFR1 blockade in vivo." Journal of immunology research 2016 (2016).
[14] Van Hauwermeiren, Filip, Roosmarijn E. Vandenbroucke, and Claude Libert. "Treatment of TNF mediated diseases by selective inhibition of soluble TNF or TNFR1." Cytokine & growth factor reviews 22.5-6 (2011): 311-319.
[15] MacEwan, David J. "TNF ligands and receptors-a matter of life and death." British journal of pharmacology 135.4 (2002): 855-875.
[16] Miki, Kiyoshi, and Edward M. Eddy. "Tumor necrosis factor receptor 1 is an ATPase regulated by silencer of death domain."
Molecular and cellular biology 22.8 (2002): 2536-2543.[17] Li, Hongxiu, and Xin Lin. "Positive and negative signaling components involved in TNFα-induced NF-κB activation." Cytokine 41.1 (2008): 1-8.
[18] Yang, Zijun, et al. "Phosphorylated form of pyruvate dehydrogenase α1 mediates tumor necrosis factor α‑induced glioma cell migration." Oncology Letters 21.3: 1-1.
[19] Teng, Chih-Chuan, et al. "Novel regulator role of CIL-102 in the epigenetic modification of TNFR1/TRAIL to induce cell apoptosis in human gastric cancer." Food and Chemical Toxicology 147 (2020): 111856.
[20] Yun, Hyung-Mun, et al. "IL-32α suppresses colorectal cancer development via TNFR1-mediated death signaling." Oncotarget 6.11 (2015): 9061.
[21] Hwang, Hee Sang, et al. "Involvement of the TNF-α Pathway in TKI Resistance and Suggestion of TNFR1 as a Predictive Biomarker for TKI Responsiveness in Clear Cell Renal Cell Carcinoma." Journal of Korean medical science 35.5 (2020).
[22] Bluemel, Sena, et al. "Tumor necrosis factor alpha receptor 1 deficiency in hepatocytes does not protect from non-alcoholic steatohepatitis, but attenuates insulin resistance in mice." World Journal of Gastroenterology 26.33 (2020): 4933.











