HER2:原癌驱动基因,也是肿瘤耐药新靶点?
日期:2021-04-01 16:19:05
近期,在国际学术期刊Nature子刊《cell death & disease》在线发表题为“Targeting transcription of MCL-1 sensitizes HER2-amplified breast cancers to HER2 inhibitors” [1] 的研究论文引起了关注。该研究发现通过MCL-1抑制剂联合HER2抑制剂,能够有效逆转HER2扩增的乳腺癌细胞对药物的耐受,该研究为耐药肿瘤的治疗提供了新的方向,实用意义较大。近年来,HER2在癌症靶向治疗中扮演的角色已越来越受到重视。那么,HER2是什么?HER2在肿瘤靶向治疗中的作用如何?一起来了解一下。
1、HER2的结构及其功能
人表皮生长因子受体2(HER2,也称ERBB2)是表皮生长因子受体家族(EGFR)中的一员 [2]。HER2基因定位于染色体17q21,其编码产物是一种具有酪氨酸激酶活性的跨膜糖蛋白,分子量约为185 kD,又称为p185 [3, 4]。如图1所示,HER2蛋白结构由3部分组成,胞外结合域(the extracellular domain,ECD)、跨膜结构域(a transmembrane domain,TM)和胞内结构域(an intrcellular domain,ICD)。胞外区可分4个亚结构域(I-IV),I、III亚结构域为配体的结合位点,II、IV亚结构域存在丰富的半胱氨酸,可以形成同源或异源二聚体。跨膜区为α螺旋结构。胞内区包含了多个重要的环状结构,构成酪氨酸激酶的活性位点 [5, 6]。
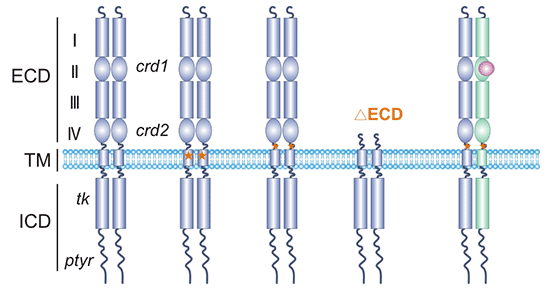
图1. HER2结构
*图片来源于Nature Structural & Molecular Biology 出版物[5]。
HER2具有酪氨酸激酶活性,在组织发育中起至关重要的作用,是胚胎发育所必需的 [7]。然而,在正常成年人机体组织中,HER2通常低表达或不表达。HER2的过表达往往会引起正常生物学功能的紊乱 [8]。许多研究表明,HER2的表达与多种肿瘤的发生、发展密切相关 [9]。
2、HER2介导的信号转导通路
迄今为止,尚未发现能与HER2直接结合的配体,必须与家族其他成员组成同源或异源二聚体,HER2二聚化后构象发生改变,激活胞内的酪氨酸激酶活性,从而启动下游信号传导通路 [10]。HER2主要参与细胞增殖的RAS-RAF-MEK-ERK通路以及细胞生存的PI3K-AKT-mTOR通路 [11]。
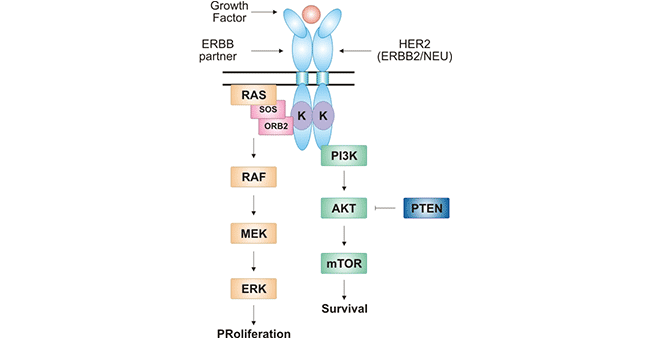
图2. HER2介导的信号转导通路
*图片来源于China National GeneBank (CNGB) [12]。
如图2所示,HER2与其家族中的HER3、HER4等形成异源二聚体,胞内的酪氨酸激酶活性激活。进而,在细胞膜内,鸟苷酸交换因子(SOS)与受体的结合使质膜RAS•GDP转换为RAS•GTP。随后,激活丝氨酸-苏氨酸激酶(RAF)和具有双重激酶活性的MEK。最终,级联激活丝裂原活化蛋白激酶(ERK)。ERK的激活可将信号转入细胞核内,活化多种转录因子的转录(如c-myc,c-fos和c-jun),引起细胞的增殖 [13]。另一方面,HER2的激活可活化三磷酸肌醇(PI3K),诱导AKT活化,进一步激活mTOR。PI3K-AKT-mTOR信号通路与细胞生长、增殖以及凋亡等密切相关 [14]。更为重要的是,许多研究表明HER2所介导的这两条信号通路与多种癌症疾病紧密相关 [15]。
3、HER2在肿瘤疾病中的作用
前面提到,HER2与其他HER家族基因形成异源二聚体,激活下游信号,促进癌细胞的侵袭和转移 [13-15]。研究发现HER2与多种癌症相关,包括乳腺癌、胃癌、结肠癌、膀胱癌、卵巢癌、子宫内膜癌、肺癌等 [16, 17]。其中,HER-2在乳腺癌和胃癌中的研究最为成熟。
HER2作为一个原癌基因,通过高水平的扩增来诱导蛋白在细胞膜上过表达,从而使细胞获得致癌性,这在乳腺癌相关的研究中报道较多。有研究表明,约20%-30%的乳腺癌患者中HER2基因过度表达。HER2过表达的乳腺癌浸润性强、复发和转移发生早、病人预后差 [18]。进一步的证据表明,HER2过表达的乳腺癌患者对化学疗法和激素疗法的反应较差 [19]。
另外,有研究提示HER2突变在乳腺癌发病、发展及抗HER2靶向耐药中起着重要作用。HER2的突变大部分位于酪氨酸激酶域或胞外域,可能是导致乳腺癌的一个重要因素 [20]。HER2基因过表达,对于乳腺癌的预后评价及指导治疗有及其重要的价值。近年来,以HER2为靶点的乳腺癌靶向治疗一直是研究的热点。
其次,在胃癌中,有超过20%胃癌患者HER2过表达。有数据表明,HER2的靶向治疗显著延长了HER2阳性晚期胃癌患者的生存期 [21],但也有研究发现HER2与胃癌预后无关 [22]。尽管HER2单克隆抗体成为靶向治疗的热点,但HER2与预后的关系仍有争议。通过对HER2与胃癌预后关系的深入研究,有望为胃癌治疗提供新途径。
4、HER2靶向治疗及临床前景
HER2靶向药物——曲妥珠单抗是第一个用于实体瘤治疗的分子靶向药物,开启了科学家探索癌症分子靶向药的大门。目前已上市的抗HER2靶向药物主要为:①曲妥珠单抗、帕妥珠单抗:两药合用可以互补增强对HER2通路的抑制。②抗体-药物偶联物(ADC):T-DM1(trastuzumab emtansine)是新型ADC,由曲妥珠单抗和细胞毒药物DM1连接而成,DM1发挥细胞毒作用,同时曲妥珠单抗发挥抗肿瘤作用。③拉帕替尼:可同时抑制HER1、HER2,从而阻断下游信号传导。④吡咯替尼:一种口服、不可逆的酪氨酸激酶抑制剂(TKI),同时抗EGFR/HER1、HER2 以及 HER4 活性,为我国自主研发的创新药。
HER2在多种恶性肿瘤中高表达,其中HER2过表达在相当大比例的乳腺癌中可见,且患者预后较差。目前,HER2靶向药物治疗乳腺癌已取得显著的临床疗效,数据表明曲妥珠单抗,T-DM1,帕妥珠单抗在治疗过表达HER2的乳腺癌中,对患者预后有显著的改善作用 [23]。此外,针对胃癌、结直肠癌的研究也在进行中。其中,曲妥珠单抗联合化疗在晚期胃癌的二线治疗中显示突出的疗效 [24]。曲妥珠单抗和拉帕替尼联合治疗HER2阳性转移性结直肠癌,有效且耐受良好 [25]。为进一步优化治疗策略,科学家们正在探索药物机制和耐药性相关的研究。HER2靶向药物治疗正在为癌症带来新的希望。
近二十年的肿瘤治疗历程中,抗HER2治疗取得了许多令人鼓舞的进展,新的抗HER2药物的出现,使肿瘤患者有了更多的选择,双靶的联合也提高了疗效,抗体-药物的结合使用使细胞毒作用发挥更充分,多靶点新药进一步降低了复发风险。如今,靶向治疗扮演了越来越重要的角色。靶向药物的副作用小,疗效显著,在改善患者生存质量的同时,也创造了巨大的市场机会。2020年乳腺癌新发病例数达226万人,首次超过肺癌(220万人)。抗HER2抗体也随着乳腺癌、胃癌等患病人数的不断上涨,需求量也不断增加。近年来,针对HER2靶点设计的药物一直是研究的热门,抗HER2抗体必将有巨大的市场刚性需求。
HER2蛋白
Recombinant Human Receptor tyrosine-protein kinase erbB-2(ERBB2),partial (Active) (CSB-MP007763HU)

(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
-AC1.jpg)
Immobilized HER2 at 2 μg/ml can bind Trastuzumab, the EC50 is 2.179-2.825 ng/ml.
参考文献:
[1] Yang, Xiang, et al. "Rewiring ERBB3 and ERK signaling confers resistance to FGFR1 inhibition in gastrointestinal cancer harbored an ERBB3-E928G mutation." Protein & cell 11.12 (2020): 915-920.
[2] Wang, Shizhen Emily, et al. "HER2 kinase domain mutation results in constitutive phosphorylation and activation of HER2 and EGFR and resistance to EGFR tyrosine kinase inhibitors." Cancer cell 10.1 (2006): 25-38.
[3] Yarden, Yosef. "Biology of HER2 and its importance in breast cancer." Oncology 61.Suppl. 2 (2001): 1-13.
[4] Read, Linnea D., et al. "Hormonal modulation of HER-2/neu protooncogene messenger ribonucleic acid and p185 protein expression in human breast cancer cell lines." Cancer research 50.13 (1990): 3947-3951.
[5] Sliwkowski, Mark X. "Ready to partner." Nature Structural & Molecular Biology 10.3 (2003): 158-159.
[6] Niazi, Sarfaraj, et al. "Revealing the molecular interactions of aptamers that specifically bind to the extracellular domain of HER2 cancer biomarker protein: An in silico assessment." Journal of Molecular Graphics and Modelling 83 (2018): 112-121.
[7] Cho, Hyun-Soo, et al. "Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab." Nature 421.6924 (2003): 756-760.
[8] Scholl, S., P. Beuzeboc, and P. Pouillart. "Targeting HER2 in other tumor types." Annals of oncology 12 (2001): S81-S87.
[9] Menard, S., et al. "Role of HER2/neu in tumor progression and therapy." Cell Mol Life Sci 61.23 (2004): 2965-78.
[10] Yarden, Yosef. "Biology of HER2 and its importance in breast cancer." Oncology 61.Suppl. 2 (2001): 1-13.
[11] Britten, Carolyn D. "PI3K and MEK inhibitor combinations: examining the evidence in selected tumor types." Cancer chemotherapy and pharmacology 71.6 (2013): 1395-1409.
[12] China National GeneBank (CNGB), Jinsha Road, Dapeng District, Shenzhen. https://db.cngb.org/dissect/repository/gene/detail/MET/
[13] Hilger, R. A., M. E. Scheulen, and D. Strumberg. "The Ras-Raf-MEK-ERK pathway in the treatment of cancer." Oncology Research and Treatment 25.6 (2002): 511-518.
[14] Gil, Eva Maria Ciruelos. "Targeting the PI3K/AKT/mTOR pathway in estrogen receptor-positive breast cancer." Cancer treatment reviews 40.7 (2014): 862-871.
[15] McCubrey, James A., et al. "Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascade inhibitors: how mutations can result in therapy resistance and how to overcome resistance." Oncotarget 3.10 (2012): 1068.
[16] Park, John W., et al. "Anti-HER2 immunoliposomes for targeted therapy of human tumors." Cancer letters 118.2 (1997): 153-160.
[17] Menard, Sylvie, et al. "Biologic and therapeutic role of HER2 in cancer." Oncogene 22.42 (2003): 6570-6578.
[18] Oh, Do-Youn, and Yung-Jue Bang. "HER2-targeted therapies-a role beyond breast cancer." Nature Reviews Clinical Oncology 17.1 (2020): 33-48.
[19] Yarden, Yosef. "Biology of HER2 and its importance in breast cancer." Oncology 61.Suppl. 2 (2001): 1-13.
[20] Bose, Ron, et al. "Activating HER2 mutations in HER2 gene amplification negative breast cancer." Cancer discovery 3.2 (2013): 224-237.
[21] Boku, Narikazu. "HER2-positive gastric cancer. "Gastric Cancer 17.1 (2014): 1-12.
[22] Kunz, Pamela L., et al. "HER2 expression in gastric and gastroesophageal junction adenocarcinoma in a US population: clinicopathologic analysis with proposed approach to HER2 assessment." Applied immunohistochemistry & molecular morphology: AIMM 20.1 (2012): 13.
[23] Goutsouliak, Kristina, et al. "Towards personalized treatment for early stage HER2-positive breast cancer." Nature Reviews Clinical Oncology 17.4 (2020): 233-250.
[24] Mitani, Seiichiro, and Hisato Kawakami. "Emerging targeted therapies for HER2 positive gastric cancer that can overcome trastuzumab resistance." Cancers 12.2 (2020): 400.
[25] Tosi, Federica, et al. "Long-term Clinical Outcome of Trastuzumab and Lapatinib for HER2-positive Metastatic Colorectal Cancer." Clinical Colorectal Cancer 19.4 (2020): 256-262.
上一篇: NRG1:极具潜力疾病治疗靶点,NRG1融合更为罕见致癌基因
下一篇: 技术|制备抗体时抗原的选择











