GFRAL:前景可期的代谢靶点,改善肥胖或癌症相关厌食/恶病质综合征(CACS)
日期:2021-10-22 09:56:32
根据世界卫生组织的统计,全球大约有四亿人是肥胖症患者,而且这一数字还在增长。全球确诊癌症患者数量达1930万。每年,上万人遭受肿瘤诱发的癌症相关厌食/恶病质综合征(Cancer-Related Anorexia/Cachexia Syndrome,CACS)。然而,目前针对肿瘤恶病质的治疗几乎是空白。2017年10月,科学家们首次鉴定出GFRAL为GDF-15的受体,并且证明GFRAL/GDF-15介导的信号通路可减少机体的食物摄入量,进而能够改善代谢相关性疾病。最近的研究还表明,GFRAL可能是治疗肿瘤患者恶病质的靶点。GFRAL作为新兴的潜力靶点,有望为干预肥胖症或改善癌症诱发的厌食症提供启发。那么,GFRAL及其配体介导的信号通路是什么?GFRAL与哪些疾病相关以及其靶向治疗的潜在价值如何?今天,我们一起来了解一下。
1. GFRAL的结构和表达
GDNF-family receptor α-like,GFRAL(也称为GRAL)属于胶质细胞源性神经营养因子(Glial Cell Line Derived Neurotrophic Factor,GDNF)家族α样受体。GFRAL基因定位于人6号染色体,含有9个外显子,且存在可变剪切体。GFRAL是一种I型跨膜蛋白,分子量约为44 kDa [1]。如图1所示,全长GFRAL蛋白由395个氨基酸残基组成,C-末端有20-30个可伸缩的疏水性氨基酸,N-末端存在一个信号肽。GFRAL蛋白通过糖基磷脂酰肌醇(GPI)锚定在细胞膜上 [1-3]。GFRAL作为一种单次跨膜蛋白,GFRAL位于细胞内的结构域较短,缺乏向细胞内传导信号的能力。现有研究发现,GFRAL特有的疏水口袋可介导GFRAL和特异性配体GDF-15之间的相互作用 [1-3]。GFRAL受体结合配体,且在酪氨酸激酶辅助受体RET协助下,介导下游信号的传导,从而发挥生物学作用 。
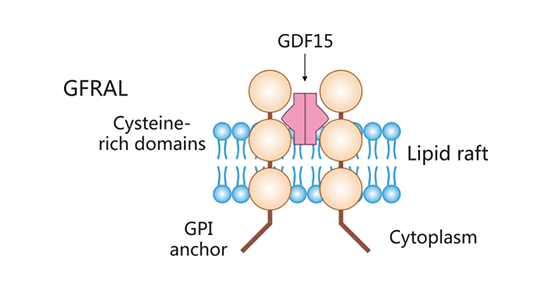
图1. GFRAL结构示意图
*图片来源于Annual Review of Physiology出版物 [1]
GFRAL局限地表达于小鼠脑干最后区以及孤束核的神经细胞上。GFRAL最高表达仅限于脑干后区的大脑。越来越多的数据表明,GFRAL的激活可调节新陈代谢,降低体重,改善血糖,将可用于严重肥胖、2型糖尿病以及厌食/恶病质治疗 [4]。近年研究表明GFRAL介导的信号机制与癌症相关。GFRAL或可作为潜在病变初始阶段的生物标志物,用于诸多疾病的诊断、治疗和疗效评估。
2. GFRAL的配体
GFRAL最近被鉴定为配体GDF-15分子的受体,两者具有较高亲和力,能够特异性结合,介导控制能量摄入和能量代谢调节的生物学效应。GDF-15是转化生长因子 β (transforming growth factor β,TGF-β)超家族的成员之一。GDF-15最初发现于活化的巨噬细胞中,亦被称为巨噬细胞抑制性细胞因子-1(macrophage inhibitory cytokine-1,MIC-1) [5]。在生理状况下,GDF-15在除胎盘组织以外的其他组织中不表达或者少量表达。然而,在病理状况下,GDF-15作为一种应激反应性细胞因子,在多种疾病中高表达,与许多生物学过程和疾病有关,包括肥胖,心血管疾病,炎症反应和自身免疫疾病以及癌症 [6]。
早期,GDF-15由于缺乏其确定的受体,其生物学功能的深入研究受到了限制。然而受体GFRAL的发现为肥胖等代谢相关疾病的治疗提供了新的思路。有研究提示,GFRAL与GDF-15共同作用改善肥胖症。陆续有实验表明,GFRAL与GDF-15可结合神经元表面的受体酪氨酸激酶RET形成复合物共同介导的下游信号的反应,打开身体能量代谢通路,参与许多病理生理过程 [4-6]。
3. GFRAL介导的信号通路机制
GFRAL通过结合GDF-15,激活GDF-15的活性。GFRAL/GDF-15再结合RET,介导下游的通路。也就是说GDF-15通过GFRAL依赖结合成多聚体,诱导一系列复杂的细胞内信号传导途径。目前,研究者对GFRAL/GDF-15或GFRAL/GDF-15/RET轴的生理功能在人类疾病中的作用和认识仍处于初级阶段,许多关键问题仍未得到解答。
现有的证据已明确GDF-15与GFRAL结合是募集RET的必要条件。同时,GFRAL/GDF-15发挥活性的基础依赖同RET结合成三聚体,进而传导信号。但GFRAL/GDF-15/RET信号传导的具体机制以及进一步生理作用尚待确定。如图2所示,综合应激反应(ISR)诱导人和小鼠的GDF-15应激性高表达,与后脑干产生的GFRAL和循环中的RET结合,形成三聚体 [1]。三聚体激活多个下游通路,在不同组织和器官中发挥生物效应。识别这些作用并确定它们是否能解释先前归因于GDF-15外周作用的一些表型,将为GFRAL/GDF-15/RET轴在人类疾病中的作用机制提供进一步的见解。
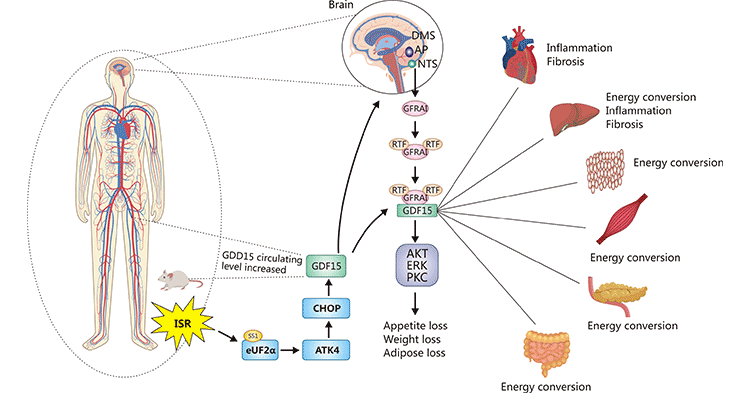
图2. GFRAL/GDF-15信号通路机制
*图片来源于Annual Review of Physiolog出版物 [1]
4. GFRAL在肥胖症和CACS等疾病中的作用
尽管GFRAL和配体GDF-15之间的复杂机制尚未明确,但GFRAL与GDF-15结合RET,形成的GFRAL/GDF-15/RET复合物,可激活胞内信号通路,参与调节新陈代谢。越来越多的研究发现,GFRAL有望作为严重肥胖 [7]、厌食症 [8]、肿瘤相关恶病质 [9] 治疗的潜在靶标。
肥胖症是一种由于营养物质过剩导致体内脂肪堆积而引起的代谢性疾病,与糖尿病、心脏病等一系列疾病相关。有研究者们分析了GDF-15对小鼠摄食量的影响,通过GFRAL基因敲除小鼠和普通实验小鼠的实验中发现,在缺乏GDF-15刺激时,敲除GFRAL与否对小鼠的摄食与体重并不产生明显影响。当在GDF-15刺激的条件下,携带GFRAL基因的野生型小鼠的摄食与体重明显降低。实验证实GFRAL对肥胖症的作用是GDF-15所介导的,也证明了GFRAL同样对肥胖症和能量代谢起举足轻重的作用 [10]。此外,在野生型小鼠中,口服二甲双胍增加循环中的GDF-15,可预防野生型小鼠高脂饮食引起的体重增加,但对缺乏GDF-15或其受体GFRAL的小鼠中不起作用。并在高脂饮食的肥胖小鼠中,二甲双胍减轻体重的作用被GFRAL拮抗剂抗体逆转 [10, 11]。由此说明,GDF-15与GFRAL结合可以激活下游能量代谢信号通路,起到提高代谢水平、降低体重的作用。因此,针对GDF-15与GFRAL互相作用机制的研究,有望为肥胖症治提供更多的可能性。
最新的研究发现,GFRAL/GDF-15/RET信号通路的激活,可引起恶心和呕吐,进而诱导厌食。在鼩鼱和大鼠中进行的实验发现,通过GDF-15外源性给药,GDF-15/GFRAL信号传导可引起厌食症发作前出现的呕吐和恶心行为 [12]。另有研究分析,持续营养过剩引起的“营养应激”会导致循环GDF-15水平升高,从而向大脑发出令人厌恶的内分泌信号 [13]。
GFRAL/GDF-15通路在癌症相关厌食或恶病质综合征,以及肿瘤方面也有一定的潜力。一方面,癌症相关厌食或恶病质综合征是指肿瘤患者在患病过程中不可控制的体重减轻,其症状包括厌食,肌肉量和脂肪组织减少引起的体重减轻。增加这类患者的体重则能显著改善肿瘤患者的存活率。研究人员发现,GFRAL受体拮抗单克隆抗体可抑制共表达RET和GFRAL的细胞中GDF-15诱导的信号转导。在小鼠模型中,该抗体给药可防止肿瘤诱导的体重减轻 [14]。另一方面,GDF-15/GFRAL通路与肿瘤相关,比如,在胰腺癌细胞中,有研究指出,胰腺导管腺癌细胞能够自分泌分化生长因子GDF-15,作用于胰腺癌细胞自身膜上GFRAL受体,通过GDF-15/GFRAL信号通路,促进胰腺癌细胞增殖及侵袭转移 [15]。但GFRAL/GDF-15在肿瘤中的具体作用仍未阐明,部分研究认为在肿瘤早期,GFRAL/GDF-15可能抑制肿瘤;然而在肿瘤中后期,GDF-15/GFRA却可能促进肿瘤 [1]。由此看出,GFRAL在肿瘤方面的调控极有可能是双面性的,正如硬币的正反面一样,GFRAL/GDF-15在疾病中的机制和治疗作用,还需开展更深入而精准的研究。
5. 靶向GFRAL的临床应用前景
随着GFRAL作为GDF-15的受体被发现,其介导的信号参与调控肥胖及改善癌症引起的恶病质综合征等功能逐步被揭示。一方面,GFRAL/GDF-15信号是人体内存在的天然应激通路,具有较高的安全性。另一方面,在细胞毒性化疗、癌症和其他严重全身疾病的背景下,GFRAL/GDF-15的升高很可能积极参与了恶心、呕吐和恶病质综合征的发病。大量的证据表明,GFRAL与GDF-15在部分疾病引起的病理性预警中扮演着重要的角色,尤其是肥胖症,使得GFRAL/GDF-15正成为潜在疾病的生物标志物。
GFRAL作为一个新的潜力靶标分子,目前暂无靶向GFRAL的临床在研药,但已有若干靶向GDF-15的药物处于临床阶段。无论如何,GFRAL在代谢中的重要作用将给未来研究带来新的启迪,是否可能通过注射外源性的GFRAL治疗代谢相关疾病,如肥胖,厌食症,糖尿病等,这些都需要进一步探索。仅管GFRAL/GDF-15信号通路已有诸多研究报道,但在不同疾病中的机制有待进一步阐明。因此,GFRAL用于代谢综合征的诊断和治疗之前,需更加全面的了解GFRAL/GDF-15信号机制以及GFRAL在代谢紊乱中扮演的积极或消极作用。从而进一步研发以GFRAL为靶点,兼顾安全与疗效的治疗措施。
6. GFRAL相关科研产品
为鼎力协助科研和药企人员针对GFRAL在肥胖、厌食症、肿瘤相关恶病质(CACS)等疾病中的临床应用研究,CUSABIO推出GFRAL活性蛋白(Code: CSB-MP750964MO1),助力您在GFRAL机制方面的研究或其潜在临床价值的探索。
GFRAL蛋白
● Recombinant Mouse GDNF family receptor alpha-like(Gfral),partial (Active) (Code: CSB-MP750964MO1)
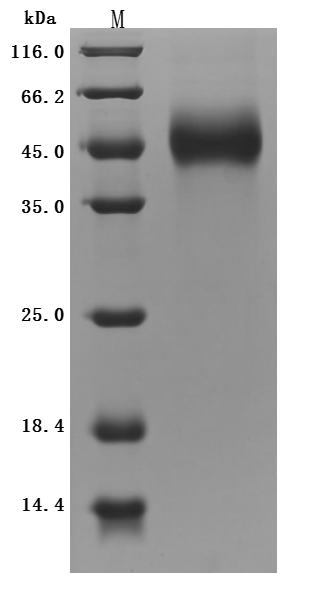
The high purity was greater than 95% as determined by SDS-PAGE.
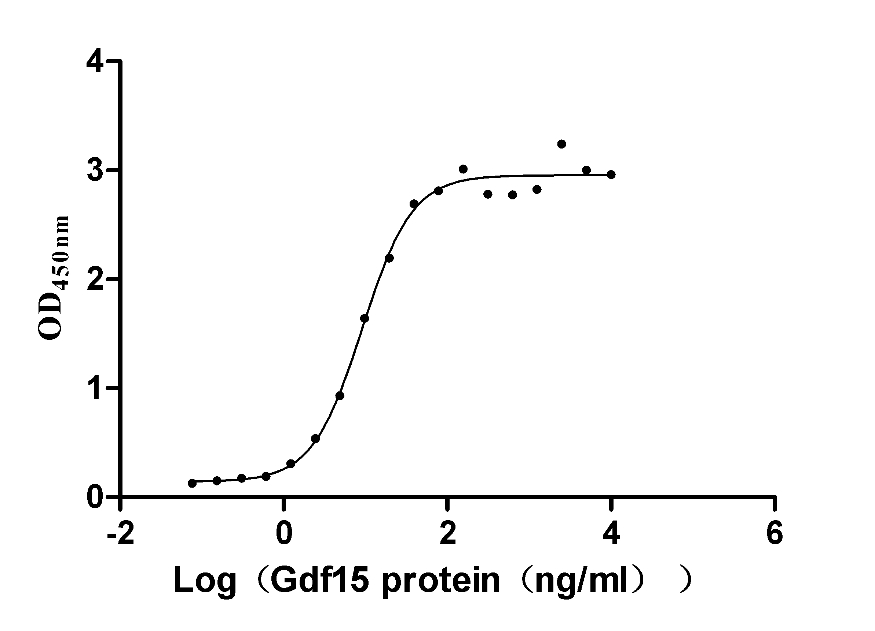
Immobilized Mouse Gfral at 5 μg/ml can bind Mouse Gdf15 (CSB-MP859530MO), the EC50 is 7.926-10.52 ng/mL
参考文献:
[1] Breit, Samuel N., David A. Brown, and Vicky Wang-Wei Tsai. "The GDF15-GFRAL pathway in health and metabolic disease: friend or foe?." Annual Review of Physiology 83 (2021): 127-151.
[2] Zhao, Zhiping, et al. "Upregulated GDF-15 expression facilitates pancreatic ductal adenocarcinoma progression through orphan receptor GFRAL." Aging (Albany NY) 12.22 (2020): 22564.
[3] Wischhusen, Jörg, Ignacio Melero, and Wolf Herman Fridman. "Growth/differentiation factor-15 (GDF-15): from biomarker to novel targetable immune checkpoint." Frontiers in Immunology 11 (2020): 951.
[4] Chang, Joon Young, et al. "The Role of Growth Differentiation Factor 15 in Energy Metabolism." Diabetes & Metabolism Journal 44.3 (2020): 363-371.
[5] Kempf, Tibor, et al. "GDF-15 is an inhibitor of leukocyte integrin activation required for survival after myocardial infarction in mice." Nature medicine 17.5 (2011): 581-588.
[6] Strelau, J., et al. "GDF-15/MIC-1 a novel member of the TGF-ß superfamily." Advances in Research on Neurodegeneration (2000): 273-276.
[7] Mullican, Shannon E., and Shamina M. Rangwala. "Uniting GDF15 and GFRAL: therapeutic opportunities in obesity and beyond. "Trends in Endocrinology & amp; Metabolism 29.8 (2018): 560-570.
[8] Tsai, Vicky Wang-Wei, et al. "GDF15 mediates adiposity resistance through actions on GFRAL neurons in the hindbrain AP/NTS. "International Journal of Obesity 43.12 (2019): 2370-2380.
[9] Assadi, Artin, Azadeh Zahabi, and Robert A. Hart. "GDF15, an update of the physiological and pathological roles it plays: a review. "Pflügers Archiv- European Journal of Physiology (2020): 1-12.
[10] Tsai, Vicky WW, et al. "The MIC-1/GDF15-GFRAL pathway in energy homeostasis: implications for obesity, cachexia, and other associated diseases." cell metabolism 28.3 (2018): 353-368.
[11] Coll, Anthony P., et al. "GDF15 mediates the effects of metformin on body weight and energy balance." nature 578.7795 (2020): 444-448.
[12] Rochette, Luc, et al. "Insights into mechanisms of GDF15 and receptor GFRAL: therapeutic targets." Trends in Endocrinology & Metabolism (2020).
[13] Ahmed, Darakhshan Sohail, et al. "GDF15/GFRAL Pathway as a Metabolic Signature for Cachexia in Patients with Cancer." journal of Cancer 12.4 (2021): 1125.
[14] Suriben, Rowena, et al. "Antibody-mediated inhibition of GDF15-GFRAL activity reverses cancer cachexia in mice." nature medicine 26.8 ( 2020): 1264-1270.
[15] Zhao, Zhiping, et al. "Upregulated GDF-15 expression facilitates pancreatic ductal adenocarcinoma progression through orphan receptor GFRAL." Aging (Albany NY) 12.22 (2020): 22564.











