IGF-like家族靶点IGFL1:新型“多功能”分泌蛋白分子,赋予促癌潜能!
日期:2022-01-28 09:40:36
近期,高分肿瘤学主流期刊《Cancer Letters》在线发表了题为“KLF5-induced lncRNA IGFL2-AS1 promotes basal-like breast cancer cell growth and survival by upregulating the expression of IGFL1”的研究论文 [1]。该研究发现,IGFL1参与调控Basal-like(基底型)乳腺癌细胞的增殖和肿瘤的生长,并进一步鉴定IGFL1是一种促癌基因,这将为乳腺癌靶向治疗提供新的思路。作为一款小众靶点,IGFL1目前处于非常早期的研究阶段。但是Nature,Science advances,Cancer Letters,Genomics等国际期刊已多次报道IGFL1在多种生物代谢过程的重要作用。陆续有研究表明IGFL1或可作为炎症皮肤性疾病和癌症的潜力治疗靶点。目前,国内外研究人员正慢慢揭开它的神秘面纱。今天,我们就来简述一下这个闪亮登场的新型IGFL1靶点。
什么是IGFL1?
IGFL1是胰岛素样生长因子-1(Insulin growth factor-like family member 1IGFL1),属于IGF-like(IGFL)家族。2006年,Peter Emtage等人的研究发现了一个新的人类分泌蛋白家族,并将其命名为IGF-like(IGFL)家族。IGF-like(IGFL)基因编码约100个氨基酸的蛋白质,由小型分泌蛋白组成,含有11个保守的半胱氨酸残基,包括两个CC基序。在人类中,IGF-like(IGFL)家族包含四个基因(IGFL1,IGFL2,IGFL3,IGFL4)和两个假基因(IGFL1P1和IGFL1P2)。人IGF-like(IGFL)基因定位于19号染色体220 kb区间,家族成员以35 kb的间隔聚集。IGFL在机体组织中通常不表达或表达很少。有数据表明,IGFL1在肾上腺、骨髓、脑、前列腺、皮肤、小肠、甲状腺和子宫等广泛组织中均不表达;在胎儿皮肤、正常乳腺、卵巢、脊髓中表达。此外,有关数据库分析显示,在癌细胞中,比如,鳞状细胞癌、子宫肿瘤、头颈部肿瘤,IGFL1存在表达,提示IGFL1有望作为一个新型的癌症潜力靶点 [2]。
IGFL1和受体IGFLR1
IGFLR1为IGFL1的受体,2011年,Adrian A. Lobito等作者发现人IGFL1同在结构上与肿瘤坏死因子受体家族(TNFRs)相似的新受体IGFLR1(以前叫TMEM149)具有特异性和高亲和力。于是,IGFLR1首次被鉴定为IGFL1的受体。同时,IGFLR1也被认为是TNFR家族中的一种新型受体。IGFLR1基因定位于19号染色体上,广泛表达于淋巴结、脾脏和肾脏。Adrian的研究还指出,IGFLR1在小鼠T细胞上表达最多,其高表达会促进炎症的浸润和激活,提示皮肤产生的IGFL1结合受体IGFLR1可能对T细胞反应发挥调节作用 [3]。
IGFL1和受体IGFLR1作为新兴的靶点,目前两个靶点之间的互相作用机制报道不多。2022年的最新一篇文献发现,IGFLR1可能是胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)的重要致病因素之一。胰腺的导管腺癌是胰腺癌的主要肿瘤类型,占80%~90%。通过疾病关联基因分析工具VAAST,研究人员筛选出IGFLR1等多个致病候选基因,其中IGFLR1排在前15内 [4]。另有一项研究表明IGFLR1的高表达水平可以预测肾透明细胞癌(ccRCC)患者的低生存率。对结直肠癌(CRC)T细胞的追踪研究发现,IGFLR1在CXCL13+BHLHE40+TH1样细胞和CD8+晚期T细胞中均高表达,并具有共刺激功能,表明IGFLR1可能为CRC的诊断、治疗和预后提供重要价值 [5]。
IGFL1-潜力“多功能”调节分子
由于其它IGF家族成员参与到丰富的生物学代谢过程控制,比如IGF1,是一款多功能调节因子。IGF1不仅参与机体多种组织细胞调节包括增值、分化、凋亡、迁移、存活,而且在生长代谢、骨质疏松、皮肤性疾病、肿瘤的发生发展中发挥重要作用。由于IGFL1蛋白与IGF蛋白的结构相似性,在功能方面可能会有所相似性。目前,已有的研究表明,IGFL1可能参与相似疾病的调控,比如生长方面的调节、炎症性皮肤疾病(过敏性皮肤疾病和银屑病)、癌症(乳腺癌和卵巢癌等等)。
IGFL1和生长代谢
前面提到的IGF1,它是机体中的一种生长调节剂。因此,IGFL1蛋白也可能一个重要的生长激素分子。而事实上,IGFL1基因的表达模式也支持这一假设。有数据表明,IGFL1基因在胎儿上皮组织中表达,该组织的生长和分化倾向较高 [2]。
IGFL1和炎症性皮肤病调控
有研究报道揭示了IGFL1作为过敏性皮炎(AD)疾病的候选靶基因,可能与AD患者免疫反应的异常激活有关,尤其是Th17免疫的激活,它是T细胞通路中的关键亚型之一。过敏性皮炎是一种常见的炎症性皮肤病,过敏性皮炎患者往往伴随各种细胞因子表达水平的失衡,其特征是皮肤中存在分泌促炎细胞因子的活化T细胞亚型(Th1、Th2、Th17)。这种T细胞介导的免疫失调是多种炎症性皮肤病发病机制的核心。调节患病皮肤中T细胞的开启和激活是开发有效治疗这些疾病的关键。因此,靶向IGFL1可能代表了AD治疗的一种新方向 [6, 7]。
此外,研究人员通过GEO数据库发现,IGFL1在人类银屑病皮肤样本中表达上调,是银屑病疾病的Hub关键基因。与此同时,越来越多的实验数据表明,IGFL1在银屑病受病皮肤中高表达。银屑病俗称牛皮癣,是一种慢性炎症性皮肤病,病程较长,有易复发倾向,由于病因不明,与遗传、感染、免疫、内分泌等有关,有的病例甚至无法治愈。因此,IGFL1有望作为银屑病治疗的潜力候选靶标 [3, 8]。
IGFL1和肿瘤疾病调控
越来越多的文献报道表明IGFL1可能与多个肿瘤的调控过程相关。目前IGFL1和肿瘤相关的研究主要包括Basal-like型乳腺癌(三阴性乳腺癌)、卵巢癌、肝癌、黑色素瘤、食管鳞癌。
在Basal-like型乳腺癌中,研究发现IGFL2-AS1可通过调控IGFL1促进肿瘤细胞的增殖和生长(图1) [1]。另外,体内以及体外实验证实IGFL1和IGFL2-AS1是癌基因。临床样本分析显示,IGFL1高表达与三阴性乳腺癌病人的预后呈负相关 [1]。通过TCGA数据库分析,在卵巢癌中,IGFL1差异性高表达与不良预后密切相关,或可作为卵巢癌潜在预测指标 [9]。在肝癌中,TCGA数据也确定了IGFL1等多个肿瘤相关成纤维细胞(Cancer-associated fibroblasts,CAF)标记靶点 [10]。在黑色素瘤中,差异表达基因(DEGs)分析表明,IGFL1表达变化可影响耐受 [11]。在食管鳞癌中,IGFL1被确定为差异表达lncRNAs的调控靶点基因 [12]。
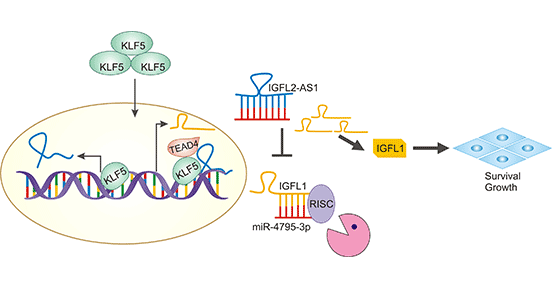
图1. IGFL1参与调控Basal-like型乳腺癌
IGFL1-临床的应用前景
目前,IGFL1靶点在临床中的有效性和治疗途径的探索有待研究。但随着研究人员针对IGFL1靶点作用机制的深入了解,IGFL1在各种生物调节网络中的作用有望为多种疾病的诊断及治疗开辟新的天地。已有越来越多的生物学分析表明,IGFL1在生长、炎症疾病、和肿瘤发生过程中扮有重要的角色,这些都预示了IGFL1有望成为潜力的炎症性皮肤疾病(过敏性皮肤疾病和银屑病)以及肿瘤疾病治疗(乳腺癌和卵巢癌)药物之一。
为鼎力协助科研和药企人员针对IGFL1在机体功能调节方面,以及IGFL1在皮肤性疾病和肿瘤中的临床应用研究,CUSABIO推出IGFL1活性蛋白(Code: CSB-MP764932HU)及其IGFLR1受体活性蛋白(Code: CSB-MP862025HUd9)产品,助力您在IGFL1机制方面的研究或其潜在临床价值的探索。
● Recombinant Human Insulin growth factor-like family member 1(IGFL1) (Active)
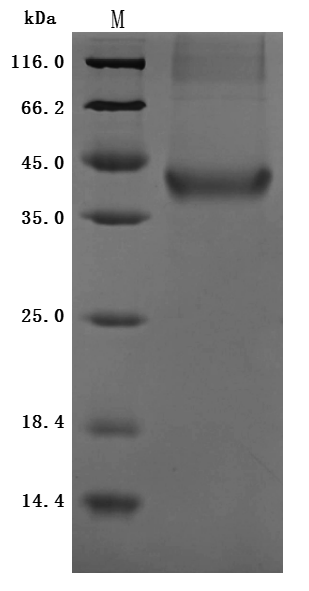
Purity was greater than 95% as determined by SDS-PAGE.(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
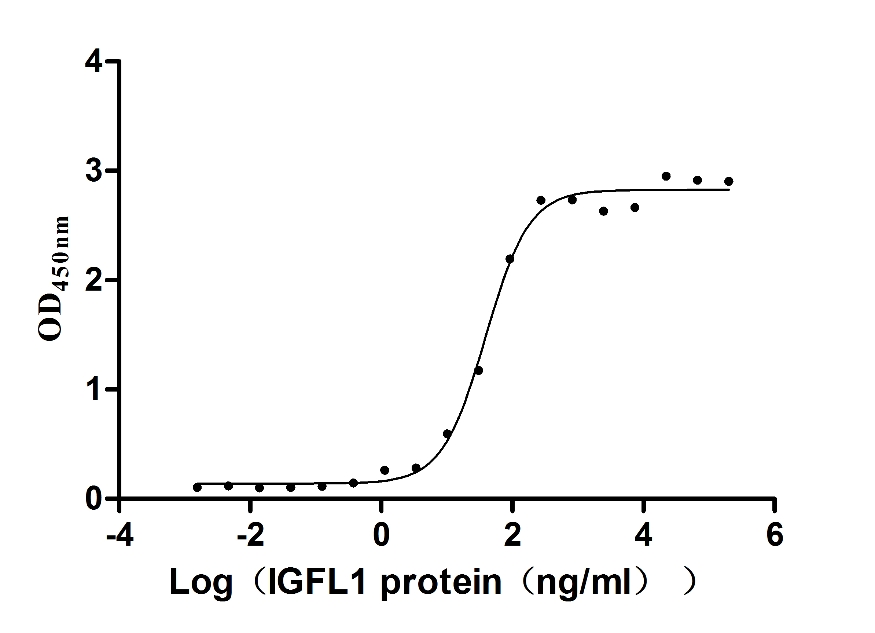
Measured by its binding ability in a functional ELISA. Immobilized Human IGFLR1 (CSB-MP862025HU) at 2 μg/ml can bind Human IGFL1, the EC50 is 32.33-47.52 ng/mL.
● Recombinant Human IGF-like family receptor 1(IGFLR1), partial (Active)
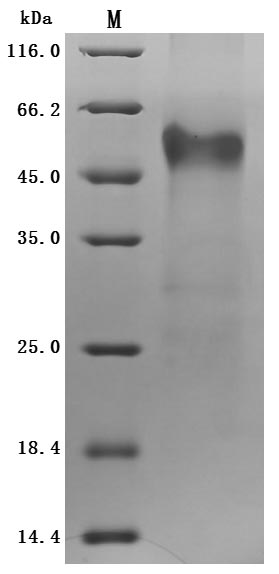
Purity was greater than 95% as determined by SDS-PAGE.(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
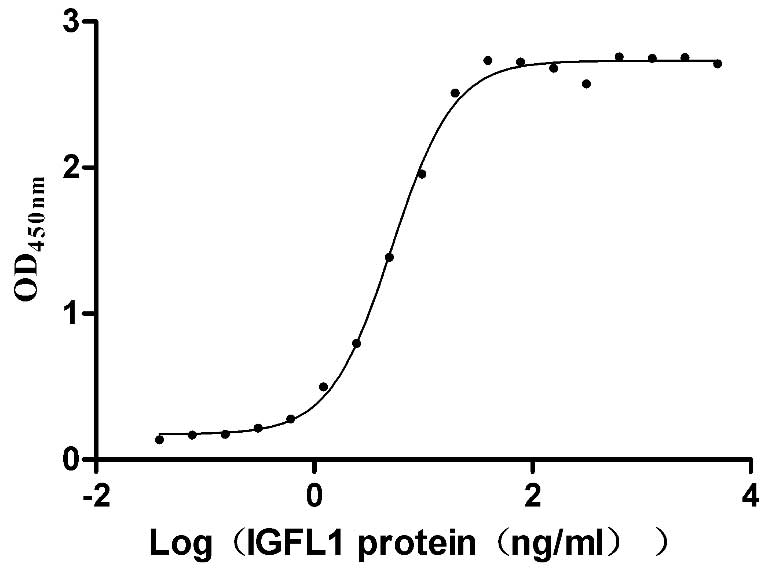
Measured by its binding ability in a functional ELISA. Immobilized Human IGFLR1 at 2 μg/ml can bind Human IGFL1 (CSB-MP764932HUh8), the EC50 is 4.640-5.722 ng/mL.
参考文献:
[1] Wang, Haixia, et al. "KLF5-induced lncRNA IGFL2-AS1 promotes basal-like breast cancer cell growth and survival by upregulating the expression of IGFL1." Cancer Letters (2021).
[2] Emtage, Peter, et al. "IGFL: a secreted family with conserved cysteine residues and similarities to the IGF superfamily." Genomics 88.4 (2006): 513-520.
[3] Lobito, Adrian A., et al. "Murine insulin growth factor-like (IGFL) and human IGFL1 proteins are induced in inflammatory skin conditions and bind to a novel tumor necrosis factor receptor family member, IGFLR1." Journal of Biological Chemistry 286.21 (2011): 18969-18981.
[4] Yu, Yao, et al. "A whole-exome case-control association study to characterize the contribution of rare coding variation to pancreatic cancer risk." Human Genetics and Genomics Advances 3.1 (2022): 100078.
[5] Zhang, Lei, et al. "Lineage tracking reveals dynamic relationships of T cells in colorectal cancer." nature 564.7735 (2018): 268-272.
[6] Jin, Lei, Lin Deng, and Wanchun Wang. "Candidate Genes of Allergic Dermatitis Are Associated with Immune Response." Journal of Healthcare Engineering 2022 (2022).
[7] Lobito, Adrian A., et al. "MURINE IGFL AND HUMAN IGFL1 ARE INDUCED IN INFLAMMATORY SKIN CONDITIONS AND BIND TO A NOVEL TNF RECEPTOR FAMILY MEMBER, IGFLR1." (2011).
[8] Guo, Pi, et al. "Gene expression profile based classification models of psoriasis." Genomics 103.1 (2014): 48-55.
[9] Ji, Xiaorong, et al. "High Expression of IGFL1 Predicts Poor Prognosis of Serous Ovarian Carcinoma." revista Argentina de Clínica Psicológica 29.4 ( 2020): 981-989.
[10] Zou, Baojia, et al. "A novel 12-marker panel of cancer-associated fibroblasts involved in progression of hepatocellular carcinoma." Cancer management and research 10 (2018): 5303.
[11] Shi, Alvin, et al. "Plasma-derived extracellular vesicle analysis and deconvolution enable prediction and tracking of melanoma checkpoint blockade outcome." Science advances 6.46 (2020): eabb3461.
[12] Kodaira, Himiko, et al. "ANXA10 induction by interaction with tumor-associated macrophages promotes the growth of esophageal squamous cell carcinoma." Pathology international 69.3 (2019): 135-147.











