生长抑素受体SSTR2:SSTR家族实力靶点,拓宽NET神经内分泌肿瘤治疗途径!
日期:2022-05-25 13:14:21
2022年第19届欧洲神经内分泌肿瘤学会年会(2022 ENETS)于3月在巴塞罗那举办。ENETS作为神经内分泌肿瘤 (Neuroendocrine tumors,NET)诊治领域的最高水平的学术会议,本届大会上,生长抑素受体SSTR相关研究成为热点。NET高 度异质性和罕见性是精准肿瘤治疗的难点。近年来,SSTR家族靶点被认为是NET治疗中最重要的靶点,同时也是NET诊断中的重要 靶点。在SSTR家族中,研究报道最多的是生长抑素受体亚型SSTR2。大量数据显示,SSTR2在神经内分泌肿瘤中特异性表达,成为 NET靶向治疗极具实力靶点。事实上,基于SSTR2的药物,已广泛应用于多种内分泌疾病的诊断和治疗,如肢端肥大症,罕见病库 欣综合征。目前,SSTR2有望在NET治疗中发挥关键的靶向作用,为NET治疗提供更好的策略。那么,SSTR家族如何发现?SSTR2为 何脱颖而出?
1、SSTR家族的发现
1973年Brazeau等人在羊的下丘脑提取物中首次发现了生长抑素(Somatostatin, SST)。随后的研究表明,SST主要分布 于神经系统、胰腺、胃肠道以及免疫系统 [1]。SST具有广泛且高效的抗分泌功能,是重要的激素分泌抑制剂。1990 年代以后,利用配体结合分析技术,生长抑素受体(Somatostatin Receptor,SSTR)被发现。目前,研究者们已克隆和鉴定出 五种SSTR亚型,按发现的顺序分别命名为SSTR1、SSTR2、SSTR3、SSTR4和SSTR5 [2-3]。机体内各组织可表达多种 SSTR,其中以SSTR2表达最多。
研究表明,SSTR属于G蛋白偶联受体(GPCR) 家族,SST主要是靶向于SSTR发挥作用。五种亚型均与Gi蛋白偶联,通过调节腺苷酸环化酶(Adenylate Cyclase,AC)的活性, 进而影响胞内cAMP浓度,将外源信号传递至胞内。因此,SSTR在介导生长抑素的生物学活性和功能方面尤为重要。在人机体中, SSTR参与多种激素的分泌调节,且与肿瘤的生长和增殖等过程相关(图1) [4]。SSTR对不同组织中各类细 胞的影响取决于细胞表面表达的生长抑素受体亚型,在这些亚型中,SSTR2是研究最多的。
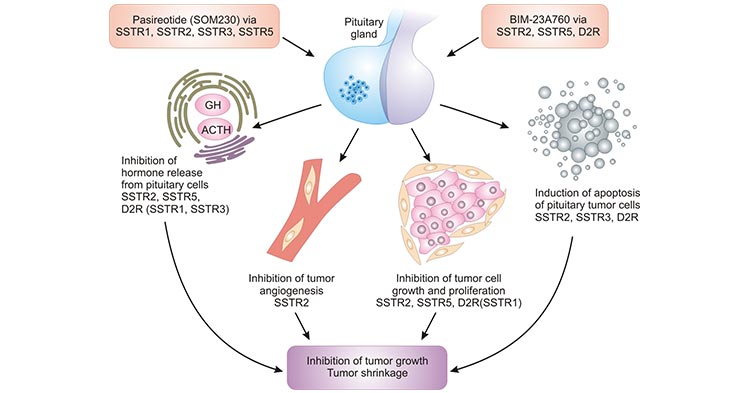
图1. SSTR家族调控重要机体活动 [4]
*图片来源于Nature Reviews Endocrinology出版物 [4]
2、什么是SSTR2?
生长抑素受体2(Somatostatin Receptor 2,SSTR2)是一类G蛋白偶联受体(GPCR),其天然配 体是生长抑素(SST) [5]。它是一种碱性稳定亲水性蛋白,无信号肽,存在7个跨膜区,作用于质膜结构 (图 2) [1]。二级结构主要为α-螺旋,属7tm GPCRs超家族。SSTR2基因及其编码蛋白在进化上高度保守,参 与调控G蛋白偶联受体信号通路。SSTR2是唯一一种有SSTR2a和SSTR2b这2种异构体的SSTR亚型受体蛋白 [6]。通过 STRING蛋白网络互作分析,SSTR2相互作用的蛋白质包括CORT、SST、NPY、GHRL、GNAI1、GNAI2、GNAI3、SHANK1、HIVEP2 [7]。大量研究证实,SSTR2蛋白主要参与G蛋 白偶联受体途径等生物学过程;参与调控GTP酶激活蛋白结合和多类激素活性等分子功能,与疾病联系紧密 [8]。
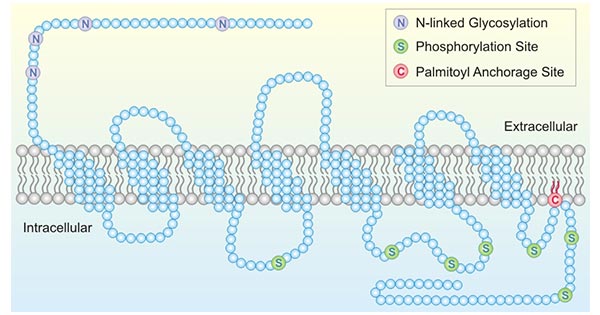
图2. SSTR2a 结构示意图 [1]
*图片来源于Cellular peptide hormone synthesis and secretory pathways出版物 [1]
SSTR2广泛分布于正常组织中,如脑下垂体、胰岛、肾上腺、胸腺、胃肠道以及免疫系统等,在不同受体的组织,表达谱 各不相同。研究表明,SSTR2与胃酸分泌、组胺及胃泌素的释放等关系密切 [9]。进一步的研究表明,SSTR2在多种 类型的实体瘤中常高表达,包括神经内分泌瘤和小细胞肺癌 [10-11]。目前,SSTR2在肢端肥大症、库欣病、消化道 出血和垂体肿瘤、神经内分泌肿瘤、神经母细胞瘤等治疗方面应用广泛。SSTR2已发展成为治疗多种疾病的潜在候选药物。
3、SSTR2结合SST的抗肿瘤作用机制
当SSTR2或其它亚型与SST结合后,可能经cAMP,MAPK,PI3K等信息通路,抑制DNA合成发挥抗肿瘤 作用 [12-14] (图3)。目前发现,SSTR2或其它亚型结合SST后,抗肿瘤的作用机制主要涉及以下传导途径 :
1)腺苷酸化环化酶途径:SSTR与腺苷酸化环化酶结合,降低细胞内环腺嘌呤核苷酸(adenosine monophos-phate,cAMP )水平,低浓度的cAMP抑制蛋白激酶的活性,进而阻止癌基因激活,抑制肿瘤。
2)蛋白酪氨酸磷酸途径:SSTR导致蛋白酪氨酸磷酸酶(PTP)上调,使酪氨酸激酶去磷酸化而失活,并抑制促丝裂原活 化蛋白激酶(MAPK)等多种蛋白激酶,抑制癌基因,c-fos、c-mys、c-jun等转录激活,从而抑制DNA和蛋白质的合成。
3)磷脂酞肌醇3激酶途径:SSTR通过抑制PI3K以及上调p21和p27的表达,抑制PRb的磷酸化和E-细胞周期依赖激酶复合体 (cyclin E-cyclin-dependent kinase 2 complex)。
4)钙离子通道途径:SSTR使Ca2+和H+间发生离子交换,降低细胞内Ca2+的浓度, 增加胞内环境的酸化水平,使细胞增殖发生抑制。
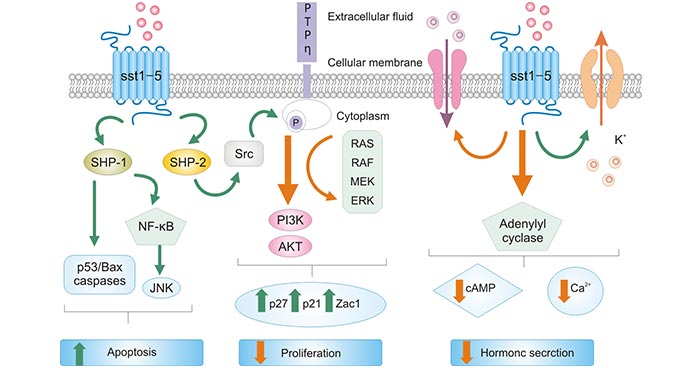
图3. SSTR结合SST抗肿瘤机制 [14]
*图片来源于Molecules出版物 [14]
4、SSTR2在肿瘤等疾病中的作用
如前所述,SSTR2可参与生物体内的众多细胞信号传导通路,如GPCR下游信号和腺苷酸环化酶抑制途径,通过改变其结构 来激活下游的信号分子,进而调控生命体的众多生理和病理反应过程。近年来,SSTR2被作用于肢端肥大症、库欣病和消化道出 血。此外,大量研究证实,SSTR2在多种肿瘤细胞中频繁高表达,尤其是神经内分泌瘤。借助于这些特性,SSTR2已经成为治疗肢 端肥大症,以及神经内分泌瘤等肿瘤的重要靶点。
4.1 SSTR2与肿瘤
SSTR2除了在正常组织中分布较为广泛外,在多种类型的实体瘤中常过度表达,如热门的神经内分泌肿瘤。有研究发现, 80-90%的肺神经内分泌肿瘤都表达SSTR,且主要是SSTR2,分化好的肺神经内分泌瘤相比于未分化的SSTR2表达密度高 [15 -16]。神经内分泌肿瘤(Neuroendocrine tumors,NET)包括来自内分泌和神经系统的多种激素分泌肿瘤,这些细胞通常 具有遗传性或散发性基因突变,目前用于NET肿瘤的治疗方法主要包括化学疗法和放射疗法,但毒性大。SSTR2将是开发NET的新 治疗方法的潜力靶点。除了NET,SSTR2还在多种肿瘤细胞中广泛表达,表现出多功能,包括神经母细胞瘤 [17]、垂 体腺瘤 [18]、黑色素瘤 [19]、甲状腺癌 [20]、脑膜瘤 [21]、乳腺癌 [22]、胃癌 [23]、肺癌 [24]等等。因此,SSTR2靶点正成为肿瘤靶向治疗研究的热点。
4.2 SSTR2与肢端肥大症等疾病
SSTR2不仅在肿瘤中发挥重要的功能,它的表达还和内分泌与代谢等疾病相关,如库欣综合征、肢端肥大症、垂体ACTH分 泌过多 [25-26]。肢端肥大症是一种由于垂体腺瘤分泌过量生长激素,起病隐匿的慢性进展性内分泌疾病。库欣病 是一种罕见的疾病,又称皮质醇增多症,是肾上腺皮质长期分泌过多糖皮质激素所产生的临床症候群。目前基于SSTR2靶点,已 有多款上市药物用于这类疾病的治疗。
5、SSTR2临床研究前景
基于Umabs DB抗体药物数据库(https://www.umabs.com/)和ParmSnap数据库显示(表1),针对SSTR2蛋白的抗体药物 研发处在早期,仅1款药物Tidutamab处于临床阶段,适应症为神经内分泌肿瘤、皮肤恶性肿瘤和小细胞肺癌,来自美国公司 Xencor, Inc.,但有报道,目前该管线的临床试验的结果并不理想。Tidutamab是一款靶向SSTR2 x CD3的双特异性抗体,通过依 赖CD3激活T细胞,对表达SSTR2的肿瘤细胞进行杀伤。过去这些年,SSTR2的药物研发已经取得较大进展,如下表,包括合成多肽 、小分子化药、融合蛋白、抗体药。
当前,抗肿瘤抗体药物已成为癌症治疗方法的重要组成,其对正常细胞的副作用小,体内靶向性分布,具有更加强的疗 效。随着对SSTR2的深入研究,越来越多的文献数据表明,SSTR2蛋白在靶向治疗肿瘤中的巨大潜力,特别是神经内分泌肿瘤。而 SSTR2蛋白的抗体药物研发也正在受到制药公司的青睐,我们期待更多的临床试验验证。因此,未来研发更为安全、有效、低副 作用的靶向SSTR2抗体药物势在必行,这也将扩宽神经内分泌肿瘤等疾病的治疗策略!
| 药物 | 靶点 | 在研适应症 | 药物类型 | 在研机构 | 最高研发状态(全球) |
|---|---|---|---|---|---|
| Lutetium Dotatate LU-177 (177镥)镥氧奥曲肽 |
SSTR2 | 神经内分泌肿瘤;胰神经内分泌瘤;胃癌 | 合成多肽 | 北京先通国际医药科技股份有限公司;高级催化剂应用品有限公司;北京大学 | 批准上市 |
| PASIREOTIDE DIASPARTATE 门冬氨酸帕瑞肽 |
SSTR1;SSTR2;SSTR3 | 库欣综合征;肢端肥大症;垂体ACTH分泌过多 | 合成多肽 | Novartis Europharm Ltd.;Novartis Pharma AG;北京诺华制药有限公司 | 批准上市 |
| Vapreotide Acetate 醋酸伐普肽 |
SSTR2;SSTR5 | 腹泻;食管胃静脉曲张;神经内分泌肿瘤 | 合成多肽 | Debiopharm Group;德拜奥维森公司 | 批准上市 |
| Somatostatin Acetate 醋酸生长抑素 |
SSTR1;SSTR2;SSTR3 | 消化道出血;胰腺炎 | 合成多肽 | 德国来奥大药厂 | 批准上市 |
| Somatostatin(BCN Peptides SA) 生长抑素(BCN Peptides SA) |
SSTR1;SSTR2;SSTR3 | 糖尿病性视网膜病变 | 合成多肽 | BCN肽类股份有限公司 | 临床3期 |
| Paltusotine | SSTR2 | 肢端肥大症;恶性类癌综合征;神经内分泌肿瘤 | 小分子化药 | 克林提克斯医药股份有限公司 | 临床3期 |
| ITF-2984 | SSTR5;SSTR4;SSTR3 | 肢端肥大症 | 小分子化药 | Italfarmaco SA | 临床2期 |
| Tidutamab(Xencor, Inc.) | SSTR2;CD3 | Merkel细胞癌;小细胞肺癌;神经内分泌肿瘤 | 双特异性抗体 | 赞科股份有限公司((Xencor, Inc.) | 临床2期 |
| Gallium-68 satoreotide | SSTR2 | 神经内分泌肿瘤;胰神经内分泌瘤;胃癌 | 合成多肽 | 益普生 | 临床2期 |
| DG-3173 | SSTR2;SSTR5;SSTR4 | 肢端肥大症 | 合成多肽 | Strongbridge Biopharma Plc;Aspire Pharma Ltd. | 临床2期 |
| Dopastatin | SSTR2;DRD2;SSTR5 | 垂体肿瘤 | 合成多肽 | Tiburio Therapeutics, Inc. | 临床2期 |
| TBR-065 | SSTR2;DRD2 | 肢端肥大症 | 融合蛋白 | 益普生;Tiburio Therapeutics, Inc. | 临床2期 |
| 68Ga-NOTA-3PTATE-RGD | SSTR2;ITGAV&ITGB3 | 肺癌 | 多肽 | 中国医学科学院北京协和医院 | 临床1期 |
| ONO-5788 | GHRH;SSTR2 | 肢端肥大症 | 小分子化药 | 小野药品工业株式会社 | 临床1期 |
| CRN-01941 | SSTR2 | 神经内分泌肿瘤 | 小分子化药 | 克林提克斯医药股份有限公司 | 临床1期 |
| ZT 01 | SSTR2 | 低血糖;2型糖尿病 | / | Zucara Therapeutics, Inc. | 临床1期 |
| Somatostatin 生长抑素 |
SSTR5;SSTR4;SSTR3 | / | 化学药 | 山东新时代药业有限公司 | 临床申请 |
| ONO-ST-468 | SSTR2 | 肢端肥大症 | 化学药 | 小野药品工业株式会社 | 临床前 |
表1. 靶点SSTR2的药物研发最新进展
为鼎力协助各药企针对SSTR2靶点在NET神经内分泌肿瘤等疾病药物方面的研发 工作,CUSABIO推出SSTR2活性蛋白产品(Code: CSB-MP022725HU),助力您在SSTR2机制方面的研究或其潜在临 床价值的探索。
● Recombinant Human Somatostatin receptor type 2 (SSTR2)-VLPs (Active)
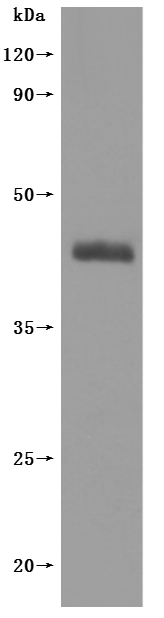
The Specificity was validated by Western Blot. CSB-MP022725HU is detected by Mouse anti-6*His monoclonal antibody.
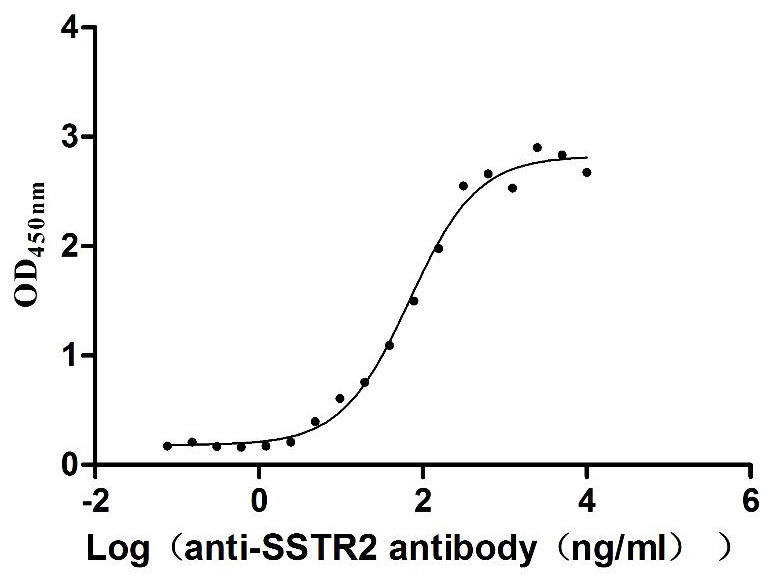
Immobilized Human SSTR2 at 10 μg/ml can bind Anti-SSTR2 recombinant antibody (CSB-RA022725MA01HU), the EC50 is 58.13-81.28 ng/mL
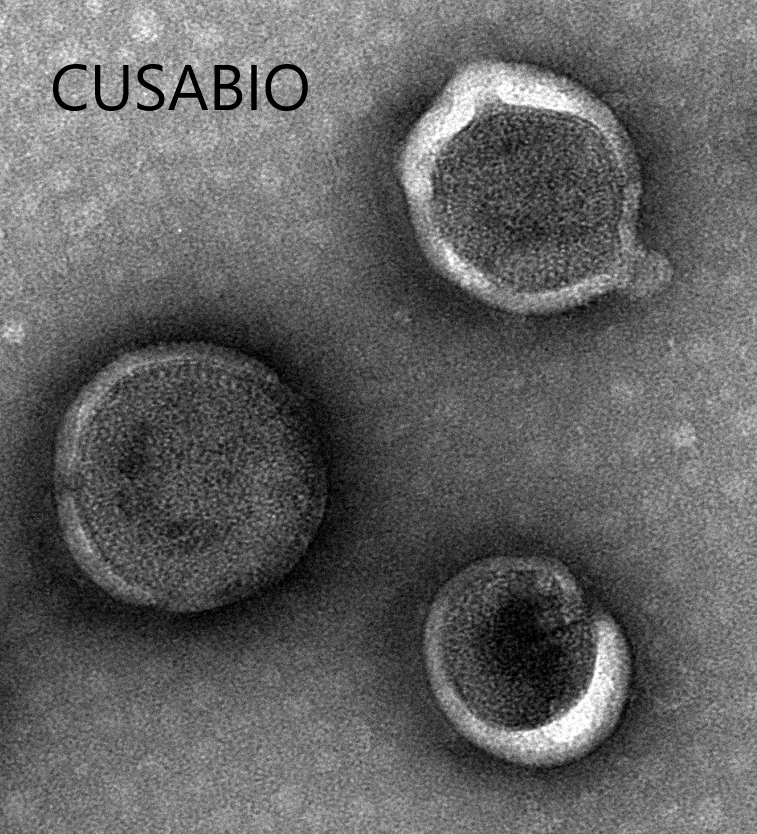
The presence of VLP-like structures was confirmed by TEM
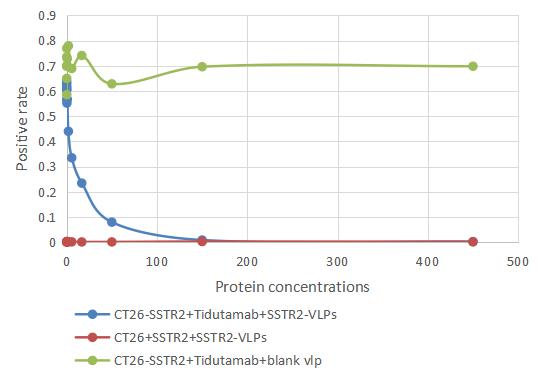
Blocking experiment on Anti-SSTR2 antibody (CSB-RA022725MA01HU) between Human SSTR2-VLPs protein and CT26/Human SSTR2 Stable Cells (CSB-SC022725HU) by Flow cytometry.
参考文献:
[1] Kumar, Ujendra, and Michael Grant. "Somatostatin and somatostatin receptors." Cellular peptide hormone synthesis and secretory pathways (2009): 97-120.
[2] Kumar, Ujendra, et al. "Subtype-selective expression of the five somatostatin receptors (hSSTR1-5) in human pancreatic islet cells: a quantitative double-label immunohistochemical analysis." diabetes 48.1 (1999): 77-85.
[3] Guillermet-Guibert, J., et al. "Physiology of somatostatin receptors." J Endocrinol Invest 28.11 (2005): 5-9.
[4] Gueorguiev, Maria, and Ashley B. Grossman. "A new therapeutic era for pituitary tumors." Nature Reviews Endocrinology 7.2 (2011): 71-73.
[5] Franko‐Tobin, Laura G., et al. "Notch1‐mediated tumor suppression in cervical cancer with the involvement of SST signaling and its application in enhanced SSTR‐targeted therapeutics." The Oncologist 17.2 (2012): 220-232.
[6] Elliott, David E., et al. "SSTR2A is the dominant somatostatin receptor subtype expressed by inflammatory cells, is widely expressed and directly regulates T cell IFN‐γ release." European journal of immunology 29.8 (1999): 2454-2463.
[7] Zhang Limeng., et al. "Physicochemical properties and bioinformatics analysis of Somatostatin Receptor 2." Guangxi Normal University Journal of Guangxi Normal University ( Natural Science Edition ): 2022.
[8] Ishida, Akiharu, et al. "Discovery and SAR Studies of Orally Active Somatostatin Receptor Subtype-2 (SSTR2) Agonists for the Treatment of Acromegaly." ACS chemical neuroscience 11.10 (2020): 1482- 1494.
[9] Piqueras, Laura, and Vicente Martínez. "Role of somatostatin receptors on gastric acid secretion in wild-type and somatostatin receptor type 2 knockout mice." Naunyn-Schmiedeberg's archives of pharmacology 370.6 (2004): 510-520.
[10] Si, Yingnan, et al. "Anti-SSTR2 antibody-drug conjugate for neuroendocrine tumor therapy." Cancer gene therapy 28.7 (2021): 799-812.
[11] Lehman, Jonathan M., et al. "Somatostatin receptor 2 signaling promotes growth and tumor survival in small‐cell lung cancer." International journal of cancer 144.5 (2019): 1104-1114.
[12] Cakir, Mehtap, Dorota Dworakowska, and Ashley Grossman. "Somatostatin receptor biology in neuroendocrine and pituitary tumours: part 1–molecular pathways." Journal of cellular and molecular medicine 14.11 (2010): 2570-2584.
[13] Ben-Shlomo, Anat, and Shlomo Melmed. "Pituitary somatostatin receptor signaling." Trends in Endocrinology & Metabolism 21.3 (2010): 123-133.
[14] Eychenne, Romain, et al. "Overview of radiolabeled somatostatin analogs for cancer imaging and therapy." Molecules 25.17 (2020): 4012.
[15] Gustafsson, Bjorn I., et al. "Bronchopulmonary neuroendocrine tumors." Cancer 113.1 (2008): 5-21.
[16] Righi, Luisella, et al. "Somatostatin receptor tissue distribution in lung neuroendocrine tumours: a clinicopathologic and immunohistochemical study of 218 ‘clinically aggressive’cases." Annals of Oncology 21.3 (2010): 548-555.
[17] Cracolici, Vincent, et al. "SSTR2 expression in olfactory neuroblastoma: clinical and therapeutic implications." Head and neck pathology 15.4 (2021): 1185-1191.
[18] Vieria Neto, Leonardo, et al. "ZAC1 and SSTR2 are downregulated in non-functioning pituitary adenomas but not in somatotropinomas." PloS one 8.10 (2013): e77406.
[19] Kouch-el Filali, Mariam, et al. "Expression of the SST receptor 2 in uveal melanoma is not a prognostic marker." Graefe's Archive for Clinical and Experimental Ophthalmology 246.11 (2008): 1585-1592.
[20] Woelfl, S., et al. "Expression of somatostatin receptor subtype 2 and subtype 5 in thyroid malignancies." Nuklearmedizin-NuclearMedicine 53.05 (2014): 179-185.
[21] de Oliveira Silva, Camila Batista, et al. "Expression of somatostatin receptors (SSTR1-SSTR5) in meningiomas and its clinicopathological significance." International Journal of Clinical and Experimental Pathology 8.10 (2015): 13185.
[22] Kharmate, Geetanjali, et al. "Inhibition of tumor promoting signals by activation of SSTR2 and opioid receptors in human breast cancer cells." Cancer Cell International 13.1 (2013): 1-13.
[23] WANG, Xiao-you, Nan-zheng ZHANG, and Xing-song JIANG. "The expression of SSTR subtypes 2 and 5 and their clinical significance in human gastric cancers." Acta Academiae Medicinae Xuzhou (2007).
[24] Dimitrakopoulou-Strauss, Antonia, et al. "Quantitative assessment of SSTR2 expression in patients with non-small cell lung cancer using68Ga-DOTATOC PET and comparison with18F-FDG PET." European journal of nuclear medicine and molecular imaging 33.7 (2006): 823-830.
[25] Yu, Benxia, et al. "Clinical importance of somatostatin receptor 2 (SSTR2) and somatostatin receptor 5 (SSTR5) expression in thyrotropin-producing pituitary adenoma (TSHoma)." Medical Science Monitor: International Medical Journal of Experimental and Clinical Research 23 (2017): 1947.
[26] Kasuki, Leandro, et al. "Ki-67 is a predictor of acromegaly control with octreotide LAR independent of SSTR2 status and relates to cytokeratin pattern." Eur J Endocrinol 169.2 (2013): 217-223.
上一篇: GUCY2C:平衡性的“守护者”,带来结直肠癌免疫治疗新曙光
下一篇: 新冠未退,猴痘又起











