CLDN6:继CLDN 18.2之后,下一个癌症治疗的“新宠”!
日期:2022-06-29 15:39:12
今年2022-AACR会议上,众多潜在创新靶标重磅登场,CLDN6便是其中之一。国内外生物医药企业拜恩泰科,安进,天境生物等公司,均对其管线中CLDN6靶向药物的阶段性进展进行了披露。其中,德国拜恩泰科公司旗下的BNT-211(CLDN6 CAR-T)的临床数据表明,无论是单用还是与疫苗联用,均展现出良好的耐受性。国内天境生物的TJ-C64B,是一款双特异性抗体,靶向肿瘤CLDN6和T细胞共刺激分子TNFRSF9,会议展示了该药物的临床前研究数据,在肿瘤小鼠模型中,TJ-C64B具有强大的肿瘤抑制活性,能够在肿瘤微环境中特异性激活免疫,无明显肝毒性风险。CLDN6作为Claudins家族的一员,被认为是继CLDN 18.2之后,下一个癌症治疗的“新宠”。
1、Claudins家族的发现
Claudins(CLDNs)蛋白家族最早在1998年由Furuse Mikio等人从鸡肝中克隆得到并为之命名,是紧密连接(Tight junctions,TJs)的重要组成部分 [1-2]。紧密连接主要由occludin,CLDNs,紧密连接黏附分子构成。在哺乳动物中,迄今为止发现了27个Claudins成员,随着研究的深入,Claudins家族成员还将不断壮大 [3-4]。大量研究已证实,Claudins家族是TJs必不可少的骨架蛋白,在维持上皮和内皮细胞中的细胞极性、细胞间的粘附固定、细胞旁路的离子运输等方面发挥重要作用 [5-8]。
Claudins成员,广泛分布于不同的组织器官中,其表达具有多样化的特性。近年来的大量研究数据揭示,Claudins的异常表达与多种肿瘤相关,涌现出更多的Claudins家族潜力靶点,用于肿瘤临床诊断和治疗(图1) [9]。不仅在癌症中扮演重要角色,也同其它疾病息息相关。例如,CLDN1的异常表达可导致硬化性胆管炎和鱼鳞病 [10-11];CLDN3的增加与肺泡屏障功能降低有关 [12]。在癌症免疫治疗领域,Claudins家族成员CLDN18的异构体CLDN18.2,已成为药企必争靶点的高地(点击查看CLDN18.2相关文章)。如今,CLDN6作为Claudins家族“新宠”,肿瘤靶向药物的研发也是势如破竹,令人期待!

图1. Claudins靶向药物的临床应用 [9]
2、什么是CLDN6?
CLDN6作为27个CLDN家族成员之一,是组成细胞间紧密连接的重要分子。CLDN6位于染色体16p3.3,分子量大约20-40kDa。Claudins成员之间具有相似的结构,每个Claudin分子有4个跨膜结构域,2个细胞外环和2条胞内尾区。CLDN6拥有一个C端的PDZ结合位点,使得紧密连接蛋白能与细胞内某些蛋白发生相互作用关系,在细胞连接及上皮组织通透性等方面均可发挥重要作用(图2) [13]。对CLDN6蛋白质分子结构的研究是进一步了解CLDN6分子特性和功能的前提和基础,目前关于CLDN6的高级结构的研究尚处于初级阶段。然而值得关注的是,越来越多的研究表明,CLDN6异常表达可参与乳腺癌 [14],卵巢癌 [15],宫颈癌 [16],胃癌 [17],肺癌 [18]等多种恶性肿瘤发生及发展过程。
由于肿瘤细胞易于侵袭转移,细胞之间结构较正常细胞排列错乱,导致细胞信号因子或者药物在流动过程中阻力增加,难以突破细胞间的屏障到达肿瘤细胞内,抗肿瘤药物无法髙效发挥作用。因此,探索打开细胞紧密连接,为抗肿瘤药物以及正常信号通路的转导清除障碍,成为肿瘤治疗中的新思路。CLDN6作为细胞骨架的形成和细胞信号通路调节的重要分子,可影响细胞的生长进程,这为肿瘤的诊断和干预提供了新的方向。目前,多款针对CLDN6的药物已处于临床和临床前阶段,用于多种肿瘤的治疗。
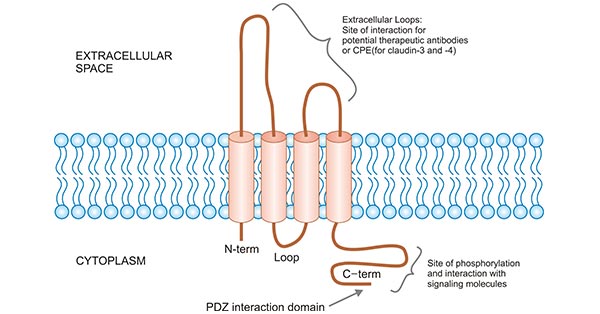
图2. CLDNs家族结构示意图 [13]
3、CLDN6相关的信号通路
目前的研究普遍认为,CLDN蛋白表达升高或降低,磷酸化及去磷酸化,都会导致一定程度的细胞极性缺失和细胞间分子异常扩散等变化,而此种变化的主要原因则是由于紧密连接正常结构的破坏而引发的。另外,CLDN蛋白可能是通过高度特异性的胞内信号通路所起作用的,但目前绝大多数CLDN蛋白在肿瘤中的作用机制尚不清楚。大量研究表明,CLDN6基因可能直接或间接参与肿瘤细胞增殖、分化、凋亡等功能的调节 [19]。
CLDN6可以通过不同的信号通路参与细胞调控,其复杂多样的分子机制有待进一步阐明。比如,在宫颈癌细胞中,CLDN6的PDZ结合基序可以募集具有PDZ结构域的蛋白AF-6,AF-6与Ras结合,抑制Ras和Raf的结合,使得Ras不能被Raf激活,从而抑制Ras的活性,进一步抑制下游靶分子如ERK和PI3K等信号通路,以调控细胞生物学行为 [13]。在乳腺癌中,过表达CLND6可以激活ASK1/P38通路,从而诱导细胞凋亡 (图3);在肺腺癌中,CLDN6过表达细胞,可促进P38 MAPK途径的活化 [14] ;在结直肠癌中,CLDN6通过与ZO-1结合,调控PTEN/AKT信号通路,抑制肿瘤 [20];在卵巢癌中,CLDN6通过ASK1参与细胞凋亡,进而介导MAPK信号通路发挥作用 [15]。
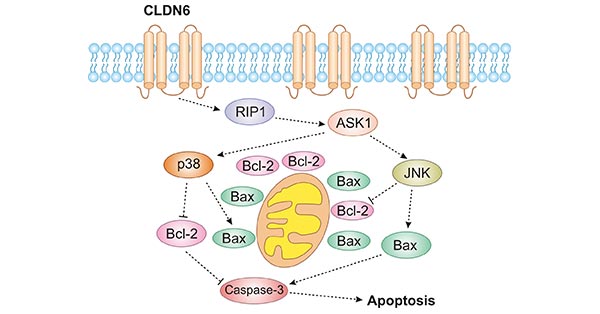
图3. CLDN6激活RIP1-ASK1-p38/JNK MAPK [19]
4、CLDN6在肿瘤等疾病中的作用
CLDN6等家族蛋白,在上皮细胞和内皮细胞紧密连接的形成过程中起了重要作用。CLDN家族通过细胞屏障、细胞旁路转运和信号转导保持了细胞内环境的平衡。CLDN6等家族蛋白的异常表达,可使得TJs功能受损,屏障功能降低,从而导致组织通透性提高,最终导致包括遗传性、过敏性疾病,各个系统感染性疾病乃至肿瘤等多种疾病的发生。目前,关于CLDN6的研究,主要集中在肿瘤,尤其是卵巢癌,乳腺癌,宫颈癌。
4.1 CLDN6和肿瘤
在一项产气荚膜梭菌肠毒素(CPE)结合CLDN6调控卵巢癌的研究数据显示,CLDN6在卵巢癌中高表达,CPE可加速卵巢癌细胞裂解;CLDN6编码基因的敲除,可降低CPE高敏感株对CPE的敏感度,使得CPE无法破坏肿瘤细胞,导致肿瘤增殖;而CLDN6过表达,可增加抗CPE细胞株对CPE的敏感度,促使肿瘤细胞裂解 [21]。在人乳腺癌细胞系中CLDN6低表达,当过表达CLDN6时,MDA-MB-231细胞的运动性显着降低,并显示出侵袭性降低,紧密连接功能随着菌落变得更紧密而增强;进一步数据显示,CLDN6的高表达,可导致Sp1和cyclin D1的表达下调 [22-23];另有研究表明,过表达CLDN6的宫颈癌细胞中,促凋亡蛋白Bax增多,抑凋亡蛋白Bcl-2、Bcl-xl减少,这提示,CLDN6具有促进宫颈癌细胞凋亡的作用 [13, 24]。因此,CLDN6有望为卵巢癌等肿瘤靶向治疗提供新方向。
4.2 CLDN6和多卵巢综合征等疾病
有研究证实,CLDN6在多囊卵巢综合征(Polycystic Ovary Syndrome,PCOS)和颗粒细胞(Granular Cells,GC)中呈高表达,减弱CLDN6表达,可抑制PCOS大鼠卵巢GC增殖并诱导GC凋亡 [25, 26]。PCOS以月经稀发、高雄激素血症、卵巢多囊样改变为主要特征,影响全球5%~20%的育龄妇女。患有PCOS的女性中,GC异常增殖,并与卵巢内雄激素的过量产生有关。另有研究报道,抑制CLDN6表达,可抑制子宫内膜异位症细胞增殖、迁移及侵袭。子宫内膜异位症是临床常见妇科疾病且育龄女性的发病率较高,患者常有月经量过多、痛经等症状。以上研究意味着,CLDN6可能作为治疗PCOS或子宫内膜异位症的潜在靶点。
5、CLDN6临床研究进展
来自ParmSnap数据库显示,已有10多家企业布局CLDN6研发管线,集中在CLDN6抗体、ADC、双特异性抗体、CART(参见下表)。具体来看,针对CLDN6药物进展较快的,来自日本安斯泰来制药(Astellas Pharma Global Development, Inc.)旗下的IMAB-027抗体药物,为靶向CLDN6的抑制剂,已处于临床二期,适应症包括生殖细胞和胚胎肿瘤、睾丸肿瘤、卵巢癌,但尚未查到该项目的2期临床数据。
安进公司的AMG 794双特异性抗体,靶向CD3 x CLDN6,处于临床1期,适应症为卵巢上皮癌、非小细胞肺癌,以及非鳞状非小细胞肺癌。在2022 AACR会议上,安进公司披露AMG 794对表达CLDN6的非小细胞肺癌和上皮性卵巢癌细胞,具有可接受的临床前安全性数据,支持AMG 794进入临床开发。
德国拜恩泰科公司旗下有三款管线药物在研BNT 211(临床2期)、BNT-142(临床1/2期)和CARVac Claudin6 mRNA vaccine(临床1期)。在AACR会议上,德国拜恩泰科披露了BNT211 CAR-T+CARVac联合治疗CLDN6阳性实体瘤的临床初步数据,在16名接受治疗患者中,CLDN6 CAR-T治疗具有良好的耐受性,疾病控制率达到86%,客观缓解率ORR为43%。
另外,4款双特异性抗体药物尚处于临床前阶段,分别来自Context Therapeutics LLC(CLDN6 x CD3),Novarock Biotherapeutics Ltd.(NBL-028;TNFRSF9 x CLDN6),天境生物(TJ-C64B;TNFRSF9 x CLDN6)、Integral Molecular, Inc.联合Context Therapeutics LLC(IM-171,CLDN6 x CD3)。其中Novarock为石药集团的附属公司,旗下的NBL-028的临床前数据表明,NBL-028在小鼠模型中能够有效抑制肿瘤并诱导免疫记忆的形成,且未检测到肝损伤或全身毒性的迹象。
随着越来越多的对紧密连接蛋白家族研究,CLDNs家族与肿瘤相关的分子机制和药物研究正成为热点和重点。继CLDN18.2之后,CLDN6同样作为紧密连接蛋白关键成员,CLDN6异常表达在卵巢癌等多种恶性肿瘤中扮演重要角色,尤其妇科肿瘤。利用CLDN6的空间结构和调节特点,寻找或设计针对CLDN6靶向药物,去主动调控CLDN6的信号转导,干扰肿瘤的进程,对于卵巢癌等肿瘤的早期诊断和精准治疗具有重要的价值!
| 药物 | 靶点 | 药物类型 | 在研适应症 | 在研机构 | 最高研发状态(全球) |
|---|---|---|---|---|---|
| IMAB-027 | CLDN6 | 抗体 | 生殖细胞和胚胎肿瘤; 睾丸肿瘤; 卵巢癌 | 安斯泰来制药株式会社(Astellas Pharma Global Development, Inc.) | 临床2期 |
| BNT 211 | CLDN6 | 基因疗法 CAR-T | 肺癌; 转移性非小细胞肺癌; 卵巢癌; 实体瘤; 胃癌; 睾丸肿瘤; 子宫癌 | 拜恩泰科 | 临床2期 |
| BNT-142 | CLDN6 x CLDN18 x CD3 | 生物药 | 实体瘤 | 拜恩泰科 | 临床1/2期 |
| AMG 794 | CD3 x CLDN6 | 双特异性抗体 | 非鳞状非小细胞肺癌; 卵巢上皮癌; 非小细胞肺癌 | 安进股份有限公司 | 临床1期 |
| CARVac Claudin6 mRNA vaccine(BioNTech) | CLDN6 | 治疗性疫苗 | RNA疫苗 | 实体瘤 | 拜恩泰科 | 临床1期 |
| DS-9606 | CLDN6 | ADC | 生殖细胞和胚胎肿瘤; 肿瘤转移; 卵巢癌; 肿瘤 | 第一三共株式会社 | 临床1期 |
| anti-claudin 6 antibody-drug conjugate(Ganymed Pharmaceuticals) | CLDN6 | ADC | 肿瘤 | 加尼梅德药物公司 | 临床前 |
| IMD-1618 | CLDN6 x CD3 | 生物药 | 实体瘤 | 上海亲合力生物医药科技股份有限公司 | 临床前 |
| CLDN6xCD3 Bispecific Antibody (Context Therapeutics LLC) | CD3 x CLDN6 | 双特异性抗体 | 卵巢癌; 实体瘤 | Context Therapeutics LLC | 临床前 |
| GB-7008-01-vcMMAE | CLDN6 | 生物药 | 卵巢癌 | 上海吉凯基因医学科技股份有限公司 | 临床前 |
| TJ-C64B | TNFRSF9 x CLDN6 | 双特异性抗体 | 肿瘤 | 天境生物 | 临床前 |
| NBL-028 | TNFRSF9 x CLDN6 | 双特异性抗体 | 实体瘤 | Novarock Biotherapeutics Ltd. | 临床前 |
| IM-171 | CD3 x CLDN6 | 双特异性抗体 | 子宫内膜样癌; 实体瘤; 卵巢癌 | Integral Molecular, Inc.; Context Therapeutics LLC | 临床前 |
表1. 靶点CLDN6的药物研发最新进展
为鼎力协助各药企针对CLDN6靶点在卵巢癌等肿瘤药物方面的研发工作,CUSABIO推出CLDN6四次跨膜蛋白活性产品(Code: CSB-MP005508HU(A4)),助力您在CLDN6机制方面的研究或其潜在临床价值的探索。
● Recombinant Human Claudin-6(CLDN6)-VLPs (Active)
-WB.jpg)
The specifity was validated by western blot. CSB-MP005508HU(A4) is detected by Mouse anti-6*His monoclonal antibody.
-AC1.jpg)
Immobilized Human CLDN6 at 10 μg/ml can bind Anti-CLDN6/9 recombinant antibody (CSB-RA005508MA1HU), the EC50 is 1.501-2.035 ng/mL
-TEM1.jpg)
The presence of VLP-like structures was confirmed by TEM
参考文献:
[1] Tsukita, Shoichiro, and Mikio Furuse. "Occludin and claudins in tight-junction strands: leading or supporting players?" Trends in cell biology 9.7 (1999): 268-273.
[2] Tsukita, Shoichiro, and Mikio Furuse. "Claudin-based barrier in simple and stratified cellular sheets." Current opinion in cell biology 14.5 (2002): 531-536.
[3] Sawada, Norimasa, et al. "Tight junctions and human diseases." Medical Electron Microscopy 36.3 (2003): 147-156.
[4] Tsukita, Sachiko, Hiroo Tanaka, and Atsushi Tamura. "The claudins: from tight junctions to biological systems." Trends in biochemical sciences 44.2 (2019): 141-152.
[5] Capaldo, Christopher T., and Asma Nusrat. "Claudin switching: physiological plasticity of the tight junction." Seminars in cell & developmental biology. Vol. 42. Academic Press, 2015.
[6] Heiskala, Marja, Per A. Peterson, and Young Yang. "The roles of claudin superfamily proteins in paracellular transport." Traffic 2.2 (2001): 92-98.
[7] Hashimoto, Yosuke, et al. "Potential for Tight Junction Protein–Directed Drug Development Using Claudin Binders and Angubindin-1." International journal of molecular sciences 20.16 (2019): 4016.
[8] Hashizume, Atsushi, et al. "Expression patterns of claudin family of tight junction membrane proteins in developing mouse submandibular gland." Developmental dynamics: an official publication of the American Association of Anatomists 231.2 (2004): 425-431.
[9] Li, Jian. "Targeting claudins in cancer: diagnosis, prognosis and therapy." American journal of cancer research 11.7 (2021): 3406.
[10] Grosse, Brigitte, et al. "Claudin‐1 involved in neonatal ichthyosis sclerosing cholangitis syndrome regulates hepatic paracellular permeability." Hepatology 55.4 (2012): 1249-1259.
[11] Grosse, Brigitte, et al. "Claudin‐1 involved in neonatal ichthyosis sclerosing cholangitis syndrome regulates hepatic paracellular permeability." Hepatology 55.4 (2012): 1249-1259.
[12] Mitchell, Leslie A., et al. "Differential effects of claudin-3 and claudin-4 on alveolar epithelial barrier function." American Journal of Physiology-Lung Cellular and Molecular Physiology 301.1 (2011): L40-L49.
[13] Du, Huan, et al. "Claudin 6: Therapeutic prospects for tumours, and mechanisms of expression and regulation." Molecular Medicine Reports 24.3 (2021): 1-9.
[14] Guo, Yaxiong, et al. "CLDN6-induced apoptosis via regulating ASK1-p38/JNK signaling in breast cancer MCF-7 cells." International Journal of Oncology 48.6 (2016): 2435-2444.
[15] Zhang, Xiaowei, et al. "Expression of apoptosis signal-regulating kinase 1 is associated with tight junction protein claudin-6 in cervical carcinoma." International journal of clinical and experimental pathology 8.5 (2015): 5535.
[16] Zhang, Xiaowei, et al. "Tight junction protein claudin-6 inhibits growth and induces the apoptosis of cervical carcinoma cells in vitro and in vivo." Medical oncology 32.5 (2015): 1-9.
[17] Kohmoto, Tomohiro, et al. "Claudin-6 is a single prognostic marker and functions as a tumor-promoting gene in a subgroup of intestinal type gastric cancer." Gastric Cancer 23.3 (2020): 403-417.
[18] Wang, Qiang, et al. "Low claudin-6 expression correlates with poor prognosis in patients with non-small cell lung cancer." OncoTargets and therapy 8 (2015): 1971.
[19] Sugimoto, Kotaro, and Hideki Chiba. "The claudin–transcription factor signaling pathway." Tissue Barriers 9.3 (2021): 1908109.
[20] Xu Wenhong. CLDN6 regulates the inhibitory effect of p53 on the proliferation of colorectal cancer cells through PTEN/Akt pathway. MS thesis. Jilin University, 2020.
[21] Lal-Nag, áM, et al. "Claudin-6: A novel receptor for CPE-mediated cytotoxicity in ovarian cancer." Oncogenesis 1.11 (2012): e33-e33.
[22] Ren, Yue, et al. "Gene silencing of claudin‑6 enhances cell proliferation and migration accompanied with increased MMP‑2 activity via p38 MAPK signaling pathway in human breast epithelium cell line HBL‑100." Molecular Medicine Reports 8.5 (2013): 1505-1510.
[23] Wagner, Meike. Molecular and functional characterization of the candidate tumor antigens placenta specific 1 and claudin 6. Diss. Universitätsbibliothek Mainz, 2016.
[24] Zhang X, Ruan Y, et al. Tight junction protein claudin-6 inhibits growth and induces the apoptosis of cervical carcinoma cells in vitro and in vivo. Med Oncol. 2015;32:148. doi: 10.1007/s12032-015-0600-4.
[25] Paz-Martínez, A. D. J., et al. "Progesterone Receptor Phosphorylation is Associated to Claudin 1and 6 Expression and Pregnancy Success in ART-Treated Women." Endocrinol Metab Int J 2.3 (2015): 00020.
[26] Sun Cai-Ping, Zhang Dan, et al. Effect of interfering with CLDN6 gene expression on apoptosis of ovarian granulosa cells in rats with polycystic ovary syndrome by regulating MAPK/ERK signaling pathway [J]. Advances in Modern Obstetrics and Gynecology 2022, Vol. 31, No. 2, pp. 96-101,106.
[27] Huang Shanying, Tang Guoling, et al. Effect of quercetin on proliferation, migration and invasion of endometriosis cells through regulation of CLDN6 gene expression and its mechanism[J]. Journal of Anhui Medical University, 2020, 55(10):7.











