表皮生长因子TMEFF2:肿瘤特异性或甲基化标志物,双功能靶点蕴藏新机会!
日期:2022-11-21 08:51:39
2022年欧洲肿瘤内科学会年会(ESMO)于9月9日-13日以线下结合线上的方式在法国巴黎举办。ESMO大会作为欧洲最负有盛名和最具影响力的肿瘤学会议,在这场学术盛会上,众多临床研究公布数据,不乏肿瘤领域新靶点。来自Janssen R&D的团队介绍了前列腺癌症中的新靶点--TMEFF2。Janssen的TMEFF2 x CD3双抗(JNJ-70218902)I期临床试验结果表明,剂量爬坡试验入组73例患者,2例未出现无剂量限制性毒性。有效性方面,8例患者前列腺特异性抗原PSA下降超过50%,5例患者疗效评价为部分缓解(Partial Response,PR)。团队表示将进一步探索第一部分的剂量递增研究,启动第二部分的剂量扩展研究以及初步疗效 [1]。
事实上,在胃癌、膀胱癌、前列腺癌等多种实体肿瘤中,TMEFF2高甲基化导致表观遗传沉默,在肿瘤研究中成为热点。目前,更多报道显示,TMEFF2既具有抑癌作用又具有促癌作用,其在前列腺癌中的作用最为复杂。因此,TMEFF2有望作为肿瘤特异性或甲基化标志物,为肿瘤药研发赋能!那么,TMEFF2如何发现?TMEFF2蕴藏着多少新机会?
1. 什么是TMEFF2?
TMEFF2(Transmembrane protein with EGF-like and two follistatin-like domains 2),也被称为HPP1,TPEF,TENB2,属于I型进化保守的跨膜蛋白。TMEFF2基因是由Uchida、Liang和Young等研究者于1999~2001年先后克隆发现 [2-3]。人TMEFF2基因定位于染色体2q32.1,包含9个内含子及10个外显子。TMEFF2由374个氨基酸组成,含胞外区、跨膜区和胞内区。胞外区包含1个类表皮生长因子(EGF)功能域和2个类似卵泡抑素(Follistatin,FS)功能域(图1) [2]。较短的胞内区含有潜在的G-蛋白活化序列 [2-3]。
TMEFF2作为具有表皮生长因子EGF样和FS样结构域蛋白,胞外区FS样功能域,可与转化生长因子-β家族(TGF-β超家族)、血管内皮生长因子(VEGF)以及血小板衍生生长因子(PDGF)等结合,并抑制其受体活化;胞外区EGF样结构,可参与细胞内的信号转导 [2]。目前TMEFF2表达异常已在多种肿瘤中得到证实,在前列腺癌以及子宫内膜癌中,TMEFF2表达上调,而在胃癌、结直肠癌、胰腺癌等恶性肿瘤中,TMEFF2基因启动子区的CpG岛常出现高甲基化,TMEFF2表达下调 [2-6]。因此,TMEFF2有望成为肿瘤特异性或甲基化生物标志物,其应用前景广阔!

图1. TMEFF2的结构 [2]
2. TMEFF2作为配受体的双功能
研究提示,TMEFF2蛋白中的EGF样功能域可能是人表皮生长因子受体ERBB1或ERBB4的配体,其与EGF神经调节蛋白家族的生长因子具有高度的同源性。在结直肠癌细胞中,过表达TMEFF2可导致ERBB4活化;在前列腺癌中,由于前列腺癌细胞株中ERBB4表达缺乏,因而有利于TMEFF2与ERBB1结合,促进细胞生长 [5, 7-8]。
此外,TMEFF2的FS样结构域具有结合和双向调节多种生长因子的活性。TMEFF2可作为血小板源性生长因子(PDGFA)的受体或共受体,在体外促进细胞外调节蛋白激酶(ERK1/2)磷酸化。在TMEFF2过表达细胞中pERK1/2的水平略上调,且在TMEFF2/PDGFRA共表达的细胞中,pERK1/2的水平进一步增加 [9]。已有研究证实,在神经胶质瘤中,TMEFF2通过其含有的FS样结构域选择性地与PDGFA相互作用,抑制其受体活化,从而调控血小板衍生生长因子信号通路 [10]。另有报道,TMEFF2的FS结构域在皮质激素细胞中可调节促肾上腺皮质激素释放激素(CRH),抑制环腺苷酸(cAMP),环磷腺苷效应元件结合蛋白(CREB),导致细胞增殖减少 [11]。目前虽然TMEFF2的生物学功能尚不完全清楚,但作为一种跨膜蛋白,TMEFF2可通过与多种蛋白结合在信号转导中发挥重要的生物学作用。
3. TMEFF2在癌症中的调控机制
TMEFF2的结构较为独特,不同形式的TMEFF2具有不同的生物学功能,其在肿瘤中的机制十分复杂。研究指出,在生长因子作用下全长TMEFF2,发挥抑癌作用;然而,TMEFF2可通过金属蛋白酶(如ADAM9、ADAM17、ADAM12)或跨膜丝氨酸蛋白酶Hepsin/TMPRSS1诱导,TMEFF2胞外域(TMEFF2-ECD)以其可溶形式脱落,脱落形式的可溶性TMEFF2-ECD则可发挥促癌作用 [12-13]。现有研究提示,TMEFF2蛋白可调控Ras/Raf/MAPK/ERK,PKB/Akt,JAK-STAT等信号通路,进而发挥抑癌或促癌作用,但其具体的调控机制有待进一步阐明。
例如,TMEFF2可与血小板衍生生长因子PDGFA特异性结合,抑制PDGFA刺激的成纤维细胞增殖,而PDGFA在少突胶质前体细胞(OPCs)的增殖、迁移和分化中起着重要作用 [2]。在过表达TMEFF2的结直肠癌细胞中,可溶性TMEFF2-ECD以ADAM17依赖的方式脱落,参与到JAK-STAT信号通路 [7]。同时,TMEFF2在结直肠癌中的抑癌作用需要TMEFF2-ECD的裂解和脱落。在前列腺癌中,TMEFF2可通过整合素信号通路调节αvβ3等整合素的表达及RhoA的活化,抑制前列腺癌细胞的迁移和黏附,而TMEFF2-ECD无此作用 [14]。由于整合素可诱导Akt和ERK磷酸化,TMEFF2也可能通过对整联蛋白表达的影响,建立负反馈回路,调节MAPK和PI3K通路。在胃癌中,TMEFF2可通过激活SHP-1抑制STAT3信号通路,抑制胃癌细胞的增殖(图2) [15, 28]。而TMEFF2-ECD可诱细胞中ERBB4的酪氨酸磷酸化,参与癌细胞增殖和凋亡的过程。因此,TMEFF2在癌症发病机制中发挥双重功能,TMEFF2通过介导和调控细胞内信号传导通路,在多种恶性肿瘤中影响细胞的增殖、分化、迁移和侵袭。
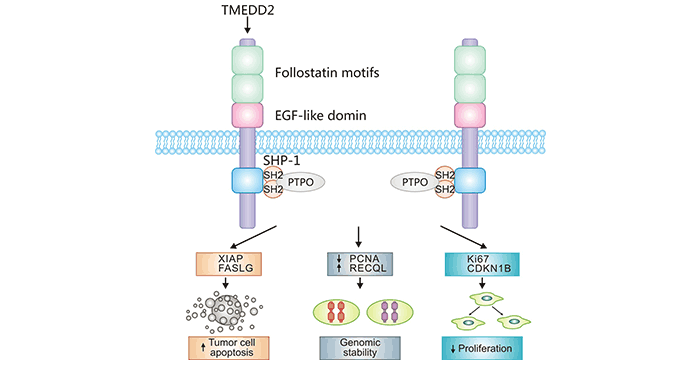
图2. TMEFF2在胃癌中的调控机制 [28]
4. TMEFF2在癌症治疗中的作用
TMEFF2涉及多种癌症和不同的功能,被发现以来,已经引起了各个领域的学者相当大的兴趣(图3)[2]。在人正常组织中,TMEFF2的表达有限,然而在肿瘤中,TMEFF2的表达不同程度地上调或下调,具有双重功能。已有报道显示,在结直肠癌、膀胱癌、胃癌中,TMEFF2抑制肿瘤细胞增殖、促进细胞凋亡,发挥抑癌作用,但另有报道揭示,TMEFF2可促进肿瘤细胞生长,发挥促癌作用。尤其在前列腺癌中,TMEFF2发挥抑癌或促癌的作用均有研究报道,其潜在作用受到广泛关注。
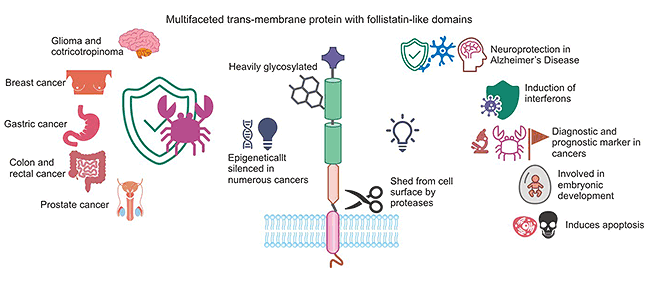
图3. TMEFF2在癌症治疗中的作用 [2]
4.1 TMEFF2与前列腺癌
前列腺癌是世界范围内老年男性最常见的恶性肿瘤之一。已有研究显示,TMEFF2可能成为前列腺癌诊断的分子标志物。与正常前列腺相比,前列腺癌组织,尤其是雄激素依赖的前列腺癌组织中,TMEFF2明显升高。TMEFF2的胞质结构域与肌氨酸脱氢酶(SARDH)相互作用,可下调肌氨酸的细胞水平。肌氨酸是前列腺癌进展中的一种潜在标志物,肌氨酸水平上调可增强肿瘤细胞迁移和侵袭的能力。TMEFF2在前列腺癌中的作用较为复杂,野生型全长结构的TMEFF2起着抑癌作用,而TMEFF2-ECD则促进癌细胞生长 ,[14, 16]。采用一种人源化的抗TMEFF2 ADC(huPr1-vcMMAE),在前列腺癌动物模型实验中发现,该药物可有效地到达肿瘤细胞,仅对表达TMEFF2的肿瘤细胞发挥细胞毒性作用 [17]。对前列腺癌患者,基于TMEFF2的抗体-药物偶联物(ADC)可能成为一种有前景的靶向疗法。
4.2 TMEFF2与胃癌
胃癌是起源于胃黏膜上皮的恶性肿瘤,在中国各种恶性肿瘤中发病率居首位。与正常胃黏膜上皮细胞相比,TMEFF2在胃癌细胞中的表达显著下调,体外过表达TMEFF2,可诱导肿瘤细胞凋亡,抑制胃癌细胞增殖。与TMEFF2高表达的胃癌患者相比,TMEFF2低表达患者的生存时间显著缩短,提示TMEFF2可作为评估胃癌患者预后的独立指标 [15, 18]。在幽门螺杆菌感染引起的胃癌中,磷酸化的STAT3直接与TMEFF2基因启动子结合,使胃癌细胞中的TMEFF2表达下调。敲低TMEFF2表达可促进胃癌细胞的增殖能力,而给予维生素C可观察到细胞的增殖能力受到抑制,以及TMEFF2表达显著上调,进一步证实TMEFF2可能是胃癌治疗的潜在靶点 [15, 18-19]。
4.3 TMEFF2与结直肠癌
结直肠癌是一种多见的癌症疾病,具有较为严重的危害性,使患者的肠道健康受损严重。TMEFF2在80%以上的结直肠癌中表达下调,被认为是一种结直肠癌抑制基因。研究表明,无论在体内还是体外,TMEFF2均显示出对结直肠癌的抑制活性。进一步发现,TMEFF2过表达,可诱导JAK1、JAK2与细胞表面受体结合而活化,活化的JAK再通过磷酸化作用诱导STAT1和STAT2活化,从而抑制肿瘤细胞的生长和增殖,促进肿瘤细胞凋亡 [2, 20]。TMEFF2高甲基化与结直肠癌早期病变密切相关,对患者血液样本的研究发现,TMEFF2基因甲基化水平越高,患者的预后越差 [22]。此外,在原发性和转移性结直肠癌中均可观察到TMEFF2基因高甲基化 [21]。因而TMEFF2有望成为结直肠癌患者早期诊断及甲基化生物标志物。
4.4 TMEFF2与其他肿瘤
目前的研究已证实,TMEFF2在胰腺癌、膀胱癌、非小细胞肺癌等多种肿瘤组织和细胞系中的表达均显著下调 [23, 24, 25, 26],TMEFF2在子宫内膜癌中的表达水平显著高于非典型内膜增生和正常子宫内膜,其在各类型肿瘤中发挥作用的机制也不同 [3]。例如,在胰腺癌细胞系中,过表达的TMEFF2可下调磷酸化STAT3、髓样细胞白血病因子1(Mcl1)、血管内皮生长因子的表达,进而抑制胰腺癌细胞增殖,并促进其凋亡 [26]。在子宫内膜癌细胞中,下调TMEFF2表达后,可抑制PI3K/Akt通路,上皮-间充质转化受到抑制,肿瘤细胞的增殖、迁移和侵袭能力均显著降低 [3]。在膀胱癌组织中,TMEFF2启动子明显甲基化,导致其基因表观遗传学沉默,从而影响膀胱癌细胞的增殖、凋亡、迁移和侵袭 [24]。在肾细胞癌中,TMEFF2甲基化与肿瘤的分期及预后呈负相关 [27]。
5. TMEFF2临床研究前景
基于ParmSnap数据库显示,针对TMEFF2蛋白的抗体药物研发,已有3款:ciduvectamig;AFC-08;anti-TenB2 antibody drug conjugates。Ciduvectamig和AFC-08均为单克隆抗体,其中AFC-08处于临床前,用于抑郁症。anti-TenB2 antibody drug conjugates,适应症为肿瘤,暂无临床信息披露。目前,关于TMEFF2的研究尚处于早期阶段,但TMEFF2作为肿瘤诊断及治疗标志物方面具有巨大潜力。TMEFF2的组织分布有望成为抗体偶联治疗前列腺癌的工具;其次,TMEFF2-ECD这一分泌型的出现提示调节TMEFF2的裂解可能会改变其功能。此外,在多种实体肿瘤中,TMEFF2基因常因高甲基化导致表观遗传沉默,在肿瘤发展中发挥重要作用。因此,TMEFF2具有成为多种肿瘤治疗及甲基化标志物的潜力。
为鼎力协助科研人员及药企针对TMEFF2靶点在前列腺癌等疾病药物方面的研发工作,CUSABIO推出TMEFF2活性蛋白产品(Code: CSB-MP883439HU),助力您在TMEFF2机制方面的研究或其潜在临床价值的探索。
Recombinant Human TMEFF2, partial (Active)

The purity was greater than 95% as determined by SDS-PAGE.
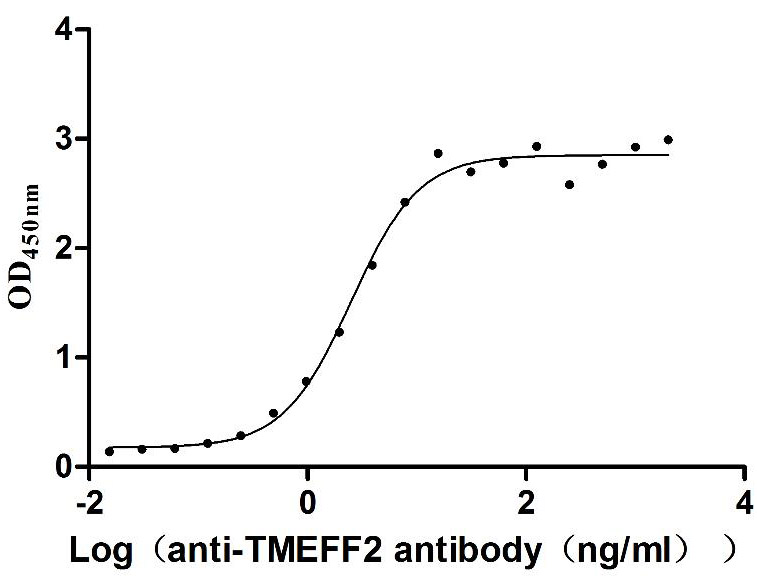
Immobilized Human TMEFF2 at 2 μg/mL can bind Anti-TMEFF2 recombinant antibody (CSB-RA883439MA1HU), the EC50 is 2.129-2.956 ng/mL.
参考文献:
[1] Basu, Subhasree, et al. "Abstract LB087: Characterization of JNJ-70218902, a TMEFF2 x CD3 bispecific antibody, in prostate cancer models." Cancer Research 82.12_Supplement (2022): LB087-LB087.
[2] Masood, Motasim, et al. "TMEFF2: A transmembrane proteoglycan with multifaceted actions in cancer and disease." Cancers 12.12 (2020): 3862.
[3] Gao, Lingling, et al. "TMEFF2 is a novel prognosis signature and target for endometrial carcinoma." life sciences 243 (2020): 116910.
[4] Koeffler, Phillip. Identification of Novel Secreted Molecules Prostate Cancer. CEDARS-SINAI MEDICAL CENTER LOS ANGELESCA, 2000.
[5] Georgescu, Constantin, et al. "A TMEFF2-regulated cell cycle derived gene signature is prognostic of recurrence risk in prostate cancer." BMC cancer 19.1 (2019): 1-13.
[6] Li, Haoshan, et al. "Roles of a TMPO-AS1/microRNA-200c/TMEFF2 ceRNA network in the malignant behaviors and 5-FU resistance of ovarian cancer cells." Experimental and Molecular Pathology 115 (2020): 104481.
[7] Elahi, Abul, et al. "HPP1 Ectodomain Shedding is Mediated by ADAM17 and is Necessary for Tumor Suppression in Colon Cancer." Journal of Surgical Research 254 (2020): 183-190.
[8] Mo, Ha Yoon, et al. "Frameshift mutation of candidate tumor suppressor genes QK1 and TMEFF2 in gastric and colorectal cancers." Cancer Biomarkers 24.1 ( 2019): 1-6.
[9] Huang, Hao, et al. "Tmeff2 is expressed in differentiating oligodendrocytes but dispensable for their differentiation in vivo." Scientific reports 7.1 (2017): 1-8.
[10] Lin, Kui, et al. "TMEFF2 is a PDGF-AA binding protein with methylation-associated gene silencing in multiple cancer types including glioma." PloS one 6.4 (2011): e18608.
[11] Labeur, M., et al. "TMEFF2: a new endogenous modulator of the CRH signaling in corticotroph cells. "Experimental and Clinical Endocrinology & Diabetes 118.08 (2010): P13.
[12] Gawel, Katarzyna. Characterization of TMEFF2; its role in tumour progression and development of targeting strategies for anti-cancer therapy. diss. Cardiff University, 2013.
[13] Gaweł-Bęben, Katarzyna, et al. "TMEFF2 shedding is regulated by oxidative stress and mediated by ADAMs and transmembrane serine proteases implicated in prostate cancer." Cell Biology International 42.3 (2018): 273-280.
[14] Chen, Xiaofei. Molecular mechanisms of TMEFF2 action in prostate cancer.
[15] Sun, Tian-Tian, et al. "Bidirectional regulation between TMEFF2 and STAT3 may contribute to H elicobacter pylori- associated gastric carcinogenesis." international journal of cancer 136.5 (2015): 1053-1064.
[16] Chen, Xiaofei, and Maria J. Ruiz-Echevarría. "TMEFF2 modulates the AKT and ERK signaling pathways. "International journal of biochemistry and molecular biology 4.2 (2013): 83.
[17] Afar, Daniel EH, et al. "Preclinical validation of anti-TMEFF2-auristatin E-conjugated antibodies in the treatment of prostate cancer. " Molecular cancer therapeutics 3.8 (2004): 921-932.
[18] Sun, Tiantian, et al. "TMEFF2 Deregulation Contributes to Gastric Carcinogenesis and Indicates Poor Survival OutcomeTMEFF2 and Tumorigenesis Signatures in Gastric Cancer." Clinical Cancer Research 20.17 (2014): 4689-4704.
[19] Han, Hongchao, et al. "Upregulation of TMEFF2 is involved in the antiproliferative effects of vitamin C and tyrphostin AG490 on GES-1 and AGS cells." Oncology letters 17.1 (2019): 652-659.
[20] Hernandez, Jonathan M., et al. "The tumor suppressive effects of HPP1 are mediated through JAK-STAT-interferon signaling pathways." DNA and Cell Biology 34.8 (2015): 541-549.
[21] Dobre, Maria, et al. "Crosstalk between DNA methylation and gene mutations in colorectal cancer." Frontiers in Oncology 11 (2021).
[22] He, Qiong, et al. "Development of a multiplex MethyLight assay for the detection of multigene methylation in human colorectal cancer." Cancer genetics and cytogenetics 202.1 (2010): 1-10.
[23] Han, Hongchao, et al. "TMEFF2 inhibits pancreatic cancer cells proliferation, migration, and invasion by suppressing phosphorylation of the MAPK signaling pathway." OncoTargets and therapy 12 (2019): 11371.
[24] Mankovska, O., et al. "Detection of methylation of VIM, TMEFF2 and GDF15 in the urine of patients with bladder cancer in Ukrainian population. "NaUKMA Research Papers. biology and Ecology (2016).
[25] Fan, Ji-min, et al. "MiR-323-3p targeting transmembrane protein with EGF-like and 2 follistatin domain (TMEFF2) inhibits human lung cancer A549 cell apoptosis by regulation of AKT and ERK signaling pathways." Medical science monitor: international medical journal of experimental and clinical research 26 (2020): e919454-1.
[26] Li, Kailiang, et al. "Expression of TMEFF2 in human pancreatic cancer tissue and the effects of TMEFF2 knockdown on cell, proliferation, and apoptosis in human pancreatic cell lines." Medical Science Monitor: International Medical Journal of Experimental and Clinical Research 25 (2019): 3238.
[27] Chen, Enjing, et al. "The effect of TMEFF2 methylation on the tumor stage and survival outcome of clear cell renal cell carcinoma." Cancer Biomarkers 19.2 (2017): 207-212.
[28] Sun, Tian-tian, et al. "TMEFF2 deregulation contributes to gastric carcinogenesis and indicates poor survival outcome." Clinical Gastroenterology and Hepatology 13.7 (2015): e79.
下一篇: 抗肿瘤治疗界后起之秀--CD93











