让人颤抖的疾病--帕金森病
日期:2023-01-05 10:37:25
帕金森病(Parkinson's disease,PD),又称帕金森综合征,是继阿尔茨海默病之后的又一复杂的神经退行性疾病(又称认知障碍)[1],主要影响大脑特定区域(黑质)的多巴胺产生神经元(多巴胺能)。该疾病可导致进行性运动障碍和非运动障碍,其临床症状表现为运动迟缓、静息时发抖或僵硬 [2]。
1. 帕金森病的类型
帕金森病是一种常见于60岁左右老年人的神经系统变性疾病。主要包括以下类型:
1.1 特发性帕金森病
特发性帕金森病是帕金森综合征中最常见的类型。特发性帕金森病没有明确的病因,其主要症状是震颤、僵硬和动作缓慢。
1.2 血管性帕金森病
血管性帕金森综合征(也称为动脉硬化性帕金森综合征)会影响大脑供血受限的人——通常是有糖尿病、高血压等健康问题的老年人。这种疾病的主要症状表现为行走困难、尿失禁和记忆障碍问题。
1.3 药物性帕金森病
药物性帕金森病是指少数(约7%)被诊断为帕金森病的患者在接受特定药物治疗后出现症状。
1.4 其他类型的帕金森病
● 多系统萎缩(multiple system atrophy,MSA)
多系统萎缩(MSA)是一种成年期发病、散发性的神经退行性疾病。其临床表现包括自主神经功能障碍、对左旋多巴类药物反应不良的帕金森综合征、小脑共济失调和锥体束体征等症状。
● 进行性核上性麻痹(progressive supranuclear palsy,PSP)
进行性核上性麻痹是以脑桥及中脑神经元变性及出现神经元纤维缠结为主要病理改变的进行性神经系统变性病。该病会影响眼球运动、肢体平衡、运动障碍、言语和吞咽问题等,因此它有时也被称为Steele-Richardson-Olszewski综合征。
● 常压性脑积水
常压性脑积水的临床症状主要累及下体,常见症状为步态不稳、尿失禁和记忆障碍。

图1. 易与帕金森病混淆的疾病
2. 帕金森病的现状、特点和案例
2.1 现状
全世界有1000多万人受帕金森病的困扰。流行病学资料显示,该病患病率为15 ~ 328/10万人口,其中大于 65岁的人群约占1%。在美国,其发病率为每10万人中有21例 [3]。随着全球预期寿命的延长,到2030年,受帕金森病影响的人数以及随之而来的个人、社会和经济负担预计将大幅增加 [4]。调查显示,2014-2021年中国65岁以上帕金森病患病人数由244.9万人增长至318.6万人。未来,我国帕金森病患病人数将保持稳定增长,预计到2023年中国帕金森病患病人数将达到345.9万人。
2.2 特点
● 年龄:帕金森病平均发病年龄为60岁,发病率随年龄增长而升高。一般来讲,在帕金森病患者中,仅有5%~10%的人年龄处于55岁以下。但近年来在临床治疗中发现,30~50岁的年轻帕金森病患者有了明显增多的趋势,这可能与环境污染问题日益严重有关,此外还有近年室内装修的污染问题可能也是原因之一。
● 性别:男性患帕金森病的可能性是女性的1.5倍。由于基因突变,父母或兄弟姐妹患有帕金森病的人患病的几率可能会增加一倍。
● 种族:患病率存在种族差异,白种人最高,其次是黄种人,黑人患病率最低。
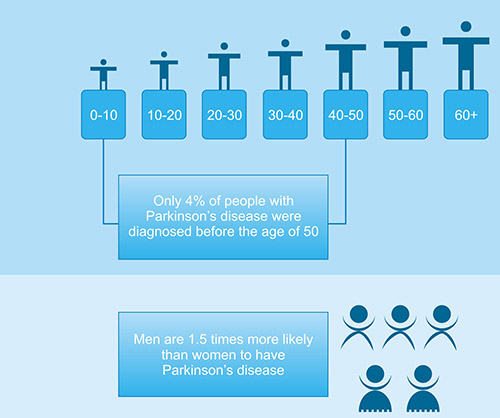
图2. 帕金森病相关数据
2.3 帕金森病案例
当名人披露自己的病情时,有助于提高人们对该疾病的关注,增加群众对疾病的认识和理解。
著名美国拳击运动员Muhammad Ali(1984年确诊)在退出拳击运动三年后被诊断出患有帕金森病。此后,他在亚利桑那州凤凰城成立默罕默德•阿里帕金森中心(Muhammad AliParkinson Center) 致力于推动治疗帕金森的治疗与科学研究,提高了全世界对帕金森病的认识。
曾五次获得艾美奖和四次获得金球奖的Michael J. fox(1991年确诊)是世界上最著名的帕金森病患者之一。在2000年由于疾病症状更为严重后从演艺舞台半退休,此后他便成为了积极推动帕金森氏症治疗研究的社会活动家,并创建了Michael J. fox基金会。2010年3月5日,瑞典卡罗琳斯卡学院授予他医学荣誉博士学位,以嘉奖他在帕金森氏症治疗方面所做的积极倡导和在筹措资金方面的贡献。
2008年,年仅37岁的前美国NBA篮球运动员Brian Grant被确诊为“最年轻的帕金森患者”,后建立了Brian Grant基金会来帮助其他患有帕金森病的人。
此外,George H. Bush、Billy Connolly、Alan Arda、Neil Diamond和Pat Torpey也被诊断为帕金森病。
3. 帕金森病的发病机制
目前关于帕金森病的发病机制有以下几种理论:
(1)线粒体功能障碍;
(2)氧化应激;
(3)蛋白质异常聚集;
(4)免疫炎症机制。
综上所述,上述发病机制中多因素协同作用,相互因果,恶性循环导致中脑的黑质多巴胺神经元选择性破坏,纹状体多巴胺合成与分泌减少,以及基底神经节环一系列改变,最终形成帕金森病的多种临床表现。
3.1 帕金森病的病因
尽管帕金森病的病因仍在研究中,尚未完全确定,但神经递质多巴胺的缺乏是主要原因。它还与遗传因素、环境因素以及患者本身等因素有关。
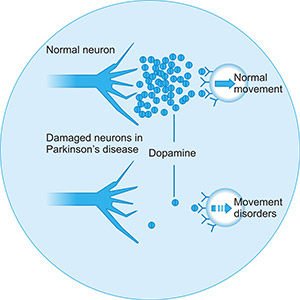
图3. 帕金森病的主要病因
● 遗传因素
常染色体显性帕金森病基因的致病性突变SNCA、LRRK2和VPS35约占帕金森病的0.1% ~ 30%,这取决于家族史、发病年龄和人口背景 [5] [6]。
编码葡糖脑苷脂酶基因的突变是本病最强的遗传危险因素 [7]。
控制线粒体DNA复制和修复的途径中罕见遗传变异的富集会影响PD的风险。导致家族性PD的基因中的大多数突变,包括SNCA [8]、LRRK2、PINK1、PRKN和VPS35,已被证明会破坏线粒体质量控制。斑马鱼仔鱼帕金森表型的诱导支持了线粒体超氧化物生成对PD发育的贡献 [9]。
● 环境因素
神经系统问题:核上性麻痹、威尔逊氏病、亨廷顿氏病、哈勒-瓦尔登-斯帕茨综合征和阿尔茨海默病也可引起PD。
脑损伤:外伤性脑损伤,可引起意识水平的改变,使受伤后数年内发生PD的风险增加 [10]。
居住地区:PD的地理分布有所不同,这可能是由于环境和遗传风险因素的差异。
职业:某些职业类别或职称与较高的PD发生率相关。工作压力会增加患PD的风险。
农药暴露:在所有与PD相关的化学品暴露中,农药(包括氯氰菊酯和六氯环己烷)的报告最为一致。
与金属的接触:各种金属的职业接触被认为与PD的发生有关。
● 患者本身
年龄:是帕金森病最大的危险因素。帕金森病主要累及老年人,尤其是55 ~ 65岁人群。
性别:男性比女性更容易患帕金森病。
4. 帕金森病的早期特征和临床表现
帕金森病有一个典型的进展阶段,通常分为5个阶段:早期、初次运动、二次运动、原发性和继发性非运动症状 [11]。
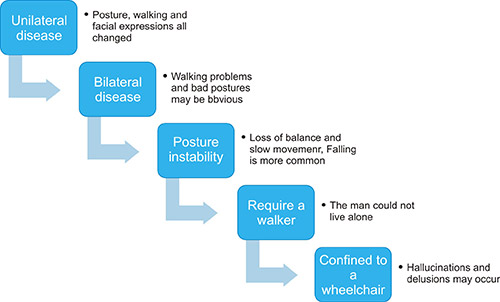
图4. 帕金森病的五个阶段
4.1帕金森病早期体征
(1)震颤:静止期震颤是帕金森病常见的早期症状
(2)笔迹很小
(3)嗅觉丧失
(4)睡眠问题
(5)行动或行走困难
(6)便秘
(7)声音柔和或低沉,研究表明高达89%的帕金森病患者会出现言语体征 [12]
(8)面具脸
(9)头晕或晕厥
(10)弯腰或驼背
4.2 临床表现
● 帕金森病运动症状
静息性震颤(手臂、下肢震颤)、运动迟缓、肌肉僵硬(面部僵硬或肢体僵硬)和体位性步态障碍。随着疾病的进展,可能会出现进一步的步态缺陷,如运动开始时的犹豫、转换和步态冻结。
● 帕金森病非运动症状
(1)认知障碍
(2)早期饱腹感
(3)直立性低血压
(4)疲劳 [13]
(5)幻觉 [14]和妄想
(6)情绪障碍(抑郁、焦虑、冷漠和易怒)
(7)泌尿问题(紧急、频繁、失禁)
(8)性问题,如勃起功能障碍
(9)睡眠障碍
(10)视力问题
帕金森病的发病率随着年龄的增长而增加,65岁以上的人中有1%受到该病困扰,80岁以上的人中则有3%受到其影响 [15]。早发性帕金森病(YOPD)发生于50岁以下人群。在极少数情况下,儿童和青少年可能出现帕金森样症状。确诊为YOPD的患者有更频繁的帕金森病家族史和更长的生存期。
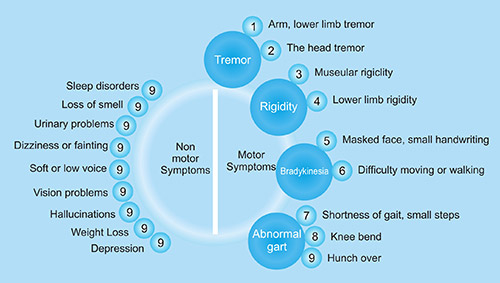
图4. 帕金森病的症状
5. 帕金森病的诊断和评估
首先,如果您担心自己可能患有帕金森病,应该立即去看帕金森病专家进行诊断。
5.1 如何诊断帕金森病?
这种疾病很难诊断,尤其是在其早期阶段,通常通过病史评估、神经系统检查,以及在某些情况下的脑部扫描或实验室检查来诊断。
● 调查症状
临床医生应对疑似帕金森病患者进行全面的神经系统检查。应特别重视对眼外肌运动、面部表情、体量、躯干及肢体运动速度、肌肉张力及步态的评估 [16]。
如果您出现以下三种症状中的至少两种,您可能被诊断为帕金森病。
(1)身体的某些部位通常只在休息时颤动
(2)慢速运动(慢速运动)
(3)肌肉僵硬(僵硬)
● 对帕金森病药物的反应
如果服用一种叫做左旋多巴的药物后您的症状有所改善,代表您很有可能已经患上帕金森病。
● 专家测试
(1)多巴胺转运体化学扫描,称为Dat Spect扫描。
(2)腰椎穿刺(脊髓液的手术转移)。
(3)MRI(磁共振成像)脑部扫描。
(4)尿道或肛门括约肌的电记录(EMG)。
(5)在某些情况下,也可以进行特殊的大脑扫描,如单光子发射计算机断层扫描(SPECT),以排除引起症状的其他原因。
此外,科学家们正在寻找识别帕金森病生物标志物的方法,这些生物标志物可以导致更早的诊断和更有针对性的治疗,以减缓疾病的进展。帕金森病中的视力异常具有作为生物标志物的潜在价值 [17]。
如果您是帕金森病患者或疑似帕金森病患者,您可以联系帕金森英国公司、帕金森支持和研究慈善机构。
帕金森病英国网站:https://www.parkinsons.org.uk/。
5.2 帕金森病评估工具
● Hoehn & Yahr分级量表:帕金森病的严重程度通常采用Hoehn & Yahr (H&Y)量表评估。临床医生用它来描述帕金森病运动症状的进展。症状分为1至5个级别。在该量表中,1和2代表早期,2和3代表中期,4和5代表晚期帕金森病。
● 统一帕金森病评定量表(UPDRS)是描述非运动症状的更全面工具,包括精神功能、情绪和社会互动、认知困难、日常活动和治疗并发症。
6. 帕金森病的治疗方法
目前,对于帕金森病的治疗方法可分为药物治疗、手术治疗和非药物治疗。
6.1 药物治疗
帕金森病药物列表:
(1)抗胆碱能药物:包括苯海索、丙环定、苯扎托品和比哌立登等。
(2)金刚烷胺:可促进多巴胺在神经末梢的合成和释放,阻止其重吸收。
(3)复方左旋多巴:包括左旋多巴、苄丝肼和左旋多巴、卡比多巴。
(4)DR激动剂:目前临床常用的是非麦角类DR激动剂。非麦角类DR激动剂有普拉克索、罗匹尼罗、吡贝地尔、罗替戈汀和阿朴吗啡。
(5)单胺氧化酶B(MAO - B)抑制剂:通过不可逆地抑制脑内MAO-B,阻断多巴胺的降解,相对增加多巴胺含量而达到治疗的目的。
(6)儿茶酚-氧位-甲基转移酶(COMT)抑制剂:包括恩他卡朋和托卡朋。
6.2 手术治疗
如脑深部刺激(Deep Brain Stimulati on, DBS)或组织切除。
6.3 非药物治疗
非药物治疗包括对疾病的认识和理解、营养补充剂、增强运动、增强对抗疾病的信心以及社会和家庭的理解、护理和支持。
6.3.1 帕金森病的自然治疗
健康均衡的饮食可以改善整体健康。包括著名倡导者Michael J. Fox在内的许多帕金森病患者表示,健康的饮食有助于缓解症状。
● 帕金森病饮食:生酮饮食甚至可能对糖尿病、癌症、癫痫、阿尔茨海默病有益 [18][19];绿茶可能对神经元有保护作用;喝咖啡的人患帕金森病的风险要低得多 [20]。
● 补充剂:某些补充剂可能有助于减轻帕金森症症状,包括:
(1)维生素C、E和D
(2)辅酶10
(3)Ω -3脂肪酸
(4)抗氧化补充剂
(5)香精油
(6)增加纤维摄入量以减少便秘。
● 降低毒性和化学品暴露:研究表明,农村生活、井水暴露、农药和除草剂暴露都与帕金森病相关,因此多吃或全吃有机食物非常有益且有保护作用。螯合还有助于减少重金属的积累和其他毒素的存在。
6.3.2 运动疗法
运动疗法有助于改善帕金森病的症状,甚至延缓疾病的进程 [21]。帕金森病患者常伴有步态冻结、姿势平衡障碍、语言和/或吞咽困难,可根据不同的运动障碍进行康复或运动训练。进行语言障碍训练、步态训练、体位平衡训练等。锻炼和物理治疗是步态和平衡症状的关键,而这些症状是药物治疗无法改善的。
6.3.3 心理咨询
帕金森病患者常伴有抑郁等心理障碍,是影响患者生活质量的主要危险因素之一。因此,对帕金森病患者进行有效的心理咨询和抗抑郁药物治疗,可以取得更满意的治疗效果。
此外,还有针对帕金森病的音乐疗法 [22]和语音疗法 [23]。
6.3.4 帕金森病治疗的未来方向
基因治疗可能成为一种有前途的帕金森病治疗策略。近年来,几种帕金森病的基因治疗方法已经进入临床试验。帕金森病的一些基因治疗方法包括:
(1)AADC-TH-GCH基因疗法
(2)病毒载体介导的基因传递
(3)RNA干扰疗法
(4)CRISPRS-CAS9基因编辑系统
7. 帕金森病治疗药物的前景
20世纪下半叶,伴随对帕金森病病理机制的深入理解,多款治疗药物相继问世,特别是基于多巴胺能系统的新药研发。然而,针对帕金森病的新药研发始终是一块难啃的“硬骨头”。直到今日,左旋多巴仍是抗帕金森病领域的核心药物。随着医学技术的发展速度愈来愈快,“老药”的治疗效果逐渐满足不了患者的治疗诉求,行业迫切需要兼顾安全、疗效和长期用药需求的“新鲜血液”。
依据pharmsnap数据库整理了帕金森药物全球研发进展,我们发现已经有45种药品批准上市,而全球在研有积极进展的药品数量竟达到了380余种!足足是上市药品的8倍多!有167种药物正在临床前阶段扎堆,足以看出全球医药企业对该治疗领域的重视程度。
整理发现,除了多巴胺受体相关靶点外,目前全球以α-突触核蛋白(SNCA)为靶点开发的抗帕金森病药物已有17个进入临床试验阶段,15个药物处于临床前阶段;针对富亮氨酸重复激酶2(LRRK2)为靶点的药物有5个处于临床试验阶段;针对 腺苷A2a受体(ADORA2A)为靶点的药物已有6个进入临床阶段;此外,还有单胺氧化酶(MAOB)、N-甲基-D-天冬氨酸受体(NMDAR)等靶点也是研究火热。
随着基础医学研究的进步,全球医药从业者群策群力,在研药物针对的靶点和作用机制各有突破,“百家争鸣”的研发格局对帕金森病研发领域具有绝对的积极意义和推动作用。
参考文献:
[1] Mason Amanda R, Ziemann Adam, Finkbeiner Steven. Targeting the low-hanging fruit of neurodegeneration [J]. Neurology, 2014, 83:1470-3.
[2] Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson's disease [J]. Movement Disorders, 2015, 30(12):1591-1601.
[3] Savica R, Grossardt BR, Bower JH, et al. Incidence and pathology of synucleinopathies and tauopathies related to parkinsonism [J]. JAMA Neurol, 2013, 70:859-66.
[4] Dorsey ER, Constantinescu R, Thompson JP, et al. Projected number of people with Parkinson disease in the most populous nations, 2005 through 2030 [J]. Neurology, 2007; 68:384-6.
[5] Clark L N, Wang Y, Karlins E, et al. Frequency of LRRK2 mutations in early- and late-onset Parkinson disease [J]. Neurology, 2006, 67(10):1786-91.
[6] Trinh J, Farrer M. Advances in the genetics of Parkinson disease [J]. Nature Reviews Neurology, 2013, 9(8):445-454.
[7] Sidransky E, Nalls M A, Aasly J O, et al. Multi-center analysis of glucocerebrosidase mutations in Parkinson disease [J]. N Engl J Med, 2009, 361(17):1651-1661.
[8] Kamp F, Exner N, Lutz A K, et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1 [J]. Embo Journal, 2014, 29(20):3571-3589.
[9] Pinho B R, Reis S D, Guedesdias P, et al. Pharmacological modulation of HDAC1 and HDAC6 in vivo in a zebrafish model: therapeutic implications for Parkinson's disease [J]. Pharmacological Research, 2016, 103:328-339
[10] Gardner Raquel C, Byers Amy L, Barnes Deborah E, et al. Mild TBI and risk of Parkinson disease: A Chronic Effects of Neurotrauma Consortium Study [J] .Neurology, 2018, 90: e1771-e1779.
[11] Maiti Panchanan,Manna Jayeeta,Dunbar Gary L,Current understanding of the molecular mechanisms in Parkinson's disease: Targets for potential treatments.[J] .Transl Neurodegener, 2017, 6: 28.
[12] Schalling Ellika, Johansson Kerstin, Hartelius Lena. Speech and Communication Changes Reported by People with Parkinson's Disease [J]. Folia Phoniatr Logop, 2017, 69: 131-141.
[13] Siciliano Mattia, Trojano Luigi, Santangelo Gabriella. et al. Fatigue in Parkinson's disease: A systematic review and meta-analysis [J]. Mov. Disord, 2018, undefined: undefined.
[14] Swann Peter, O'Brien John T. Management of visual hallucinations in dementia and Parkinson's disease [J]. Int Psychogeriatr, 2018, undefined: 1-22.
[15] Pringsheim T, Jette N, Frolkis A, et al. The prevalence of Parkinson's disease: a systematic review and meta-analysis [J]. Movement Disorders Official Journal of the Movement Disorder Society, 2015, 29(13):1583-1590.
[16] Suchowersky O, Reich S, Perlmutter J, et al. Practice Parameter: diagnosis and prognosis of new onset Parkinson disease (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology [J]. Neurology, 2006, 66: 968-75.
[17] Guo Li, Normando Eduardo M, Shah Parth Arvind, et al. Oculo-visual abnormalities in Parkinson's disease: Possible value as biomarkers [J]. Mov. Disord, 2018, 33: 1390-1406.
[18] Zhou Weihua, Mukherjee Purna, Kiebish Michael A, et al. The calorically restricted ketogenic diet, an effective alternative therapy for malignant brain cancer [J]. Nutr Metab (Lond), 2007, 4: 5.
[19] Gasior M, Rogawski M A, Hartman A L. Neuroprotective and disease-modifying effects of the ketogenic diet [J]. Behavioural Pharmacology, 2006, 17(5-6):431.
[20] Costa J, Lunet N, Santos C, et al. Caffeine exposure and the risk of Parkinson's disease: a systematic review and meta-analysis of observational studies [J]. Journal of Alzheimers Disease, 2010, 20 Suppl 1(1):S221.
[21] Bloem Bastiaan R, de Vries Nienke M, Ebersbach Georg. Nonpharmacological treatments for patients with Parkinson's disease [J]. Mov Disord, 2015, 30: 1504-20.
[22] Sihvonen A J, Särkämö T, Leo V, et al. Music-based interventions in neurological rehabilitation [J]. Lancet Neurology, 2017, 16(8):648.
[23] Ramig Lorraine, Halpern Angela, Spielman Jennifer, et al. Speech treatment in Parkinson's disease: Randomized controlled trial (RCT) [J]. Mov Disord, 2018, undefined: undefined.











