Treg细胞的鉴别
日期:2023-11-20 08:33:55
免疫系统能够准确识别“自身”和“非自身”,使身体产生保护性免疫反应,并实现对肿瘤的监测。
调节性T细胞(Treg细胞)是免疫系统中的基础细胞,由Sakaguchi等人于1995年发现 [1]。
Treg细胞的特点是表达Foxp3、CD25和CD4。它属于一类CD4+ T细胞亚群,具有较低的增殖能力。在免疫稳态和免疫耐受的诱导中发挥着重要作用。
1. 调节性T细胞的分类
根据其来源,调节性T细胞可以进一步分为自然调节性T细胞(nTreg)和适应性或诱导性调节性T细胞(aTreg或iTreg)。
nTreg主要是CD4+Treg细胞,它们在胸腺中由骨髓前体细胞分化而来,占CD4+T淋巴细胞总数的约1% - 3%,外周血中占CD4+T淋巴细胞总数的5% [2]。它在外周血、淋巴器官、炎症部位和肿瘤组织中发挥免疫调节作用 [3]。
aTreg或iTreg包括:Th3(表型特征为CD4+CD25low)、Tr1(表型特征为CD4+CD25lowCD45RBlow)、CD8+调节性T细胞、自然杀伤T细胞(NKT细胞)等亚型。它们与自身免疫性疾病和肿瘤的发生密切相关。
iTreg也被称为sTreg,是一类由外周成熟T细胞受特定抗原刺激并受免疫抑制性细胞因子(主要包括TGF-β、IL-2、IL-10、IFN-γ、IFN-α、吲哚胺2-3二氧化酶和维甲酸)诱导的调节性T细胞,占CD4+T细胞总数的约4% - 7%。
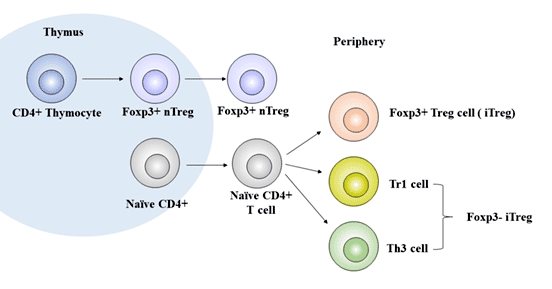
图1. Treg细胞的发育
2. Treg细胞分化
Treg细胞的分化、发育和功能受多种细胞因子的调控。转录因子Forkbox P3(Foxp3)参与了分化过程。转录激活因子STAT5是Treg细胞分化和存活的另一个重要因素。
在胸腺中,nTreg的发育依赖于TCR和CD28的协同刺激,这对于外周nTreg的稳定增殖和存活至关重要。
iTreg的发育需要IL-2和转化生长因子(TGF-β),而不是与CD28的共刺激 [4]。
研究表明 [5],IL-2通过STAT5促进诱导性调节性T细胞的产生,IL-2与TGF-β一起诱导原始CD4+ CD25-T细胞转化为CD4+ CD25+ T细胞,并表达Foxp3。
3. Treg细胞标记物
目前认为,CD4+CD25+ Foxp3+是Treg细胞的主要表型。
Treg还低表达了另一个特异性标记物,CD127。
一些受体也表达在Treg的表面,如CD5、CD38、CD45、CD62L、CD103、CTLA-4和抑制性免疫受体GITR。
Treg细胞表达的标记物可以根据它们的位置分为两类:
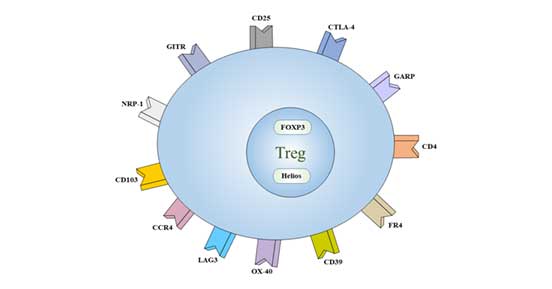
图2. Treg的细胞标记
3.1 胞内标记物
FOXP3:Fontenot JD等人在1995年发现Treg细胞高度表达forkhead盒P3(Foxp3),它可以促进未成熟CD4+T细胞转化为Treg [7]。
FOXP3是forkhead样转录因子家族的成员,与细胞生长和发育调控有关。FOXP3与Treg细胞密切相关。如果FOXP3基因发生突变,将影响Treg细胞的发育和成熟,并引发一些疾病。
FOXP3主要在淋巴器官和组织如胸腺、脾脏和淋巴结中表达。目前,Foxp3被认为是Treg细胞最敏感的标记物。
Helios:该基因编码了伊卡洛斯家族的锌指蛋白成员,是参与淋巴细胞发育调控的造血专一性转录因子。该蛋白与伊卡洛斯家族的其他成员形成同源或异源二聚体,被认为在早期造血发育中起着重要作用。
3.2 Treg细胞表面标记物
CD4:CD4,也称为T4/leu-3,是免疫球蛋白超家族的成员。它是一种分子量为55kDa的单链I型跨膜糖蛋白。
CD4 β是TCR/CD3复合物的一部分,参与TCR信号转导。
它在大多数胸腺细胞、辅助T细胞、II型NKT细胞和单核/巨噬细胞中表达。
CD25:CD25也称为IL-2Rα、Ly-43、P55或Tac,是一种分子量为55kDa的糖蛋白。它在激活的T和B细胞、胸腺细胞亚群、前B细胞和Treg细胞中表达。
CD39:CD39(核苷酸三磷酸二磷酸水解酶-1,NTPDase 1)是一种能够将ATP降解为AMP的细胞外酶。它在B细胞、树突细胞和包括调节性T细胞和记忆T细胞在内的T细胞亚群中表达。CD39是免疫系统的一个重要成员,参与抑制炎症和控制血小板活化。
CD62L:CD62L,也称为L选择素或LECAM-1,是一种分子量为74 - 95 kDa的单链I型糖蛋白。它在大多数外周血B细胞、T细胞、NK细胞亚群、单核细胞、粒细胞和一些造血系统恶性细胞上表达。CD62L对于不成熟淋巴细胞定位到外周淋巴结和Peyer's斑高内皮静脉非常重要。
CD73:CD73是一种通过GPI锚定到细胞的细胞表面蛋白,分子量为69kDa。在小鼠中,骨髓中的CD73表达仅限于CD11b+髓系细胞。在脾脏中,它主要在T细胞上表达。
CD103:CD103,也称为α E整合素或整合素α IEL链,属于整合素家族,是一种I型跨膜糖蛋白。Treg细胞高度表达CD103。CD103与E-钙黏蛋白结合,介导淋巴细胞定位到肠上皮细胞。
CD134:CD134是TNF受体家族的一员,也称为OX40和TNFRSF4,是一种分子量为50kDa的I型跨膜糖蛋白。OX40在激活的T淋巴细胞上表达。OX40与OX40L之间的相互作用导致B细胞增殖和抗体分泌,并调节原发性T细胞
增殖和T细胞存活。OX40影响CD4+T细胞的耐受调节。
CD152(CTLA-4):CD152是免疫球蛋白超家族的成员,也称为CTLA-4或Ly-56,分子量为33kDa。它在激活的T和B淋巴细胞上表达。
CTLA-4负调节细胞介导的免疫应答,在诱导和维持免疫耐受、发展保护性免疫和调节胸腺细胞方面发挥作用。
CD194(CCR4):CCR4配体包括:CCL17(TARG)和CCL22(MDC)。CCR4在记忆T细胞、巨噬细胞、血小板、嗜碱性粒细胞、Th2细胞和Treg细胞中表达。
CCR4及其配体(CCL17和CCL22)在多种皮肤免疫疾病的记忆T细胞招募中发挥重要作用。
FR4:叶酸受体4(FR4)是叶酸(维生素B9)的表面受体。它在小鼠CD4+ CD25+自然调节性T细胞(Treg)上具有高度的构成性表达。它结合CD4和CD25,并区分Treg与其他类型的T细胞。
GARP:GARP,也称为富含亮氨酸重复序列32(LRC32),是一种分子量为80kDa的I型跨膜糖蛋白。GARP存在于巨核细胞、血小板和激活的Treg(CD4+、CD25+、FoxP3+细胞)的表面,是转化生长因子-β(TGF-β)的受体。GARP可能在控制Treg的抑制功能方面发挥作用。
GITR:GITR(糖皮质激素诱导的TNFR相关基因),也称为TNFRSF18和AITR,是TNF受体超家族的成员。它在CD25+ CD4+ Treg中高度表达。GITR与其配体之间的相互作用可以增强T细胞的激活、增殖和细胞因子产生,并消除CD25+ CD4+ Treg的抑制功能。在体内激活GITR会导致自身免疫疾病的发展和被抑制的免疫反应的恢复。
TGF-β:TGF-β是促进成骨细胞形成的强效刺激剂,对骨重塑起重要作用。
它可以调节Th17细胞或Treg细胞的分化。高浓度有利于Treg细胞的发育。低浓度TGF-β与IL-6和IL-21的协同作用有利于Th17细胞的分化。它还控制许多细胞类型的细胞增殖、分化等功能。
CD127:CD127,也称为IL-7Rα,是一种分子量为60 kDa的I型跨膜糖蛋白。在Treg细胞中,CD127的表达被下调,缺乏CD127是Treg细胞的特征之一。它可以用作Treg和常规T细胞分化的标记物。
4. Treg细胞的功能是什么?
Treg的一般生理功能主要包括以下几个方面:
调节性T细胞和免疫耐受:通过抑制自反应T细胞,Treg使机体对自身抗原产生主动耐受,防止自身免疫疾病的发生。在肿瘤中,Treg通过免疫抑制使机体产生抗原耐受,使肿瘤细胞逃脱机体的免疫杀伤。
促进慢性炎症反应:当病原体入侵时,效应T细胞通过一系列免疫反应清除病原体,而Treg在体内与其他免疫细胞发挥相反的作用 [8]。它通过分泌细胞因子如IL-4、IL-10和TGF-β发挥抑制功能。它可以防止引起组织破坏的病理性免疫反应的发生,但同时也使得难以清除病原体,延长慢性感染的病程。
免疫抑制:Treg的主要功能是负调节机体的免疫反应,因此在调节免疫稳态、预防自身免疫疾病的发生方面,Treg起着至关重要的作用。通过免疫抑制,Treg促进肿瘤免疫逃避 [9],因此它也被视为一种帮助肿瘤存活并促进其生长的免疫细胞。
Treg细胞调节免疫功能并参与人体的老化过程。老年小鼠的免疫功能下降。
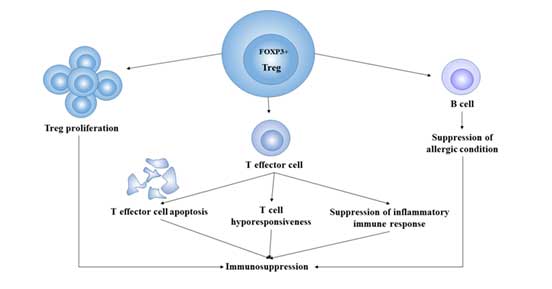
图3. Treg细胞的免疫抑制
5. Treg细胞是如何工作的?
Teg通过两种方式发挥其免疫调节功能:5.1细胞与细胞的直接接触一些趋化因子使Treg聚集在免疫细胞周围,通过细胞与细胞接触依赖的机制发挥作用。Treg可通过CTLA-4、TGF-β和GITR直接与靶细胞上相应受体结合,抑制CD4+T、CD8+T、树突状细胞和抗原提呈细胞 [10]等免疫细胞的增殖。Treg通过调节树突状细胞的数量和活性,使其抗原呈递失效,从而抑制免疫应答。5.2抑制性细胞因子的分泌Treg通过分泌IL-4、IL-10、IL-35和TGF- β [11][12]等抑制性细胞因子负性调节免疫。
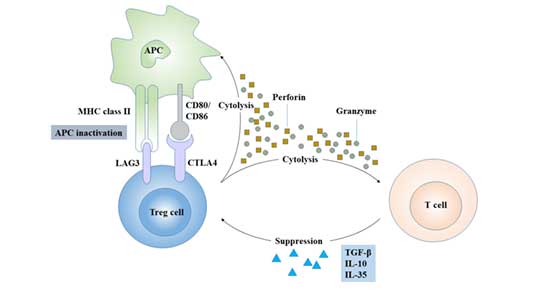
图4. Treg细胞的调控机制
6. 肿瘤中的调节性T细胞
肿瘤微环境在肿瘤的发生和发展中起着非常重要的作用。免疫细胞可以通过影响肿瘤微环境来影响肿瘤的进展。
一般来说,大多数免疫细胞都可以发挥抗肿瘤免疫的作用,如辅助T细胞和细胞毒性T细胞。然而,在肿瘤微环境中,Treg细胞则扮演着相反的角色。Treg的免疫抑制作用不仅可以防止自身免疫疾病的发生,还可以促进肿瘤细胞的免疫逃逸,间接加速肿瘤细胞的增殖,并增强肿瘤细胞的浸润能力。
Treg细胞可以抑制效应细胞的发育和激活,在介导肿瘤免疫耐受中起着重要作用。研究表明,Treg细胞的数量与肿瘤的预后呈负相关 [13]。
Treg细胞引起的肿瘤免疫耐受是通过控制原始T细胞和记忆T细胞来实现的。
Treg细胞还可以通过TGF-β诱导宿主免疫耐受来影响CD4+(Th1、Th2、Th17、NK)等其他免疫细胞。
Treg细胞引发的免疫耐受也与树突状细胞(DC)的作用有关 [14]。
7. Treg细胞与免疫疗法
Treg细胞在免疫体系中发挥免疫抑制作用,在骨髓移植治疗中具有一定优势。
在多发性骨髓瘤患者中,低淋巴状态可以提高骨髓移植的成功率。
Treg细胞介导体内抗原的耐受。其数量的降低将减少机体对一些自身抗原的耐受,增加对移植物的排斥。因此,通过刺激人体内Treg细胞的恢复和再生,可以显著减轻患者对移植物的排斥反应,大大提高骨髓移植的成功率。
Treg细胞的免疫抑制作用与肿瘤抗原的免疫逃逸和耐受有关。因此,在肿瘤中,如何降低Treg的功能成为关键。
IL-2对于Treg细胞的发育是必不可少的 [15]。IL-21是一种与IL-2相似但没有免疫调节功能的细胞因子。用IL-21代替IL-2可以防止Treg细胞发展为sTreg细胞。此外,抗CD25+单克隆抗体和抗CD4+单克隆抗体的联合应用可以在体内阻断Treg细胞,最大程度地消除Treg细胞的效应。小鼠实验表明,越彻底地去除Treg细胞,肿瘤免疫疗法的效果就越好,小鼠的生存时间就越长 [16]。
肿瘤免疫疗法的另一个思路是逆转Treg细胞对肿瘤细胞引起的免疫耐受。
Kiniwa等人 [17] 发现TLR8配体(人类Toll样受体8配体)可以逆转Treg细胞对肿瘤的免疫耐受,消除肿瘤的免疫逃逸,提高效应细胞的效率。
其他的共刺激因子,如B7.1和B7.2,也可以逆转Treg细胞对肿瘤的免疫耐受,消除效应细胞的抑制作用,提高杀伤效果。研究发现,缺乏B7.1和B7.2的共刺激因子时,肿瘤细胞将逃避机体的免疫监视,使T细胞处于无效状态或诱导其凋亡,导致肿瘤无限生长。
参考文献:
[1] Sakaguchi S, Sakaguchi N, Asano M, et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases [J]. The Journal of Immunology, 1995, 155(3): 1151-1164.
[2] Gavin M A, Rasmussen J P, Fontenot J D, et al. Foxp3-dependent programme of regulatory T-cell differentiation [J]. Nature, 2007, 445(7129): 771.
[3] Feuerer M, Hill J A, Mathis D, et al. Foxp3+ regulatory T cells: differentiation, specification, subphenotypes [J]. Nature immunology, 2009, 10(7): 689.
[4] Cassis L, Aiello S, Noris M. Natural versus adaptive regulatory T cells [M]. Kidney Transplantation: Strategies to Prevent Organ Rejection. Karger Publishers, 2005, 146: 121-131.
[5] Zheng S G, Wang J, Wang P, et al. IL-2 is essential for TGF-β to convert naive CD4+ CD25− cells to CD25+ Foxp3+ regulatory T cells and for expansion of these cells [J]. The Journal of Immunology, 2007, 178(4): 2018-2027.
[6] Trzonkowski P, Szmit E, Myśliwska J, et al. CD4+ CD25+ T regulatory cells inhibit cytotoxic activity of T CD8+ and NK lymphocytes in the direct cell-to-cell interaction [J]. Clinical immunology, 2004, 112(3): 258-267.
[7] Li Z, Li D, Tsun A, et al. FOXP3+ regulatory T cells and their functional regulation [J]. Cellular & molecular immunology, 2015, 12(5): 558.
[8] Klabusay M. The role of regulatory T-cells in antitumor immune response [J]. Klinicka onkologie: casopis Ceske a Slovenske onkologicke spolecnosti, 2015, 28: 4S23-7.
[9] Halvorsen E C, Mahmoud S M, Bennewith K L. Emerging roles of regulatory T cells in tumour progression and metastasis [J]. Cancer and Metastasis Reviews, 2014, 33(4): 1025-1041.
[10] Schlößer H A, Theurich S, Shimabukuro-Vornhagen A, et al. Overcoming tumor-mediated immunosuppression [J]. Immunotherapy, 2014, 6(9): 973-988.
[11] Collison L W, Workman C J, Kuo T T, et al. The inhibitory cytokine IL-35 contributes to regulatory T-cell function [J]. Nature, 2007, 450(7169): 566.
[12] Sakaguchi S, Wing K, Onishi Y, et al. Regulatory T cells: how do they suppress immune responses? [J]. International immunology, 2009, 21(10): 1105-1111.
[13] Beyer M, Schultze J L. Regulatory T cells in cancer [J]. Blood, 2006, 108(3): 804-811.
[14] Banerjee D K, Dhodapkar M V, Matayeva E, et al. Expansion of FOXP3high regulatory T cells by human dendritic cells (DCs) in vitro and after injection of cytokine-matured DCs in myeloma patients [J]. Blood, 2006, 108(8): 2655-2661.
[15] Frumento G, Piazza T, Di Carlo E, et al. Targeting tumor-related immunosuppression for cancer immunotherapy [J]. Endocrine, Metabolic & Immune Disorders-Drug Targets (Formerly Current Drug Targets-Immune, Endocrine & Metabolic Disorders), 2006, 6(3): 223-237.
[16] El Andaloussi A, Han Y U, Lesniak M S. Prolongation of survival following depletion of CD4+ CD25+ regulatory T cells in mice with experimental brain tumors [J]. Journal of neurosurgery, 2006, 105(3): 430-437.
[17] Kiniwa Y, Miyahara Y, Wang H Y, et al. CD8+ Foxp3+ regulatory T cells mediate immunosuppression in prostate cancer [J]. Clinical Cancer Research, 2007, 13(23): 6947-6958.
上一篇: Th17细胞的分化
下一篇: 改良的红细胞可以防止有害的免疫反应











