同一个世界,同一个希望—我们能为艾滋病做些什么?
日期:2023-12-27 09:07:00
人类免疫缺陷病毒(HIV)是一种属于反转录病毒类别的慢病毒。HIV是一种攻击人体免疫系统的病毒。它以CD4 T淋巴细胞为主要攻击目标,而CD4 T淋巴细胞是人体免疫系统中最重要的细胞,它大量破坏这些细胞,使人体失去免疫功能。因此,人体容易受到各种疾病的感染,并可能发展恶性肿瘤。
1. 艾滋病的历史
1981年,首次在美国发现了人类免疫缺陷病毒。
自从发现HIV以来,人类免疫缺陷病毒的基因组和蛋白质一直是广泛研究的对象[1][2]。早在1985年,HIV基因组的序列就已经被报道[3][4][5]。
2. HIV的分类
获得性免疫缺陷综合症(AIDS)的国际疾病分类-10(ICD-10)编码为B24.x01。已经确定了两种类型的HIV:HIV-1和HIV-2。HIV-1和HIV-2之间存在差异,它们的核酸序列仅有40%的同源性。
● HIV-1:高毒性,高传染性,是全球大多数HIV感染的原因。HIV-1是病毒的最常见的致病株。
● HIV-2:低毒性,低传染性。HIV-2的传播能力相对较差,主要限于西非地区。
HIV-1起源于黑猩猩,而HIV-2起源于白领芒巴树叶猴[6]。
2.1 HIV-1的分类
它分为四个类型:M组、N组、O组和P组。
● M组
“M”代表“major”,是HIV最常见的类型,超过90%的HIV/AIDS病例源于感染HIV-1的M组。M组进一步细分为分支,称为亚型。详见表1。
表1. M组各亚型及主要分布
| 亚型 | 主要分布地区 |
|---|---|
| Subtype A | 非洲西部 |
| Subtype B | 欧洲、美洲、日本、澳大利亚、中东和北非 |
| Subtype C | 非洲南部、非洲东部、印度、尼泊尔和中国部分地区。 |
| Subtype D | 只在非洲东部和中部可见。 |
| Subtype E | 东南亚(以异性恋者为主) |
| Subtype F | 中非、南美和东欧。 |
| Subtype G | 非洲和中欧。 |
| Subtype H | 仅限于中非 |
| Subtype I | / |
| Subtype J | 北非、中非、西非和加勒比地区 |
| Subtype K | 仅限于刚果民主共和国和喀麦隆。 |
还有一种“循环重组形式”,CRFs源自不同亚型病毒之间的重组。例如,CRF12_BF是B亚型和F亚型之间的重组。
● N组
这是一种HIV-1变异体,于1998年从一名喀麦隆妇女身上分离出来,她死于艾滋病。
● O组
O(“外来者”)组在非洲中部以西地区以外的地区通常不常见。据报道,喀麦隆是这种亚型最常见的地方。
● P组
2009年,它从法国的一名喀麦隆妇女身上分离出来。报告该序列的科学家将其归入了提议的P组,“等待进一步的人类病例鉴定”。
3. HIV流行病
绝大多数HIV感染者生活在低收入和中等收入国家。非洲拥有全球最多的HIV/AIDS感染者,尤其是南部非洲地区。南亚和东南亚是继撒哈拉以南非洲之后受影响最严重的地区。HIV风险环境的发展[7]受到了各个背景中特定的社会结构、经济和政治因素的影响。
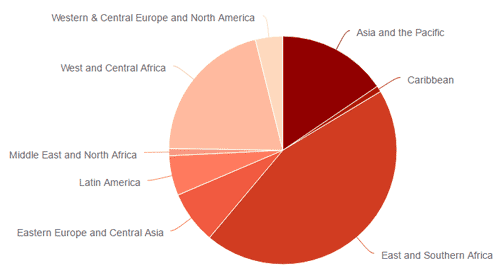
图2. 各地区艾滋病毒新感染病例(所有年龄)
HIV疫情:截至2016年底,全球约有3,670万人生活在HIV感染状态下,其中210万人是儿童(15岁以下)。2017年,东部和南部非洲有1960万人生活在HIV感染状态下,西部和中部非洲有610万人,亚洲和太平洋地区有520万人,西部和中部欧洲以及北美地区有220万人,拉丁美洲有180万人,东欧和中亚地区有140万人,中东和北非有220万人生活在HIV感染状态下。
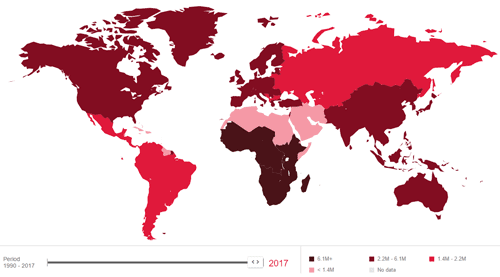
图3. 2010-2017年艾滋病毒感染新趋势
艾滋病方面的突破:自2010年以来,艾滋病相关死亡人数的百分比变化下降了34%,艾滋病毒新感染人数的百分比变化下降了18%。
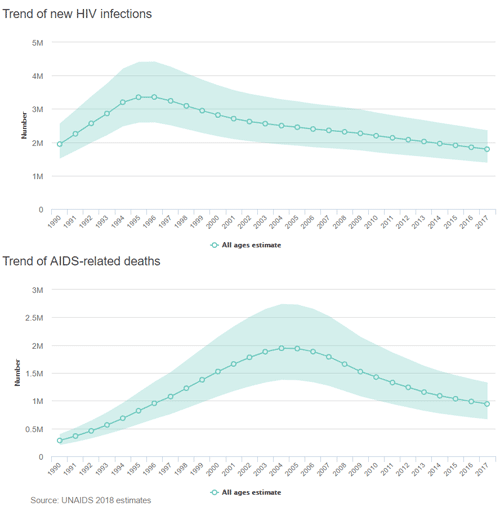
图4. 艾滋病毒新感染和艾滋病相关死亡趋势
更详细的数据可以在联合国艾滋病规划署网站上找到:http://aidsinfo.unaids.org./
目前,国际社会对艾滋病的响应是前所未有的,因为投入的资源超过了任何其他健康事业[8]。这被称为艾滋病的特殊性。
4. HIV结构和基因组
4.1 HIV的形态结构
人类免疫缺陷病毒直径约为120纳米,通常呈球形。它主要包括病毒包膜,以及蛋白质gp120和gp41(跨膜蛋白质)。向内是由蛋白质p17形成的球形基质,以及由蛋白质p24形成的半锥形壳体。壳体内含有病毒RNA基因组、酶(反转录酶、整合酶、蛋白酶)以及来自宿主细胞的其他成分(如tRNAlys3,作为反转录的引物)。
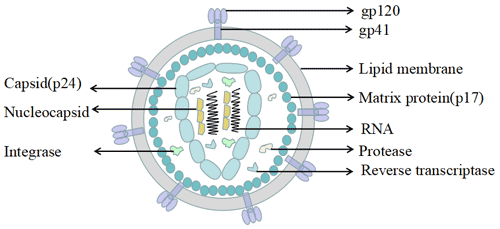
图5. HIV的结构
4.2 HIV基因组
病毒基因组由两个相同的正链RNA组成,每个约为9.2-9.8 kb。两端都是长末端重复序列(LTR),包含控制原病毒表达的顺式调控序列。已证明LTR具有启动子和增强子,并含有负调控区域。在LTR之间的序列编码至少九种蛋白质,可分为三类:结构蛋白、调节蛋白和辅助蛋白。
结构蛋白
- gag基因可以编码聚合前体蛋白,被蛋白酶水解成P17和P24核蛋白。
- Pol基因编码聚合酶前体蛋白,经蛋白酶裁剪形成蛋白酶、整合酶、反转录酶和核糖核酸酶,这些都是病毒增殖所必需的[9]。
- env基因编码前体蛋白,被糖基化成gp160、gp120和gp41。
调节蛋白
- TaT基因编码的蛋白质可以结合到LTR上,提高病毒的转录速率。
- Rev基因编码一个顺式激活因子,可以作用于env和gag中的顺式作用抑制序列(Crs),增强gag和env基因的表达。
辅助调节蛋白
- Nef基因编码蛋白质P27,对HIV基因的表达具有负调控作用。
- Vif基因可能影响游离HIV的感染性、病毒颗粒的产生以及体内传播。
- VPU基因仅存在于HIV-1中,对于HIV的高效复制以及病毒颗粒的组装和成熟是必不可少的。
- Vpr基因编码的蛋白质是一个弱转录激活因子,在体内的复制周期中发挥作用。
- 与HIV-1相比,HIV-2基因中不含VPU基因,但具有一个尚未解释的VPX基因。
5. 艾滋病的成因
5.1 感染源
HIV感染者是感染源。HIV已从血液、精液、阴道分泌物、乳汁等中分离出来。
HIV在体外存活能力极差,不耐高温。因此,握手、拥抱、亲吻、游泳、蚊虫叮咬、共用餐具、咳嗽或打喷嚏、日常接触等不会传播。
5.2 HIV传播
以下是三种主要的传播方式[10]:
● 性传播
HIV存在于感染者的精液和阴道分泌物中。性行为可以轻易引起皮肤粘膜的微小损伤,病毒可以通过受损区域进入血液。
● 血液传播
人体接触带有HIV的血液或血液制品,静脉注射药物,以及移植感染者的组织和器官都有患上艾滋病的风险。
● 母婴传播
感染HIV的妇女可以在怀孕和分娩期间将病毒传递给胎儿。感染的妇女还可以通过母乳喂养将病毒传递给婴儿。
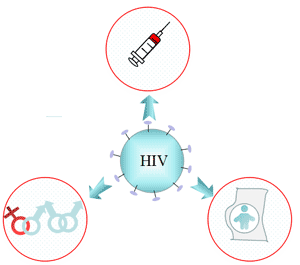
图6. 艾滋病传播情况
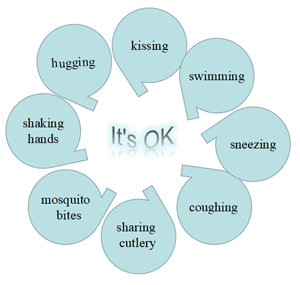
图7. 无艾滋病毒传播
5.3 病原机制
众所周知,艾滋病是由人类免疫缺陷病毒(HIV)引起的免疫缺陷性疾病。HIV选择性侵入CD4分子,主要是T4淋巴细胞、单核巨噬细胞、树突状细胞等。
病因过程
细胞表面的CD4分子是HIV受体。HIV膜蛋白gp120与细胞膜上的CD4结合后,gp120的构象发生变化,使gp41暴露出来。与此同时,gp120-CD4结合到目标细胞表面的趋化因子CXCR4或CXCR5上,形成cd4-gp120-cxcr4 / CXCR5三分子复合物。 Gp41利用其疏水性质介导病毒囊泡与细胞膜的融合。最终细胞被破坏。随着时间的推移,HIV破坏了如此多的这些细胞,以至于身体无法抵抗感染和疾病,使人更容易受到其他感染或与感染相关的癌症的侵害。
5.4 HIV感染的阶段
HIV感染有三个阶段:急性HIV感染阶段;临床潜伏期阶段;艾滋病(获得性免疫缺陷综合症)。
● 急性HIV感染阶段
许多人(但并非全部)在感染后2至4周内出现类似流感的症状。HIV症状包括发热、腺体肿胀、喉咙痛、艾滋病疹、肌肉和关节疼痛,以及这个阶段的头痛。
● 临床潜伏期阶段
潜伏期是指病毒在人体中生存或发展而不引起症状的时间段。在临床潜伏期阶段,标准实验室检测无法检测到病毒。但在这个时期,人们仍然可以将HIV传给其他人。平均临床潜伏期约为10年。
● 艾滋病(获得性免疫缺陷综合症)
艾滋病是HIV感染的最严重阶段。艾滋病患者的免疫系统严重受损,他们将遭受越来越严重的疾病,被称为机会性感染。当CD4细胞计数低于每立方毫米200个细胞(200个细胞/mm3)时,您被认为已发展成艾滋病。(在免疫系统健康的人群中,CD4细胞的数量在500到1600/mm3之间)。
6. 艾滋病相关疾病
6.1 HIV相关痴呆
与临床痴呆有关的原发性HIV神经系统疾病包括外周神经病变、脊髓病变和HIV脑病。由于这些疾病与临床痴呆有关,因此被称为艾滋病痴呆综合症(ADC)。HIV相关痴呆(HAD)常常表现为记忆力减退、注意力不集中、反应迟钝以及时间和空间定向障碍等初期症状,疾病逐渐进展。患有晚期HAD的患者可能会发展为严重痴呆 [11]。
6.2 消瘦综合征
HIV消瘦综合征表现为体重显著下降(> 10%)以及慢性腹泻或虚弱。间歇性或持续性发热也是HIV诊断的基础之一。
6.3 艾滋病性肾病
由HIV引起的肾脏损害包括直接由HIV引起的血栓性微血管病变,以及免疫介导的肾小球肾炎和肾病。美国学者Rao在1984年首次报道了HIV引起的肾脏疾病,并正式命名为HIV相关性肾病(HIVAN)。肾脏活检是确认HIVA的主要手段。
7. 艾滋病检测
目前,全球所有国家都已将HIV纳入血液筛查标准。用于筛查的方法主要包括HIV抗体检测、HIV抗原-抗体检测以及HIV核酸检测 [12]。
7.1 抗体检测
血清中的HIV抗体是HIV感染的间接指标。广泛使用的艾滋病检测方法包括第四代检测、酶联免疫吸附试验和化学发光免疫分析。艾滋病的窗口期可以缩短至14~21天 [13]。尽管窗口期内未检测到HIV抗体,但它们仍然具有传染性。其他检测方法包括:粒子凝集试剂、点斑法(一种快速酶联免疫法)。
7.2 抗原检测
病原体检测主要是指通过病毒分离培养、电子显微观察、病毒抗原检测和基因检测等方法,从宿主样本中直接检测病毒或病毒基因。在临床诊断中,一般使用抗原检测和RT-PCR(逆转录-聚合酶链反应)。
7.3 核酸检测
HIV核酸检测可用于辅助诊断、病程监测、治疗方案指导、疗效判断和疾病进展预测等。
常用于检测HIV病毒载量的方法包括逆转录聚合酶链反应(RT-PCR)、基于核酸序列的扩增(NASBA)、分支DNA杂交(bDNA)、实时荧光定量PCR等。
8. 艾滋病有治愈方法吗?
目前没有有效的HIV治疗方法,但在适当的医疗护理下,HIV可以得到控制。例如,魔术师约翰逊于1991年被诊断出患有HIV病毒。经过多年的坚持治疗,1997年3月,在检查后,医生确定约翰逊已克服了病毒并完全康复。
8.1 艾滋病预防
如果您是HIV阴性者,您有几种方法来保护自己免受HIV感染。您采取这些措施越多,您就会越安全。
- 使用避孕套。
- 减少性伴侣的数量。
- 使用预先曝露预防方法。这是指高危人群每天服用HIV药物以减少感染的风险。联邦指南建议考虑那些HIV阴性并与HIV阳性伴侣有持续性性关系的人。
- 使用暴露后预防方法(PEP),意味着在可能暴露于HIV之后采取抗逆转录病毒药物来预防感染。PEP只应在紧急情况下使用,并且必须在最近一次可能暴露于HIV之后的72小时内使用。
如果您是HIV阳性者,您可以采取许多措施来防止将HIV传播给HIV阴性的伴侣。
- 使用AIDS药物来预防HIV的性传播,这被称为治疗作为预防(TasP)。这是预防HIV传播最有效的方法之一。
- 如果HIV携带者在怀孕、分娩和产后全程使用HIV药物,可以减少怀孕、分娩和产后期间母婴传播的风险。
- 选择较低风险的性行为。
- 加强公众对HIV的教育,增进对政府HIV/AIDS政策的理解。
8.2 HIV的生命周期
- 病毒颗粒结合到宿主细胞表面受体并穿透细胞膜。
- 病毒颗粒在靶细胞的细胞质中去除蛋白外壳,释放基因RNA和逆转录酶(RT)。
- 病毒RNA在逆转录酶的催化下反转录成前病毒DNA。
- 前病毒DNA与病毒编码的整合酶(IN)结合,形成一个前整合复合物(PIC),并转移到细胞核内。
- 病毒DNA被整合到宿主细胞的染色体中。对人类基因组进行的完整测序研究显示,HIV优先整合到活跃转录的基因中[14],这个特点可能进一步使它们能够被复制和传播。
- 通过使用宿主细胞的基因复制和蛋白质表达系统进行复制和翻译。
- 病毒的蛋白酶(PR)将基因表达产生的多肽切割成各种活性的结构和功能蛋白,并与复制的遗传物质RNA组装成成熟的后代病毒。
- 一旦所有病毒成分都得到表达,新的病毒颗粒在细胞膜上组装并从细胞表面分裂出去。为了实现完全分裂,病毒劫持了细胞囊泡转运机制的组分。
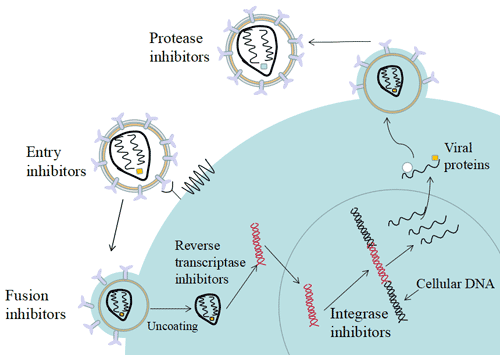
图8. HIV生命周期及抗HIV药物靶点
8.3 HIV的治愈
基于上述所述的HIV-1生命周期,目前正在使用或正在研发的抗艾滋病药物主要包括:
- 进入抑制剂 [15]:作用于HIV的病毒结合、共受体相互作用、HIV与细胞的融合;
- 核苷类逆转录酶抑制剂(NRTIs)和非核苷类逆转录酶抑制剂(NNRTIs):反转录病毒RNA;
- 整合酶抑制剂 [16]:前病毒DNA的整合;
- 蛋白酶抑制剂(PIs) [17]:DNA的转录、病毒蛋白质的翻译、病毒的组装、分裂和HIV病毒颗粒的成熟 [18] [19]。
目前,世界上最热门、最成功的新型抗艾滋病药物主要集中在HIV-1进入抑制剂和HIV-1整合酶抑制剂这两个领域 [20]。这些新型抗艾滋病药物为越来越多的耐药患者带来了新的治疗希望 [21]。
2018年5月,一个研究团队利用CRISPR/Cas9编辑技术开发出一种有效的方法,破坏HIV的调控基因,并成功抑制了感染细胞中HIV-1的增殖 [22]。
潜在的未来选择
目前还没有可预防或治疗HIV感染的HIV疫苗。然而,科学家正在努力开发中。目前,由美国国立卫生研究院支持的名为HVTN702的疫苗试验正在测试一种实验性疫苗计划是否能够安全地预防南非成年人的HIV感染。
参考文献:
[1] Barrésinoussi F, Chermann J C, Rey F, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS) [J]. Science, 1983, 220(4599):868-871.
[2] Gallo RC, Sarin PS, Gelmann EP, et al. Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS) [J]. Science, 1983, 220(4599):865-867.
[3]Ratner L, Haseltine W, Patarca R, et al. Complete nucleotide sequence of the AIDS virus, HTLV-III [J]. Nature, 1985, 313(6000):277-284.
[4]Sanchez-Pescador R, Power M D, Barr P J, et al. Nucleotide sequence and expression of an AIDS-associated retrovirus (ARV-2) [J]. Science, 1985, 227(4686):484.
[5]Wain-Hobson S, Sonigo P, Danos O, et al. Nucleotide sequence of the AIDS virus, LAV [J]. Cell, 1985, 40(1):9-17.
[6]Sharp P M, Hahn B H. Origins of HIV and the AIDS Pandemic [J]. Cold Spring Harbor Perspectives in Medicine, 2011, 1(1):a006841.
[7]Rhodes T, Singer M, Bourgois P, et al. The social structural production of HIV risk among injecting drug users [J]. Social Science & Medicine, 2005, 61(5):1026-1044.
[8] Smith J H, Whiteside A. The history of AIDS exceptionalism [J]. Journal of the International Aids Society, 2010, 13(1):1-8.
[9] Votteler J, Schubert U. Human Immunodeficiency Viruses: Molecular Biology [J]. Encyclopedia of Virology, 2008, 511:517-525.
[10] Hollingsworth TD, Anderson RM, Fraser C. HIV-1 transmission, by stage of infection [J]. The Journal of Infectious Diseases, 2008, 198(5):687-693.
[11]Moore D J, Masliah E, Rippeth J D, et al. Cortical and subcortical neurodegeneration is associated with HIV neurocognitive impairment [J]. Aids, 2006, 20(6):879-887.
[12]Patel, P, Mackellar, D, Simmons, P, et al. Detecting acute human immunodeficiency virus infection using 3 different screening immunoassays and nucleic acid amplification testing for human immunodeficiency virus RNA, 2006-2008 [J]. Archives of Internal Medicine, 2010, 170(1):66-74.
[13] Petak F, Albu G, Lele E, et al. Cost-effectiveness of a Fourth-Generation Combination Immunoassay for Human Immunodeficiency Virus (HIV) Antibody and p24 Antigen for the Detection of HIV Infections in the United States [J]. HIV Clinical Trials, 2012, 13(1):11-22.
[14] Schröder A R W, Shinn P, Chen H, et al. HIV-1 Integration in the Human Genome Favors Active Genes and Local Hotspots [J]. Cell, 2002, 110(4):521-529.
[15] Tomkowicz B, Collman R G. HIV-1 entry inhibitors: closing the front door [J]. Expert Opin Ther Targets, 2004, 8(2):65-78.
[16] Young S D. Inhibition of HIV-1 integrase by small molecules: the potential for a new class of AIDS chemotherapeutics [J]. Curr Opin Drug Discov Devel, 2001, 4(4):402-410.
[17] Reeves D J D, Piefer A J. Emerging Drug Targets for Antiretroviral Therapy [J]. Drugs, 2005, 65(13):1747-1766.
[18] Temesgen Z, Feinberg J E. Drug evaluation: bevirimat--HIV Gag protein and viral maturation inhibitor [J]. Current Opinion in Investigational Drugs, 2006, 7(8):759.
[19] Li F, Goila-Gaur R, Salzwedel K, et al. PA-457: A Potent HIV Inhibitor That Disrupts Core Condensation by Targeting a Late Step in Gag Processing [J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(23):13555-13560.
[20]Opar A. New HIV drug classes on the horizon [J]. Nature Reviews Drug Discovery, 2007, 6(4):258.
[21] Moore J P, Stevenson M. New targets for inhibitors of HIV-1 replication [J]. Nature Reviews Molecular Cell Biology, 2000, 1(1):40.
[22] Ophinni Y, Inoue M, Kotaki T, et al. CRISPR/Cas9 system targeting regulatory genes of HIV-1 inhibits viral replication in infected T-cell cultures [J]. Scientific Reports, 2018, 8.
上一篇: 你真的了解淋病吗?
下一篇: 重组猴痘病毒蛋白-加速猴痘研究











