ACVRL1(Alk1):TGF-β受体家族成员之一,全新的抗血管生成药物研究靶点!
日期:2024-01-05 15:48:39
近期,Nature Communications杂志发表了题为“Alk1 acts in non-endothelial VE-cadherin+ perineurial cells to maintain nerve branching during hair homeostasis”的研究论文 [1],强调了TGF-β受体Alk1在神经分支维持中的重要性。Alk1,又称ACVRL1,属于TGF-β受体家族,其作为新近报道的抗血管生成靶点受到研究者关注。尽管Alk1在多种信号通路中的调控机制尚未全面阐明,但陆续的研究揭示了ACVRL1(Alk1)在多种实体瘤和血管生成中发挥重要作用。目前,针对ACVRL1的靶向策略已经在探索中,且靶向ACVRL1在改善相关疾病症状方面展示出研究潜力。因此,ACVRL1(Alk1)作为全新的抗血管生成药物靶点,未来有望成为多种研究领域的有效靶点,为多种疾病的药物研究带来新的可能性和机遇!
1. 什么是TGF-β家族?
TGF-β家族是一类在结构、功能上相关的转化生长因子,包括TGF-β、活化素(Activin)、骨形成蛋白(bone morphogenic proteins,BMPs)等。TGF-β存在TGF-β1、TGF-β2和TGF-β3三种亚型。其中,TGF-β1是其主要存在形式,具有最强的生物活性。BMPs属于TGF-β超家族成员,大约有20多种,如BMP2和4,5,6,7,8a和8b,BMP9和BMP10,以及BMP12,BMP13和BMP14。TGF-β受体(TGF-β receptors,TβR)广泛存在于正常细胞及肿瘤细胞表面,包括I型(TβRI)、II型(TβRII)、III型TβRIII(betaglycan)及endoglin等。目前研究较多的是I型和II型两种受体,参与多种信号的转导。迄今为止,已鉴定出七种I型TGF-β受体(TβRI),分别命名为活化素受体样激酶1-7 (activin receptor-like kinase,ALK1-7)(点击查看“TGF-beta受体”专题报道) [2-4]。
2. 什么是ACVRL1?
2.1 ACVRL1的结构
活化素受体样激酶1(activin receptor-like kinase-1,ACVRL1/ALK1)属于TGF-β家族的I型受体(TβRI或ALK)成员之一,是丝氨酸/苏氨酸激酶受体。ACVRL1/ALK1基因定位于12q13,含10个外显子,基因组全长约15 kb,编码ACVRL1受体蛋白。ACVRL1是一种整合在细胞膜上的同形二聚体跨膜糖蛋白,含503个氨基酸残基,由N端胞外区、跨膜区和几乎全由丝氨酸-苏氨酸激酶区构成的胞内区三部分组成。ACVRL1与其他I型受体在丝氨酸-苏氨酸激酶亚结构域、GS结构域(位于激酶结构域之前的富含甘氨酸和丝氨酸的区域)和C末端尾部具有高度的相似性(图1) [5-6]。
2.2 ACVRL1的表达和功能
TGF-β家族的I型受体ACVRL1在内皮细胞和一些富含血管的组织,如肺、胎盘中具有高表达,其激活后可刺激内皮细胞增殖,与血管发生及形成密切相关。ACVRL1受体主要与转化生长因子(TGF-βs)结合,从而调节细胞增殖、分化、迁移、存活、粘附和发育等,例如ACVRL1在骨骼肌细胞中,促进肌肉再生,在成纤维细胞中促进伤口愈合。同时,ACVRL1作为重要的细胞信号传导分子,在多种生理和病理过程中扮演关键角色,陆续研究表面,异常的ACVRL1表达与多种癌症的发生和发展密切相关,凸显其在肿瘤病理生理中的重要性 [7-8]。
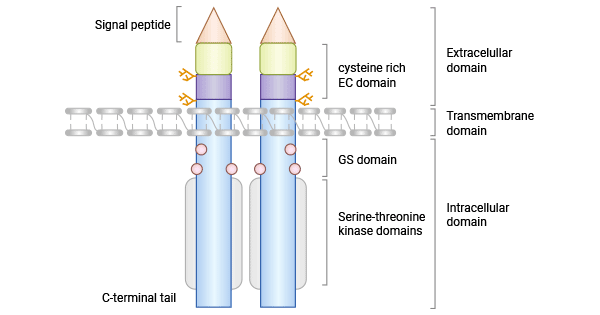
图1. ACVRL1/ALK1的结构 [5]
3. 什么是ACVRL1的配体?
ACVRL1的配体来自TGF-β家族成员,其中TGF-β与ALK1的亲和力较低,而BMP和BMP10被认为是与ACVRL1/ALK1具有高亲和力的生理学配体。但是,这两个配体并不会直接激活ACVRL1/ALK-1的丝氨酸/苏氨酸激酶活性,而需要在TβR-II或激活素II型受体的协助下才能完成激活过程。当配体与TGF-β受体相结合时,I型受体收到磷酸化后活化,而后进一步使包括ACVRL1/ALK-1的I型受体激活,并结合形成受体复合物,进一步激活下游的相关信号通路。这意味着,ACVRL1/ALK1的激活并不完全由其配体决定,而是由其配体与其他受体的相互作用决定。因此,ACVRL1/ALK-1被认为是一种“孤儿”受体,其活性的调节涉及多种信号通路和复合物的相互作用。这种复杂的调控机制使得ACVRL1/ALK1在细胞信号传导和生物学效应中扮演着多样化而关键的角色 [6, 9]。
4. ACVRL1相关的信号通路
4.1 ACVRL1-Smads信号调节机制
TGF-β需要ACVRL1(ALK1)和ALK5受体来发挥作用。在信号传导中,TGF-β首先与TβRII结合,激活TβRI,形成复合物并启动Smads信号通路。在内皮细胞中,激活两种不同的Smad信号通路会导致相反的效应。一方面,当BMP-9(或-10)与ACVRL1/ALK1受体结合后,会激活Smad1/Smad5信号级联,进一步招募BMPRII受体和辅助受体Endoglin(ENG)形成细胞表面复合物。TGF-β也可以通过结合到活跃的Tβ RII而启动此信号通路,随后招募并磷酸化ACVRL1/ALK1。Endoglin有助于配体-ALK1相互作用,并成为受体复合物的一部分 [10-11]。
当ALK1诱导Smad1/5(R-Smads)磷酸化后,这些激活的R-Smads能与共同型Smad4形成复合物,随后转运到细胞核,调控特定靶基因的转录,例如ID1和ID3。这些调控反应可能导致内皮细胞增殖和迁移的增加。另一方面,TGF-β也可以激活(依赖于Tβ RII)ALK5受体,导致Smad2/Smad3的磷酸化。激活的Smad2/3也能与Smad4形成复合物,并进入细胞核。这些核内Smad复合物可能调控基因的转录反应,例如PAI1,对内皮细胞的增殖和迁移产生抑制效应(图2) [10-11]。
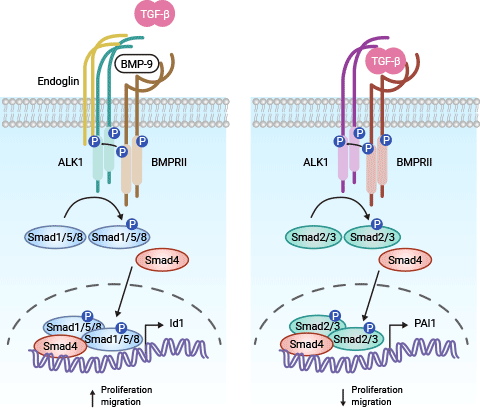
图2. ACVRL1相关的信号通路 [11]
4.2 ACVRL1抗肿瘤血管生成机制
ALK1作为TGF-β/BMPS家族的I型受体,与血管发生及形成密切相关,是介导TGF-β家族调节血管生成的重要因子。近年来发现,抑制ALK1信号通路可作为抗肿瘤血管生成的另一重要策略。研究发现,在胚胎肝脏中,ALK1通过与SMAD6相互作用,调节血管发育和功能。当SMAD6缺失时,ALK1信号传导过度激活,导致胚胎肝脏血管畸形和出血。在体内实验中,减少Alk1基因剂量可以挽救由Smad6缺失引起的胚胎肝脏出血和微血管毛细血管化。机制研究表明,ALK1信号传导过度激活会导致内皮细胞连接不稳定和收缩性增加。这会导致血管壁脆弱,容易破裂。因此,ALK1在胚胎肝脏血管发育中发挥着重要的“守护者”作用。它通过与SMAD6相互作用,维持血管发育和功能的正常。ALK1功能丧失会导致血管畸形和出血,表明平衡的ALK1信号传导对于血管发育至关重要 [12]。
5. ACVRL1在疾病中的研究
5.1 ACVRL1和遗传性出血性毛细血管扩张症研究
ACVRL1(ALK1)作为一种跨膜受体,参与血管生成和血管发育相关的关键信号通路。抑制ALK1信号传导已成为各种血管生成相关疾病(如遗传性出血性毛细血管扩张症)的一种有前途的研究策略。遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasis,HHT)是常染色体显性遗传性血管发育异常的一种疾病。临床可分HHT1、HHT2以及幼年性息肉病伴HHT(JPHT)三种表型。目前为止,已发现ALK-l、ENG(endoglin,CD105)和SMAD4基因突变可导致HHT。相关的研究已揭示,ENG基因突变引起HHT1型,ALK-1基因突变引起HHT2型,SMAD4基因突变引起JPHT型。因此,抑制ACVRL1(ALK1)可能成为HHT等多种血管生成相关疾病研究的重要靶点 [13]。
5.2 ACVRL1和系统性硬皮病研究
一项研究分析了ACVRL1(ALK1)在系统性硬皮病患者皮肤成纤维细胞中的表达功能情况。系统性硬皮病(Systemic Sclerosis,SSc)是一种结缔组织疾病,其特征是细胞外基质在皮肤和内脏等组织中的大量沉积,导致纤维化和功能障碍,同时伴随广泛的血管损伤和免疫系统的激活。这项结果显示,在SSc患者中,ALK1表达量明显高于正常人。免疫荧光结果证实ALK1主要分布在成纤维细胞的胞膜和胞浆。ALK1 siRNA转染实验中,成纤维细胞中ALK1、纤维连接蛋白和PAL-1的表达水平均呈下降趋势。相反,TGFβ1处理对照siRNA组后,对以上蛋白表达产生显著促进作用。这些研究结果暗示着,TGFβ1通过ALK1在成纤维细胞中调节了纤维连接蛋白和PAI-1的表达。这可能意味着ALK1在系统性硬皮病的纤维化过程中发挥着关键作用 [14]。
5.3 ACVRL1和肿瘤研究
目前国外内关于ACVRL1(ALK1)基因在肿瘤中的相关报道较少,只是通过不同研究实验证实了ALK1基因与肿瘤的发生、发展密切相关。在结直肠癌(CRC)治疗中,瑞戈非尼(Regorafenib)和索拉非尼(Sorafenib)等多靶点酪氨酸激酶抑制剂(mTKI)已获批准,但其在CRC疗效受限。最新实验表明,ACVRL1介导的耐药机制可能解释了这一限制。ACVRL1的敲低或过表达显著影响CRC细胞对mTKI的体内外敏感性,因此,针对ACVRL1可能是克服mTKI耐药的有效策略 [15]。
一项Ib期研究分析了Dalantercept和Sorafenib联合治疗晚期肝癌的安全性和有效性。Dalantercept是一种可溶性的ALK1受体融合蛋白,通过结合BMP9和BMP10,抑制ALK1信号通路,从而干扰成熟血管的形成,虽然该组合的抗肿瘤活性很低,但是ALK1作为HCC的研究靶点,其新颖性已引起研究人员的关注 [16];在非小细胞肺癌中,研究提示,相对于正常肺组织,ALK1 mRNA及蛋白在非小细胞肺癌组织中特异性上调表达,推测ALK1基因可能作为非小细胞肺癌分子靶向治疗的一个潜在靶点或者血清学肿瘤标志物 [17]。
5.4 ACVRL1和其它疾病研究
ACVRL1在其他疾病研究中也同样发挥重要作用。针对ALK1在脑神经方面的研究发现,TGF-β1-ALK1p-Smad1对神经保护起着作用,相反,TGF-β1-ALK5-p-Smad2/3则促发癫痛。在脑组织受损时,神经元和星形胶质细胞可以通过TGF-β1-ALK1-p-Smad1和TGF-β1-ALK5-p-Smad2/3通路发挥功能 [18]。此外,LRG-TGF-β-Alk-1/TGFßRII-Smads被探讨作为动脉瘤性蛛网膜下腔出血后慢性脑积水的预测生物标志物 [19]。
针对ALK1和ALK2在BMP9诱导成骨中的作用,体内外实验证实了其重要性。在体内体外水平验证了ALK1和ALK2对于BMP9诱导成骨的影响。在体外实验中,siALK1和siALK2能有效抑制碱性磷酸酶、钙盐和荧光素酶的活性,这三项是验证BMP9信号传导和体外成骨的重要指标。值得注意的是,实验结果表明siALK1和siALK2不仅抑制了BMP9信号传导,还阻碍了BMP9引导骨髓间充质干细胞向成骨细胞分化的过程。这些发现强调了ALK1在调控BMP9介导的骨细胞分化中的重要性,为未来针对骨相关疾病的治疗提供了有力的依据 [20]。
6. ACVRL1的临床药物研究前景
目前有三种药物针对ACVRL1(ALK1)正在进行研发,分别是单克隆抗体Ascrinvacumab、双特异性抗体ALK-1/VEGF bispecific antibody、单克隆抗体TATX-21。前两款药物由苏州开拓药业和辉瑞公司联合开发。TATX-21由ImmunoPrecise Antibodies和Talem Therapeutics联合开发。早前另有一款融合蛋白Dalantercept,但现在尚处于终止阶段。三款在研的药物的阶段不同,其中Ascrinvacumab已经进入中国的临床试验,其他2种药物还处于海外的早期研究阶段。这些药物的治疗领域也不同,Ascrinvacumab和ALK-1/VEGF bispecific antibody主要针对实体瘤,TATX-21主要用于治疗动脉硬化和心脏病。总之,ALK1作为一个全新的抗肿瘤血管新生的靶点,有望为心血管疾病、免疫系统疾病、肿瘤等研究带来新的突破和进展!
为鼎力协助各药企针对ACVRL1(ALK1)在心血管疾病、免疫系统疾病、肿瘤等疾病在临床中的研究,CUSABIO推出ACVRL1活性蛋白(CSB-BP001262HU1)和抗体(CSB-RA555022A0HU;CSB-RA001262MA1HU)产品,助力您在ACVRL1机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页 CUSABIO ACVRL1 蛋白
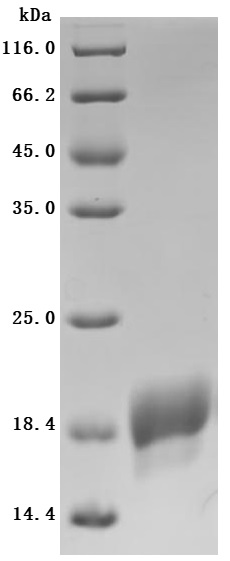
The high purity is greater than 95% as determined by SDS-PAGE.
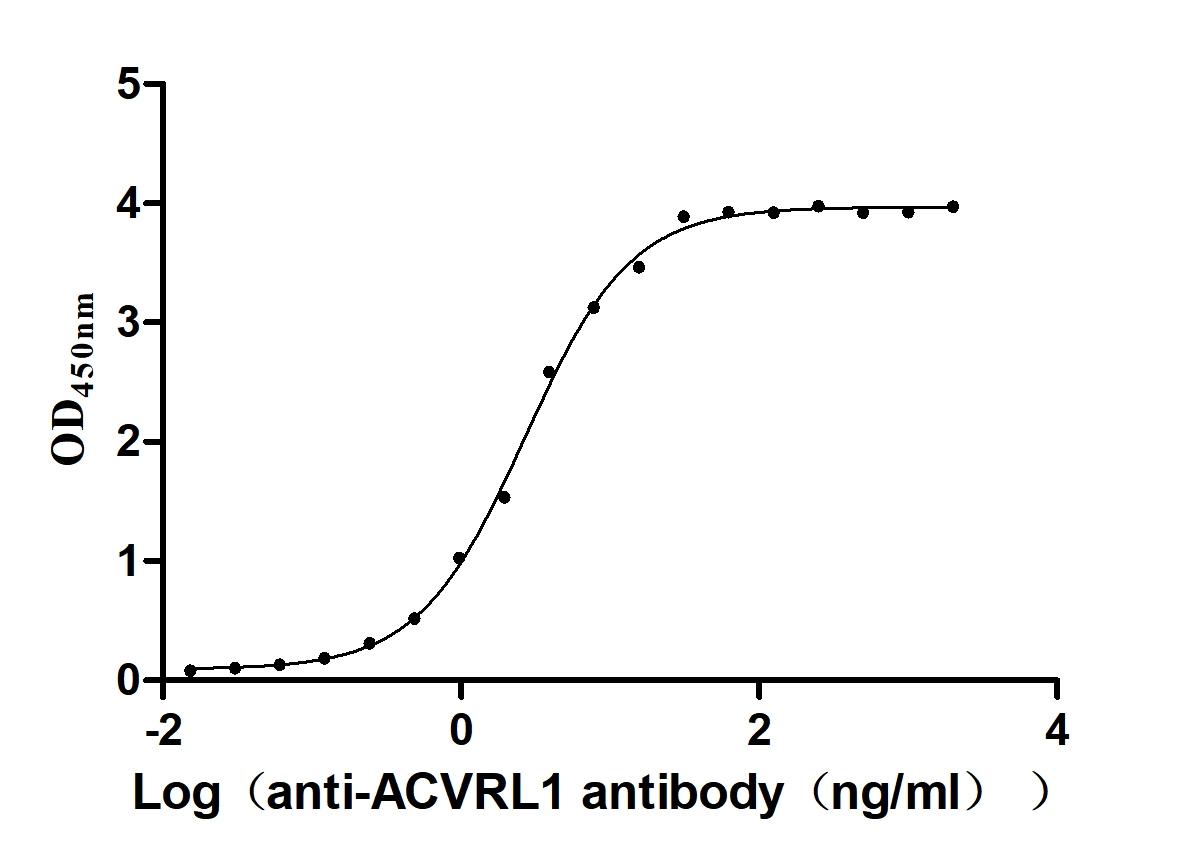
Immobilized Human ACVRL1 at 2μg/mL can bind Anti-ACVRL1 recombinant antibody (CSB-RA001262MA1HU). The EC50 is 2.417-2.971 ng/mL.
参考文献:
[1] Chovatiya, Gopal, et al. "Alk1 acts in non-endothelial VE-cadherin+ perineurial cells to maintain nerve branching during hair homeostasis." Nature Communications 14.1 (2023): 5623.
[2] Bierie, Brian, and Harold L. Moses. "TGF-β and cancer." Cytokine & growth factor reviews 17.1-2 (2006): 29-40.
[3] Tzavlaki, Kalliopi, and Aristidis Moustakas. "TGF-β Signaling." Biomolecules 10.3 (2020): 487.
[4] Vander Ark, Alexandra, Jingchen Cao, and Xiaohong Li. "TGF-β receptors: In and beyond TGF-β signaling." Cellular signalling 52 (2018): 112-120.
[5] Munoz-Felix, Jose M., Maria Gonzalez-Nunez, and Jose M. Lopez-Novoa. "ALK1-Smad1/5 signaling pathway in fibrosis development: friend or foe?." Cytokine & growth factor reviews 24.6 (2013): 523-537.
[6] Bhave, Shreyas, et al. "ALK1 Deficiency Impairs the Wound-Healing Process and Increases Mortality in Murine Model of Myocardial Infarction." Journal of Cardiovascular Translational Research (2023): 1-9.
[7] Li, Kefei Nina, et al. "Blood endothelial ALK1‐BMP4 signaling axis regulates adult hair follicle stem cell activation." The EMBO Journal (2023): e112196.
[8] Johnston, E. D., W. Wang, and K. Lyons. "A single-cell rna sequencing analysis of alk1 and related bmp pathway proteins in osteoarthritis progression." Osteoarthritis and Cartilage 31.5 (2023): 673-674.
[9] Chu, Kit Yee. Elucidating the Role of the TGF-β Superfamily Signaling in Pulmonary Vascular Cell Proliferation. Diss. Michigan State University, 2023.
[10] Finnson, Kenneth W., et al. "ALK1 opposes ALK5/Smad3 signaling and expression of extracellular matrix components in human chondrocytes." Journal of bone and mineral research 23.6 (2008): 896-906.
[11] Hawinkels, Lukas JAC, Amaya Garcia de Vinuesa, and Peter Ten Dijke. "Activin receptor-like kinase 1 as a target for anti-angiogenesis therapy." Expert opinion on investigational drugs 22.11 (2013): 1371-1383.
[12] Kulikauskas, Molly R., et al. "Endothelial Cell SMAD6 Balances ACVRL1/Alk1 Function to Regulate Adherens Junctions and Hepatic Vascular Development." bioRxiv (2023): 2023-03.
[13] Duerig, Inga, et al. "Nonfunctional TGF-β/ALK1/ENG signaling pathway supports neutrophil proangiogenic activity in hereditary hemorrhagic telangiectasia." Journal of Leukocyte Biology 114.6 (2023): 639-650.
[14] Morris, Erin, et al. "Endoglin promotes TGF‐β/Smad1 signaling in scleroderma fibroblasts." Journal of cellular physiology 226.12 (2011): 3340-3348.
[15] Lu, Xiaolin, et al. "ACVRL1 drives resistance to multitarget tyrosine kinase inhibitors in colorectal cancer by promoting USP15-mediated GPX2 stabilization." BMC medicine 21.1 (2023): 366.
[16] Abou‐Alfa, Ghassan K., et al. "A phase Ib, open‐label study of dalantercept, an activin receptor‐like kinase 1 ligand trap, plus sorafenib in advanced hepatocellular carcinoma." The Oncologist 24.2 (2019): 161-e70.
[17] Casaluce, Francesca, et al. "ALK inhibitors: a new targeted therapy in the treatment of advanced NSCLC." Targeted oncology 8 (2013): 55-67.
[18] Cacheaux, Luisa. A Novel Role for TGF-Beta Signaling in Epileptogenesis. Diss. UC Berkeley, 2010.
[19] Ma, Dongying, et al. "The LRG-TGF-β-Alk-1/TGFßRII-Smads as Predictive Biomarkers of Chronic Hydrocephalus after Aneurysmal Subarachnoid Hemorrhage." Journal of Neurological Surgery Part A: Central European Neurosurgery (2023).
[20] Seong, Chang‐Hwan, et al. "Early induction of Hes1 by bone morphogenetic protein 9 plays a regulatory role in osteoblastic differentiation of a mesenchymal stem cell line." Journal of Cellular Biochemistry 124.9 (2023): 1366-1378.











