细胞免疫治疗-CAR-T细胞疗法
日期:2019-09-10 10:49:50
癌症治疗方式一般包括三种,手术、化学疗法和放射疗法。但是近两年,免疫疗法在癌症治疗领域可谓占尽风头,尤其免疫治疗更是取得了前所未有的突破。免疫治疗旨在增强患者免疫系统攻击肿瘤的能力,目前已成为癌症治疗的“第五支柱”。前面已经详细介绍过免疫治疗药物中的明星——PD-1/PD-L1抑制剂,目前为止,免疫治疗药物已在非小细胞肺癌、小细胞肺癌、三阴性乳腺癌和黑色素瘤等癌症治疗中占有一席之地。
然而,以PD-1/PD-L1为代表的免疫药物仅仅是肿瘤免疫治疗中的一方面,除了用药物解除肿瘤细胞对免疫细胞的抑制,另一方面是直接利用患者体内的T细胞,将它们拿到体外进行改造,大量复制后再回输到患者体内,这也就是常说的免疫细胞疗法。
细胞免疫疗法又称为过继细胞转移(ACT),抽取和使用患者自身免疫细胞来治疗他们的癌症。目前细胞免疫疗法包括肿瘤浸润淋巴细胞(TIL)、T细胞受体(TCR)和嵌合抗原受体(CAR)三中类型。其中CAR-T细胞疗法是唯一在临床开发方面取得重大进展的疗法。针对这一细胞疗法,我们分别从六个方面进行介绍,包括定义、过程、发展历史、目标和挑战等。
1. 什么是CAR-T细胞疗法?
CAR-T细胞疗法的全称是chimeric antigen receptor T cell therapy,即嵌合抗原受体T细胞疗法,原理是应用患者自身的T淋巴细胞,经过实验室重新改造,装载上具有识别肿瘤抗原的受体及共刺激分子,体外扩增后再次回输入患者体内,从而识别并攻击自身的肿瘤细胞。2014年,CAR-T细胞治疗已在急性淋巴细胞白血病(ALL)中取得显著疗效,个性化治疗效果显著。这也给血液恶性肿瘤的治疗带来希望之光。
目前,已有两种免疫细胞疗法在2017年获得美国FDA批准上市。即诺华的Kymriah,和Kite Pharmar的Yescarta,这两款CAR-T疗法的适应症就是治疗罹患B细胞前急性淋巴细胞白血病及复发或难治性大B细胞淋巴瘤的成人患者。不过遗憾的是,国内目前尚无批准上市的细胞疗法。
2. 治疗原理
CAR-T细胞疗法一般要持续几周时间,如图1所示,简单来说可分为5个步骤:
一是医生利用白细胞分离技术从患者的血液中提取免疫T细胞;
二是利用基因工程技术给T细胞加入一个能识别肿瘤细胞,并且同时激活T细胞杀死肿瘤细胞的嵌合抗体,T细胞立马变身为高大上的CAR-T细胞。它不再是一个普通的T细胞,而是一个带着GPS导航,随时准备找到癌细胞,并发动自杀性袭击,与之同归于尽的“恐怖分子”T细胞;
三是体外培养,大量扩增CAR-T细胞,一般一个病人需要几十亿,乃至上百亿个CAR-T细胞(体型越大,需要细胞越多)。
四是一旦有足够的CAR-T细胞,扩增好的CAR-T细胞输回病人体内。
五是严密监护病人,尤其是控制前几天身体的剧烈反应。
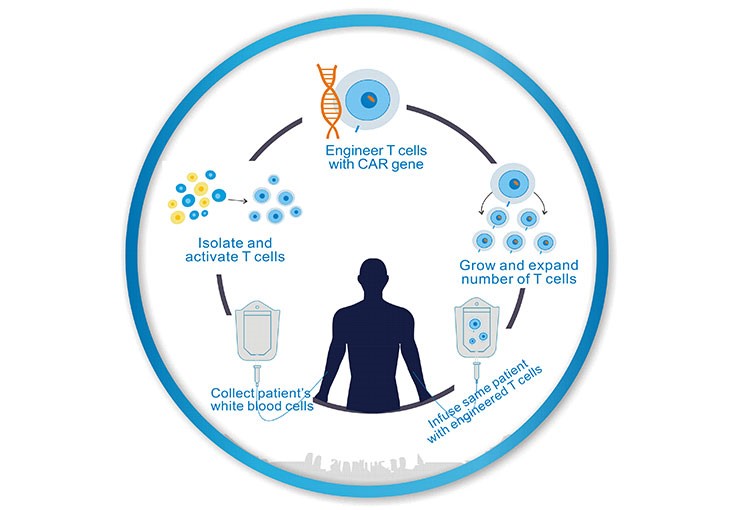
Figure 1. The Processes of CAR-T Cell Therapy
3. CAR-T细胞疗法的发展历程
实际上,CAR-T技术已经使用多年,但近年才被改进为一种新型细胞疗法应用于临床。它对急性白血病和非霍奇金淋巴瘤的治疗疗效显著,被认为是最有希望的肿瘤治疗方法。与所有技术一样,CAR-T技术经历了漫长的演变过程。也正是在这一系列演变中,CAR-T技术逐步走向成熟。这里,我们列出有代表性的三代CAR-T细胞疗法。
3.1 第一代CAR-T细胞疗法
第一代CAR介导的T细胞激活是通过CD3z链或FceRIg上的酪氨酸激活基序完成的。CD3z链能够提供激活T细胞、裂解靶细胞、调节IL-2分泌以及体内发挥抗肿瘤活性所需的信号。但第一代CAR改造T细胞的抗肿瘤活性在体内受到了限制,T细胞增殖减少最终会导致T细胞的凋亡。
3.2 第二代CAR-T细胞疗法
第二代CAR介导的T细胞疗法在细胞中添加了新的共刺激信号,可增强源自TCR / CD3复合物的原始“信号1”。 许多研究表明,增加了“信号2”的CAR-T 细胞疗法与第一代相比,尽管第二代CAR在抗原特异性上没有差异,但其T细胞增殖、细胞因子分泌、抗凋亡蛋白分泌的能力和细胞死亡延迟的时间都优于第一代CAR-T细胞疗法。常用的共刺激分子是CD28,但随后研究用CD137(4-1BB)代替了CD28。 此外,还提出了使用NK细胞受体CD244的想法。
3.3 第三代CAR-T细胞疗法
为了进一步改良CAR的设计,许多研究组开始着眼于发展第三代CAR-T,不仅包括“信号1”、“信号2”,还包括了额外的共刺激信号。不同研究者们用不同的靶点和共刺激信号开展的研究所得到的第二代CAR和第三代CAR的比较结果存在一定的差异性。一些研究报道表达第三代CAR的重组T细胞在抗肿瘤活性、存活周期及细胞因子释放方面均显著提高;Wilkie等的研究结果显示靶向MUC1的第二代CAR与第三代CAR重组T细胞在抗肿瘤细胞毒性方面并无明显差异,虽然表达第三代CAR的T细胞能够分泌更大量的IFN-γ[1]。
4. CAR-T典型构造
典型的CAR由细胞外抗原结合区、跨膜区和细胞内信号转导区组成。 如图2所示,抗原结合区由轻链(v1)和衍生自单克隆抗体的重链(vh)组成,并通过铰链区连接形成单链片段可变区(scfv)。 CAR结构的第一个关键部分是识别肿瘤抗原的单链抗体,例如CD19,EGFR等,而不是处理需要加工的抗原肽。
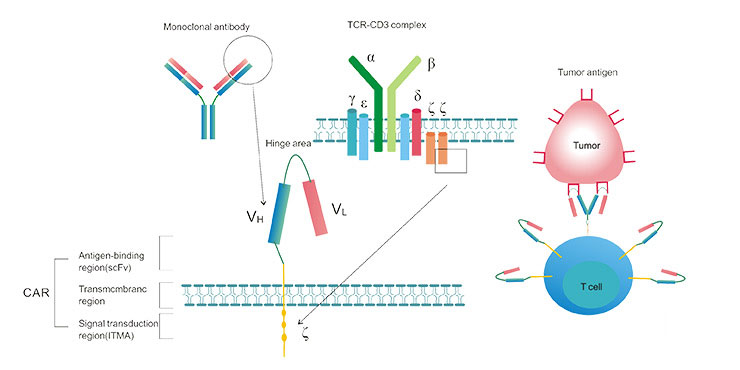
Figure 2. The Typical Structure of CAR-T
5. CAR-T细胞疗法靶点
在过去几年中,多个机构的临床试验对CAR修饰的T细胞(CAR-T细胞)治疗B细胞恶性肿瘤进行了评估,如B细胞急性淋巴细胞白血病(B-ALL)、慢性淋巴细胞白血病(CLL)和B细胞非霍奇金淋巴瘤(BNHL)可通过靶向CD19 [2] [3]、CD20 [4] 或CD30 [5]进行治疗。除此之外,CAR-T细胞疗法的靶位点还包括目前临床中的CD22,CD123,CD133,PD-L1和HER2。
CD19,CD19是簇分化抗原的一种,是B细胞增殖、分化、活化及抗体产生有关的重要膜抗原。CD19分布于全体B细胞、毛细胞白血病细胞等恶性B细胞、滤泡树状细胞上,是诊断B细胞系肿瘤(白血病、淋巴瘤)和鉴定B细胞最好的标记。CD19特异性CAR-T细胞中B-ALL的成功率最高,其完全缓解率(CR)高达70~94%[6]。
CD20抗原是一种B细胞分化抗原,仅位于前B细胞和成熟B细胞,从pro-B期开始(CD45R+,CD117+)并且逐渐增加浓度直至成熟。它在95%以上的B细胞性淋巴瘤中表达,而在造血干细胞、血浆细胞和其他正常组织中不表达。一些研究表明,CD20是NHL免疫治疗的理想靶抗原,因为它几乎普遍表达在B细胞淋巴瘤表面的高拷贝数,并且调节最小[7] [8]。
CD30,也称为TNFRSF8,是肿瘤坏死因子受体家族和肿瘤标志物的细胞膜蛋白。CD30广泛表达于所有经典的霍奇金淋巴瘤(HL),间变性大细胞淋巴瘤(ALCL),部分其他淋巴细胞瘤,包扩皮肤T细胞淋巴瘤,弥漫性B细胞淋巴瘤细胞表面。在众多候选靶点中脱颖而出,是目前淋巴瘤治疗最有希望的靶点。临床前研究已经证实了CD30CAR-T治疗的可行性。
CD22特异表达于B细胞,随着B细胞分化、成熟,CD22表达增加,但是它不表达于浆细胞。CD22与CD450R、CD75结合,介导B细胞与单核细胞、B细胞与T细胞和B细胞与B细胞之间的相互作用。它是属于SIGLEC凝集素家族的分子和调节分子,可防止免疫系统的过度激活和自身免疫疾病的发展[9]。
CD123,也称为IL-3受体,主要位于胞浆与胞膜,有助于传递白细胞介素-3的信号。白介素-3是免疫系统中重要的可溶性细胞因子。CD123在急性髓性白血病(AML)亚型中表达,包括白血病干细胞。
CD133,也称为prominin-1,是一种5次跨膜糖蛋白,特异性定位于细胞突起。CD133抗原可被3种CD133抗体识别:克隆AC133、293C3和AC141。AC133直接与CD133/1糖基化抗原表位结合,可用于从外周血、骨髓、脐带血及其它组织中分析和分选CD133+细胞。多数情况下CD133/1和CD133/2识别同种细胞,只是有表达强度的差别,但是在骨髓增生异常综合征(myelodysplastic syndrome,MDS)和某些急性髓性白血病中发现CD133/1和CD133/2表达不同,或者正常表达强度紊乱。
PD-L1首次被发现是由华裔学者陈列平教授在1999年作为B7家族的第3个成员B7-H1。次年,Tasuku Honjo与哈佛医学院的Gordon Freeman证实B7-H1能够与PD-1结合,抑制T细胞增殖以及细胞因子分泌,负调控淋巴细胞的激活。随后,B7-H1也被更名为程序性死亡受体配体-1(PD-L1)。PD-L1除了会表达在肿瘤表面,参与免疫逃逸,还会在IFN-γ刺激下,表达在抗原提呈细胞(DC细胞、巨噬细胞等),以及血管内皮细胞的表面。
HER2,也称为CD340,是人表皮生长因子受体(HER / EGFR / ERBB)家族的成员。大量数据表明该癌基因的扩增或过表达在某些侵袭性类型的乳腺癌的发展和进展中起重要作用。近年来,该蛋白已成为约30%乳腺癌患者的重要生物标志物和治疗靶点[10]。
6. 其他T细胞疗法
前面提到T细胞疗法可分为三种类型,肿瘤浸润淋巴细胞(TIL)、T细胞受体(TCR)和嵌合抗原受体(CAR)。
6.1 肿瘤浸润淋巴细胞
肿瘤浸润淋巴细胞(TIL)是从肿瘤组织分离的淋巴细胞。它在体外由IL-2诱导,可以特异性杀死肿瘤细胞。这类细胞主要来源是通过手术切除获得的实体肿瘤组织和浸润淋巴结。由于TIL比LAK和CIK具有更强的肿瘤特异性,因此它是目前世界上研究和应用的主要免疫疗法。
6.2 T细胞受体
T细胞受体(TCR)基因疗法是指利用分子生物学方法克隆肿瘤特异性T细胞的TCR,并且通过含有TCR的病毒载体将TCR转移到正常T细胞中,从而使这些T细胞成为肿瘤特异性杀伤细胞。在目前已有的临床试验中,TCR转染的T细胞可以介导肿瘤消退,而且这些重新输注的T细胞可以在体内存活超过半年。与前两种T细胞疗法相比,TCR基因治疗的临床疗效相对较低,而寻找具有高亲和力TCR受体的有效肿瘤靶抗原克隆并优化TCR转化效率是当前的研究热点。
References
[1] Wilkie S, Picco G, et al. Retargeting of human T cells to tumor associated MUC1: The evolution of a chimeric antigen receptor [J]. J Immunol. 2008, 180: 4901–4909.
[2] Maude SL, Frey N, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia [J]. N Engl J Med. 2014, 371(16):1507–17
[3] Kochenderfer JN, Dudley ME, et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor [J]. J Clin Oncol. 2015, 33(6):540–9.
[4] Zhang W-y, Wang Y, et al. Treatment of CD20-directed chimeric antigen receptor-modified T cells in patients with relapsed or refractory B cell non-Hodgkin lymphoma: an early phase IIa trial report [J]. Signal Transduction TargetTher. 2016, 1:16002.
[5] Wang CM, Wu ZQ, et al. Autologous T Cells expressing CD30 chimeric antigen receptors for relapsed or refractory Hodgkin lymphoma: an openlabel phase I trial [J]. Clin Cancer Res. 2016.
[6] Kochenderfer JN, Dudley ME, et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor [J]. J Clin Oncol. 2015, 33(6):540–9.
[7] Bindon CI, Hale G, et al. Importance of antigen specificity for complement-mediated lysis by monoclonal antibodies [J]. Eur J Immunol 1988; 18: 1507–1514.
[8] Brentjens RJ, Riviere I, et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias [J]. Blood. 2011; 118: 4817–4828.
[9] Hatta, et al. Identification of the gene variations in human CD22 [J]. Immunogenetics. 1999, 49 (4): 280–286.
[10] Mitri Z, Constantine T, et al. The HER2 Receptor in Breast Cancer: Pathophysiology, Clinical Use, and New Advances in Therapy [J]. Chemotherapy Research and Practice. 2012, 743193.
上一篇: 细胞器标志物,你知道多少?














