文献解读│CUSABIO产品问鼎Nature:VEGF-C驱动的淋巴引流可对脑肿瘤进行免疫监视
日期:2020-03-11 15:03:56


众所周知,脑屏障可以保护人脑,防止危险病原体进入。但由于缺乏淋巴引流,免疫系统对中枢神经系统内病原体和肿瘤的监视是有限的。然而,脑膜中淋巴管的存在表明,中枢神经系统与外周免疫系统之间存在关联,可能影响自身免疫。脑膜淋巴网络特征的揭示可帮助人们理解,先前未知的大脑内表达的抗原如何引起免疫应答。胶质母细胞瘤是成人颅内最常见的恶性肿瘤,目前尚无非常有效的治疗方法,临床治疗主要是手术切除,再辅以放化疗,但预后生存率仅为18个月,因此探索新的治疗途径非常重要。
此次研究中,研究人员利用胶质母细胞瘤小鼠模型,报道了一种新颖的脑肿瘤治疗策略,血管内皮生长因子C(VEGF-C)的异位表达有可能增加脑膜淋巴管,从而实现免疫监视,启动T细胞介导的脑肿瘤免疫,达到治疗效果。
由VEGF-C介导的抗胶质母细胞瘤保护作用依赖于引流的淋巴结和T细胞 胶质母细胞瘤缺乏淋巴管生成信号 VEGF-C增强免疫检查点阻滞 VEGF-C恢复中枢神经系统限制性T细胞启动
1由VEGF-C介导的抗胶质母细胞瘤保护作用依赖于引流的淋巴结和T细胞
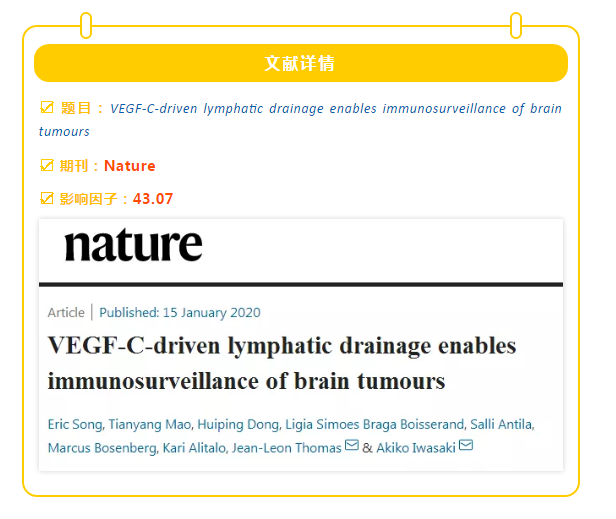
脑膜淋巴管分布于硬脑膜周围,将大脑与外周淋巴系统紧密维系。在此,研究者用C57BL/6同基因细胞系GL261构建小鼠胶质母细胞瘤模型,起初利用腺病毒相关载体AAV9 在小鼠脑内过表达了 VEGF-C,并发现接受AAV9 -VEGF-C 注射的实验组小鼠脑膜淋巴管的淋巴窦面积出现了明显的上升 (Fig. 1a, b)。而且AAV9-VEGF-C 注射实验组对胶质母细胞瘤实现了 100% 的清除(Fig.1c)。
因为此前已经有研究证明下颌淋巴结与颈外侧浅淋巴结对中枢神经系统的抗原识别有非常重要的作用,所以研究人员随后将过表达 VEGF-C 的小鼠中通往这两个淋巴结的淋巴管进行了结扎。发现 VEGF-C 在结扎后的小鼠中不能帮助他们抵抗脑瘤(Fig. 1d);而通过CD8 和 CD4 抗体清除 CD8 / 4 T细胞后,VEGF-C的预防作用也大幅度下降(Fig. 1e, f)。
这两个实验证明了 VEGF-C 对脑瘤的预防作用需要有抗原识别作用的淋巴结和 CD8 / 4 T 细胞的参与。
▲Fig. 1VEGF-C-mediated protection against glioblastoma depends on the draining lymphnodes and on T cells.
2胶质母细胞瘤缺乏淋巴管生成信号
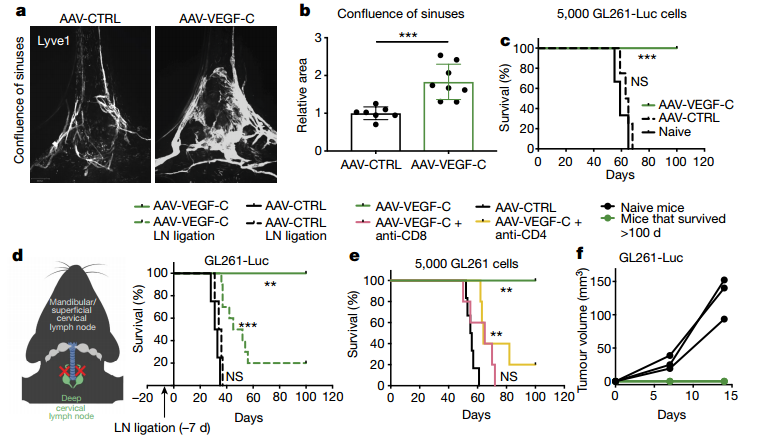
研究表明,在小鼠或人类中,肿瘤自身的VEGF-C过表达可导致发生在中枢神经系统外部区域的恶性肿瘤预后较差。研究人员通过对 GTEX 和 TCGA 数据库中的正常人与胶质母细胞瘤患者的脑组织转录组进行分析,发现了胶质母细胞瘤组织中出现了更高的血管促进因子 VEGF-A 和CD31 的表达,而 VEGF-C 的表达则出现了显著的下降(Fig. 2a, b, c)。
但是,在最近发表的抗 PD- 1 疗法对GBM 的治疗作用的研究中,VEGFC的表达与T细胞浸润有很强的相关性(通过T细胞标记基因CD3E,CD4和CD8B的表达来衡量)(Fig.2d, e, f)。这些结果表明在胶质母细胞瘤患者和实验小鼠中,胶质母细胞瘤微环境丧失了淋巴管生成信号,并且在小鼠胶质母细胞瘤的模型中,VEGF-C的异位表达有抗胶质母细胞瘤作用。换言之,VEGF-C 在胶质母细胞瘤中的缺失可能导致了胶质母细胞瘤的发生或生长。
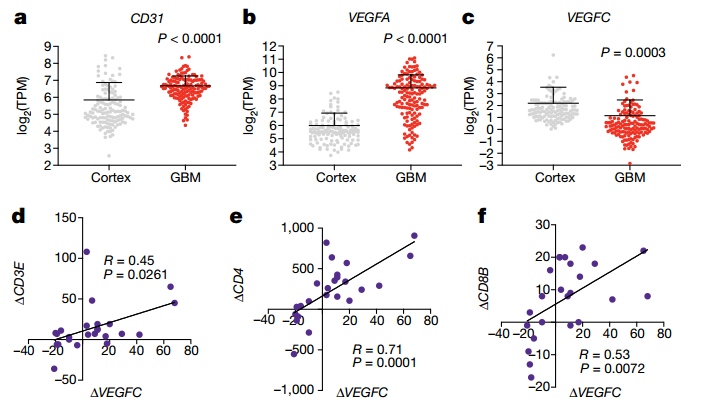
▲Fig.2 Human glioblastoma is deprived of lymphangiogenic signals at steady state,and VEGF-C levels correlate with T cell infiltration with anti-PD-1 therapy.
3VEGF-C增强免疫检查点阻滞
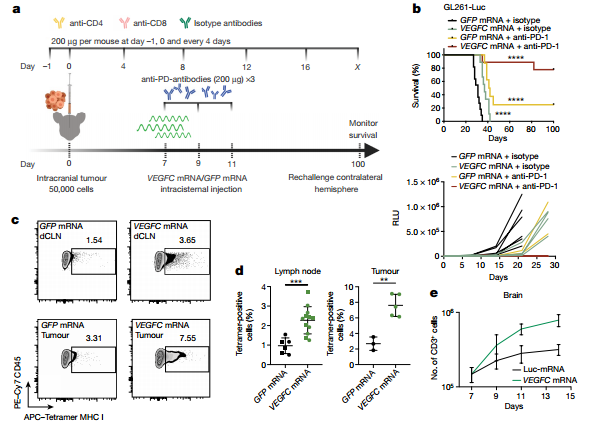
▲Fig. 3 Therapeutic delivery of VEGF-C potentiates checkpoint inhibitortherapy by enhancing T cell priming and recruitment.
4VEGF-C恢复中枢神经系统限制性T细胞启动
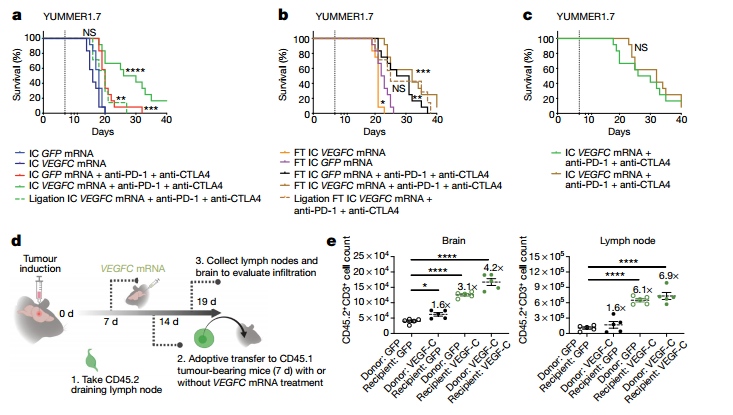
与在胶质母细胞瘤患者中观察到的相反,有报告显示,在转移至脑部的黑色素瘤患者中,与尼古鲁单抗和伊匹木单抗联合治疗具有相同的颅内外功效。而且具有颅外和颅内肿瘤的小鼠对免疫疗法的反应比仅具有颅内黑素瘤的小鼠更好。为了检查VEGFC mRNA在中枢神经系统中是否有效治疗其他(非胶质母细胞瘤)类型的癌症,研究使用了黑色素瘤细胞系YUMMER1.7和B16。
仅有颅内YUMMER1.7肿瘤的小鼠在接受VEGFC mRNA和检查点抑制剂治疗后显示出明显的生存获益(Fig 4a)。相比之下,检查点抑制剂治疗对同时具有颅外和颅内肿瘤的小鼠(后面称同时具有颅内和颅外肿瘤的小鼠为颅内外肿瘤小鼠)有明显作用,而这种作用与VEGFC mRNA的治疗无关(Fig4b)。实际上,仅接受联合治疗的颅内肿瘤小鼠的生存率与仅接受检查点抑制剂治疗的颅内外肿瘤小鼠相似(Fig 4c)。另外,深颈淋巴结的结扎仅影响具有颅内肿瘤的小鼠,而不影响具有颅内外肿瘤小鼠(Fig 4a,b)。
这说明了 VEGF-C 既可以在颅内通过改变脑内微环境帮助 T 细胞浸润,也可以在颅外通过活化 T 细胞抵抗肿瘤。为了进一步证明这一点,研究人员进行了浸润白细胞移植试验,发现单独活化 T 细胞与单独改善瘤内微环境都可以提高肿瘤和淋巴结内的 T 细胞数量,而两者叠加后出现了进一步协同作用(Fig 4d, e)。这证明VEGF-C 通过两种机制帮助大脑获得对脑瘤的免疫监视功能。
—END—
——j9九游会登录入口首页生物·让科研变得有温度!——
资源|基础研究数据库汇总 汇总|细胞器标志物通宵整理 精品推介|新兴治疗靶点BCMA 精品推介|EGFR最新研究进展及药物发展现状 精品推介|EphA3—细胞粘附和迁移的调节器 精品抗体|Oct4—胚胎干细胞多能性的看门人 精品抗体|GFAP—星形胶质细胞特异性标志物 精品抗体|肿瘤标志物CD146 精品抗体|CD31—多功能分子

上一篇: 战疫时刻|Th17细胞分化











