免疫组化与病理诊断
日期:2020-03-16 09:04:42
免疫组织化学(Immunohistochemistry,IHC)是临床病理诊断中常用的技术和手段。从20世纪70年代开始,免疫组化技术就已经应用于病理诊断,对诊断肿瘤、肿瘤分类、判断预后产生了巨大的影响,同时也扩展了人们对于各种疾病及肿瘤形成过程的认识,提高了病理诊断与研究水平。本文重点讨论了免疫组化技术在临床上的应用与常见的免疫组化指标在临床上的意义。
1、什么是免疫组化?
在了解免疫组化在临床上的应用之前,我们先来了解下什么是免疫组化。免疫组化,是应用免疫学基本原理——抗原抗体反应,即抗体和抗原之间的结合具有高度的特异性,先将组织或细胞中的某种化学物质提取出来,以此作为抗原或半抗原。然后通过免疫动物后获得特异性的抗体,再用此抗体去探测组织或细胞中的同类抗原物质。由于抗原与抗体的复合物是无色的,因此还必须借助于组织化学的方法(荧光素、酶、金属离子、同位素)将抗原抗体结合的部位显示出来,以其达到对组织或细胞中的未知抗原进行定性,定位或定量的研究(Figure 1)。
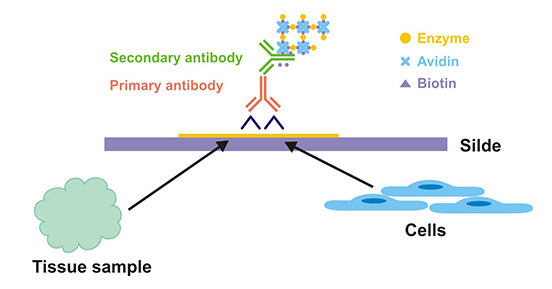
Figure 1. The theoretical diagram of IHC
免疫组化针对的样本主要是组织。组织是来自患者或动物,经过冷冻或石蜡包埋。将这些组织制成约4μm厚的切片,封片后再处理。若样本是细胞,通常被称为免疫细胞化学(Immunocytochemistry,ICC)。对于ICC,大部分细胞外基质及其他基质组分被去除,只剩下整个细胞来染色。ICC的来源可以是细胞悬液,来自患者或动物(如血涂片、拭子等),或在实验室中进行的组织培养细胞系。
2、什么是病理诊断?
病理诊断是研究疾病发生发展和疾病过程中患病机体形态结构、功能代谢改变与疾病转归,从而为疾病的诊断、治疗与预防提供必要的理论基础和实践依据。
病理诊断是对手术切下或尸体解剖取下的肿瘤标本进行固定染色后,在显微镜下进行组织学检查,以便于诊断疾病。样本更多源于活人。尽管各种影像学技术飞速发展,但是病理诊断仍然是肿瘤各种检查方法中最可靠的,病理诊断被喻为“金标准”,也是疾病的最终诊断。如果将病理诊断和生化免疫等检验诊断进行比较,病理诊断就好像警察办案获得的指纹、脚印、DNA等实际证据。因其通过显微镜观察疑似病变组织的细胞形态和结构,可直接看出组织发生了怎样的病理变化,能较准确地对疾病做出判断,尤其在肿瘤性质的诊断上更为常用。而免疫组化,就是病理诊断中最常用的检测技术。
3、免疫组化技术在临床上的应用
目前免疫组化技术应用于临床主要有以下几个方面:
- 肿瘤良恶性的判断:对于反应性增生还是肿瘤性增生,可用免疫球蛋白(Ig)的轻链抗体检测B淋巴细胞增生的单克隆或多克隆性来区别。
- 确定肿瘤分期:肿瘤分期是判断预后的一个指标,与是否浸润、有无淋巴管或血管侵袭密切相关,而通过免疫组化方法可以判断肿瘤是否浸润、有无淋巴管或血管侵袭。
- 细胞属性的判定:通过特定抗体标记出细胞内相应的抗原成分,来判定细胞的属性,确定肿瘤的来源。
- 确定来源不明的转移瘤的原发部位:对于来源不明的转移瘤,用免疫组化技术有助于确定恶性肿瘤的组织学来源,进一步确定原发部位。如角蛋白抗体(CK20)在胃肠道癌、胆管癌、胰腺癌中阳性,而在肺癌、乳腺癌、肾癌中阴性。
- 对“未分化”恶性肿瘤的分类:未分化恶性肿瘤包括癌或肉瘤,在HE切片上由于肿瘤的“未分化”而缺少肿瘤细胞的起源特征不能分类,初步区分组织学类型用非特异性抗体,在其基础上再选用特异性抗体做进一步鉴定。
- 进一步分类不同器官与组织交界处肿瘤:由于重叠的特征,在一些组织器官交界处的肿瘤,仅凭组织学基础对肿瘤进行分类很困难。如发生于组织交界处的肿瘤有睾丸胚胎癌与精原细胞癌,两者较难区别,且治疗与预后显著不同,但用免疫组化检测角蛋白就较易于区别:角蛋白阴性则为精原细胞癌,而角蛋白阳性则为胚胎癌。
- 及时准确的发现微小转移灶:在常规组织切片中,辨别单个或几个转移性肿瘤细胞很难,淋巴结内窦性组织细胞增生与某些癌的早期转移有时也不易区别,而采用免疫组化方法,有助于及时准确的发现微小(癌)转移灶。
4、病理诊断中免疫组化的局限性
但是,随着免疫组化的广泛应用,发现免疫组化技术存在一些局限性。在肿瘤诊断中评估免疫组化的局限性主要在抗体特异性和解释方面。在免疫组化操作过程中中都必须有适当的阳性与阴性对照,作为技术完整性质量控制,如对照组被忽略或不理想时,免疫组化染色的结果要谨慎对待,免疫组化的正确结果,不仅要依靠技术步骤上规范化操作,而且有赖于正确的解释,在报告免疫组化染色结果时不应孤立地解释,应考虑到诊断与鉴别诊断、所应用的抗体特性、所研究组织性质,同时还要注意假阳性与假阴性结果的干扰。深入研究免疫组化原理和技术,必须熟悉各种抗体真阳性反应部位,实现实验室间免疫组化标准化,使免疫组化在病理诊断中发挥最大的辅助作用。
5、临床上常用免疫组化指标的意义
大家都知道病理检查是临床诊疗的金标准,尤其对于肿瘤患者,更是一封判决书。其中免疫组化(IHC)的结果对肿瘤的诊断和治疗及预后分析尤为重要。本文就目前开展的系列检查及意义进行了整理。
5.1 恶性肿瘤的 Ki-67 和 p53 常规检查
目前的研究表明,大部肿瘤的复发、转移取决于 Ki-67 值和 p53 值,而与肿瘤的组织的分型关系不是十分密切,如中分化腺癌,如果 Ki-67 和 p53 值超过 50%,预后不佳。相反,如肿瘤的组织分型为低分化腺癌,而 Ki-67 和 p53 值较低,预后也会较中分化或高分化癌的预后稍好。
5.2 耐药预后标记全套 4 项:P-gp,GSTπ,TOPOⅡ,Ki-67
P-糖蛋白(P-gp)--药泵作用--胞膜/胞浆--阳性率越高,对下列药物耐药性越强:阿霉素、柔红霉素、表阿霉素、米托蒽醌、长春花碱、长春新碱、紫杉醇及泰素帝。
谷光甘肽 S 转移酶(GST π)--解毒作用--胞浆--阳性率越高,对下列药物耐药性越强:阿霉素、顺铂、氮芥、环磷酰胺及瘤可宁。
拓扑异构酶Ⅱ(TOPOⅡ)--靶点作用--胞核--阳性率越高,对下列药物越有效:蒽环类抗生素和鬼臼毒素类,如 VP-16、替尼泊苷、玫瑰树碱、新霉素、柔红霉素、表阿霉素、阿霉素、VM26。阳性率高者对 VP-16 尤其有效。
Ki-67--细胞增殖标志--胞核--阳性率越高,肿瘤增殖越快,恶性程度越高。
5.3 乳腺癌五项(ER、PR、C-erbB-2(Her-2)、Ki-67、p53)
乳腺癌耐药预后标记,全套 7 项:P-gp,GSTπ,TOPOⅡ,Ki-67,ER,PR,HER2。
雌激素受体(ER)--性激素作用--胞核--阳性率越高,肿瘤对内分泌治疗越有效,预后越好。
孕激素受体(PR)--性激素作用--胞核--阳性率越高,肿瘤对内分泌治疗越有效,预后越好。
C-erbB-2--癌基因产物--胞浆--阳性率越高,肿瘤恶性程度越高。
p53 一种抑癌基因,分野生型(Wtp53)和突变型(Mtp53)。野生型 Wtp53 因微量免疫组化难以检测,突变型 Mtp53 能够被免疫组化测定,突变后则丧失了启动细胞凋亡的能力。突变型 p53 高表达,细胞的高度增生、分化程度差分化、恶性程度越高、预后不良,公认预后差指标之一。
5.4 垂体腺瘤功能六项检查
LH(促黄体生成素),FSH(卵泡刺激素),ACTH(促肾上腺皮质激素),TSH(促甲状腺素),PRL(泌乳素)、GH(生长激素)。根据某一种抗体阳性表达进行术后药物治疗。
5.5 GIST(胃肠道间质瘤)诊断
GIST 特征性表达 CD117(95%)
GIST 特征性表达 DOG1,DOG1 阳性表达部位与 CD117 相似
- DOG1 可以表达于部分 CD117 阴性的 GIST 中(6%)
- DOG1 在胃部 GIST、上皮样 GIST、PDGFRA 突变的病例中,表达率高
大多数表达 CD34(70%)、局灶性表达 SMA(40%)、S-100 蛋白(5%)、通常不表达 desmin(2%)。
标准免疫组化染色套餐是:CD117、DOG1、CD34、SMA、S-100和Desmin。可依据组织形态表现,添加需要的鉴别染色抗体。
5.6 淋巴瘤的 WHO 分型
淋巴瘤 WHO 最新分型有 33 个亚型,每个亚型的预后和治疗方案均有所不同,而淋巴瘤的诊断和分型又是极其困难的,是病理中的难中之难,所以诊断淋巴瘤的免疫组化方案必须「双份套餐式」的,即每一种组织的标记物必须用 2 种以上的抗体。
诊断 B 细胞淋巴瘤,必须有 CD20 和 CD79a 阳性正面证实,同时还需要用 CD3 阴性反面来证实,因此诊断淋巴瘤需 8-10 种左右的抗体,才能准确地反应出淋巴瘤各种亚型的信息。














