战疫时刻|CD147—另一个新冠病毒入侵的关键靶点
日期:2020-03-30 17:23:53
截至2020年3月30日,新冠病毒已肆虐了近200个国家和地区,全球累计确诊超过70万人,死亡人数超过3万人。此前,国内外研究发现,SARS-CoV-2和SARS-Cov可通过相同的受体ACE2入侵人体,而且是SARS-CoV-2入侵人体的主要途径。而最近,随着新冠肺炎各项研究的逐步深入与展开,3月14日,第四军医大学陈志南研究团队报道了第二条新冠病毒入侵途径——即SARS-CoV-2通过CD147新途径侵入宿主细胞。该研究发表在预印版平台BioRxiv上,论文题目为“SARS-CoV-2 invades host cells via a novel route: CD147-spike protein”。那CD147到底是什么?又是怎样成为新型冠状病毒入侵人体的靶点的呢?
1. 什么是CD147?
免疫球蛋白超家族(IgSF)由具有至少一个Ig结构域的蛋白质组成,在细胞间通讯中起重要作用。CD147,也称为Basigin或EMMPRIN,是一种高度糖基化的单次跨膜蛋白,相对分子质量为50kDa-60kDa,属于免疫球蛋白超家族。根据CD147来源不同,对其命名也有所不同,在人体内被称为basigin、白细胞活化相关M6抗原、肝癌细胞抗原Hab18G;在小鼠中被称为basigin或gp42;在大鼠中被称为OX47;在鸡中被称为HT7或neurothelin。
CD147可识别同一细胞中的分子,尤其是同一膜中的分子(顺式识别)和位于细胞外的分子(反式识别)。如Figure 1所示,在顺式识别中,BSG或BSG1(CD147的两种亚型)可与同一细胞(尤其是同一膜)中的蛋白结合,比如GLUT1和CD44;在反式识别中,GPV1和RdCVF可与BSG或BSG1结合 [1] [2]。
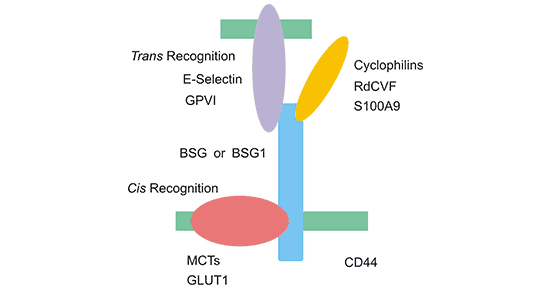
Figure 1. The two manners of recognizing various molecules of BSG or BSG1
2. CD147的结构与亚型
CD147分子属于单次跨膜糖蛋白,基因定位于19p13.3处,由10个跨度约为12kb的外显子组成。从克隆的cDNA序列得知CD147分子的mRNA长度大约1.7kb,N端起始之前有约115个核苷酸为非编码区,编码区编码269个氨基酸,21个氨基酸为信号肽,中间185个氨基酸构成胞外结构域,从206-229共24个氨基酸为跨膜区,该跨膜区域在物种之间和BSG家族成员之间高度保守 [3][4]。C端39个氨基酸为胞内结构域,跨膜区包括3个亮氨酸和一个苯丙氨酸,且每隔7个氨基酸出现一次,为典型的亮氨酸拉链结构。
CD147分子在人类有两种亚型(Basigin-1和Basigin-2),这是由剪接不同和转录起始位点不同导致的。如Figure 2所示,Basigin-1(BSG1)具有三个Ig域,是视网膜特异性形式。 Basigin-2(BSG2)是常见形式,具有两个Ig域,由于其分布广泛,因此我们通常也将BSG2简称为BSG。Ig结构域分为V区,C1和C2区及I区。I区通常位于V和C区之间。 相关研究通过X射线晶体学和NMR光谱法确定BSG细胞外部分的空间结构 [5][6]。BSG的Ig域分配如下:D0,I区; D1,C2区; D2,I区。
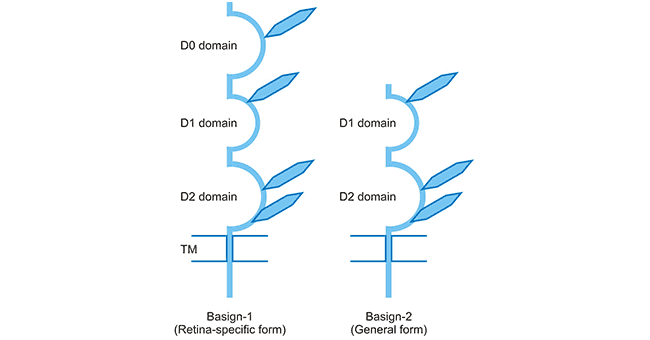
Figure 2. Schematic presentation of two BSG isoforms
3. CD147的功能?
CD147在体内分布非常广泛,同种基因产生的不同类型的CD147是由于不同形式的糖基化所致,而异源基因的CD147则是由于编码其DNA中N端序列不同所致。存在于机体不同系统中的CD147能够参与各种不同的生理过程中并具有多种不同的生理功能。
研究发现CD147分子表达于许多正常细胞类型,包括成体和胚胎组织,而且表达量各有差异。但EMMPRIN/CD147表达于各种肿瘤组织,尤其是恶性肿瘤,如乳腺癌、肺癌、肾癌、淋巴瘤等,而且表达比相应正常组织明显要高。肿瘤细胞EMMPRIN可刺激成纤维细胞产生MMPs,比如MMP-1、MMP-2、MMP-3和MMP-9。而且,这些有间质细胞产生的MMPs在体内可大大加速肿瘤进展 [7]。
在中枢神经系统中,CD147通常被称为neurothelin,主要表达与血脑屏障内皮细胞、脉络膜上皮细胞和视网膜色素上皮细胞,是血脑屏障形成的标志之一,该基因的表达与中枢神经系统内皮细胞的成熟是一致的,与人体正常血脑屏障的功能相关。因为血脑屏障形成中枢神经系统与身体免疫系统的解剖屏障,neurothelin可能参与了细胞的识别。另外CD147分子可参与神经元与神经胶质细胞的相互作用 [8]。
此外,相关研究表明,CD147在表皮细胞基底层、毛囊外根鞘细胞、精子头部、血液系统、消化系统及泌尿系统中也有表达。所以,CD147不仅与肿瘤的发生发展密切相关,还参与了组织重建、淋巴细胞应答、精子发生、病毒感染和发育早期神经系统功能调节。在Figure 3中我们汇总了CD147生物学功能及对应的相互作用分子。
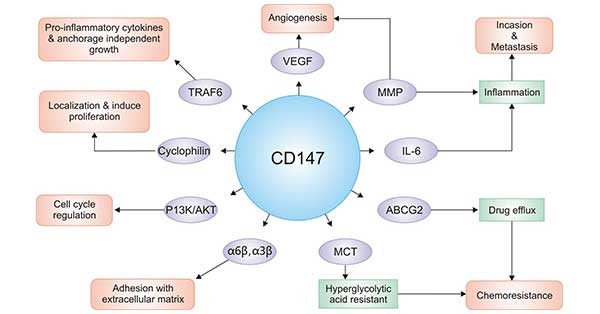
Figure 3. The collection of CD147 biological function
4. 病毒是如何通过CD147侵入人体?
CD147在多种病毒对人体的感染过程中起到重要的作用,如HIV、HBV、HCV、KSHV等。相关研究表明,在HIV-1感染宿主细胞过程中,宿主细胞的对环亲和素A(CyPA)通过与HIV-1 Gag蛋白的相互作用掺入新生病毒,并随着病毒的成熟到Gag蛋白释放,重新分布于病毒的表面,并通过与宿主细胞表达的蛋白受体相互作用,介导HIV-1对靶细胞的黏附,这一作用使HIV-1外膜糖蛋白(gp120/gp41)与宿主细胞上的CD4及趋化因子受体相结合,从而促进病毒与细胞膜的融合,最终导致病毒对宿主细胞的入侵感染。宿主细胞的CD147分子可通过与病毒相关的CyPA相互作用促进HIV-1病毒对宿主细胞的感染。
在严重急性呼吸器官综合征(SARS)冠状病毒入侵宿主细胞过程中,CD147分子可通过与CyPA的相互作用介导与其在HIV-1入侵中类似的作用机制。而CD147-拮抗肽9与HEK293细胞的结合率高,对SARS-CoV具有抑制作用。由于SARS冠状病毒和新冠病毒具有相似的特征,陈志南研究团队对CD147在后者侵袭宿主细胞中的可能作用进行了研究。实验表明,在宿主细胞上阻断CD147对新冠病毒具有抑制作用,而且CD147在促进该病毒对宿主细胞的侵袭中起重要作用。另外,表面等离子体共振分析则证实了CD147和S蛋白(SP)的相互作用 [9]。
5. CD147与疾病
CD147是广泛存在于细胞膜表面的一种跨膜糖蛋白,隶属于免疫球蛋白超家族,可通过与多种因子结合,广泛参与体内正常的生理代谢和疾病的病理生理过程。在这部分我们集中阐述了几个研究比较热的与CD147相关的疾病。
5.1 CD147与恶性肿瘤
CD147在多种恶性肿瘤中均呈现高水平表达,在肿瘤的发生发展中,CD147通过诱导基质金属蛋白(MMPs)的产生,实现对肿瘤生长、浸润及转移的促进作用。而肿瘤的发生发展是一个动态过程,涉及肿瘤微环境(TM)的不同细胞和非细胞成分相互作用 [10]。
恶性肿瘤细胞浸润及转移需要跨越基底膜和组织间隙机制,而CD147的高表达可使MMPs表达及活性增加,从而降解基底膜的组要成分,破坏组织的机械屏障,促进肿瘤的浸润和转移。CD147对于MMPs的作用可通过激活MMPs或MMPs激活剂来完成。CD147通过与α3β1、α6β1形成复合物,参与细胞与基质的黏附,促进恶性肿瘤细胞的扩散转移。此外通过CD147细胞内C端结构的改变,影响细胞内骨架蛋白的聚集和解聚,参与细胞的运动及伪足的形成 [11]。
5.2 CD147与急性肾损伤
据统计,急性肾损伤(AKI)占住院患者的1-2%,而进入重症监护病房的患病率超过40%,ICU 中AKI和多器官功能衰竭患者的死亡率超过50%。而AKI的机制目前尚不清楚。此前有研究在盲肠结扎和穿刺(CLP)诱导的器官功能障碍中通过差异凝胶电泳(DIGE)证实,CLP和败血症诱发的肾功能不全后,CyPA含量增加,但注射CD147抗体后CyPA含量降低, 表明CyPA的受体被腹膜内抗CD147抗体抑制。此外,CLP后24小时血清TNF-α、IL-6和IL-10浓度显着降低,这表明注射CD147抗体显着降低了促炎和抗炎性细胞因子的产生。这也证实了抗CD147可以预防AKI [12]。
多项研究表明,细胞外CyPA可通过CD147发挥促炎作用,而抗CD147抗体则具有抗促炎作用(Figure 4)。CyPA-CD147相互作用对炎症过程的病理生理相关性已经在许多动物模型中进行了研究。对类风湿关节炎患者的滑膜巨噬细胞的研究发现,可以检测到CyPA和CD147的表达,而且刺激CD147可诱导MMP-9和促炎性细胞因子的产生,并促进巨噬细胞的细胞迁移。所以,在胶原诱导的关节炎模型中,抗体阻断CD147和CyPA之间的相互作用可明显减轻关节炎症状 [13]。
然而,就缺血性肾损伤而言,CD147可能是疾病进程中的一把双刃剑,因为CD147上调可增加MMP的产生并诱导缺血组织中白细胞适应,进而破坏组织 [14]。有研究发现CD147与E-选择素相互作用,可通过增加中性粒细胞向肾小管间质的适应性来促进肾缺血/再灌注损伤中的肾发炎。
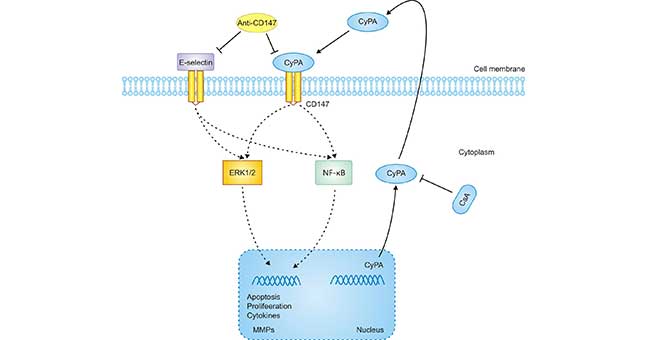
Figure 4. A proposed mechanism implicated in CyPA/CD147-mediated cell response in AKI
5.3 CD147与其他疾病
如前所述,作为一个高度糖基化的跨膜粘附分子,CD147在许多生理病理过程中发挥重要作用。最新研究表明,氧化型低密度脂蛋白能够促进血小板中CD147表达,而CD147能够通过MMPs降解细胞外基质,进而导致动脉粥样硬化斑块破裂或不稳定。这为CD147分子在心血管疾病中的角色扮演奠定了理论基础。在人类子宫内膜上皮细胞的相关研究中发现,子宫内膜异位患者体内CD147水平高于正常水平,WB结果显示在含CD147抗体的实验组中,参与细胞凋亡的Bax及Caspase3明显上调,导致子宫内膜上皮细胞凋亡增加和细胞活力下降。此外,在兔的液压损伤模型中发现,脑组织受伤区域CD147含量明显升高、MMP9表达增加,这表明CD147在创伤性脑损伤后的炎症反应中具有重要作用。
CD147蛋白
Recombinant Human Basigin(BSG),partial (Active) (Code: CSB-MP002831HU1)

(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
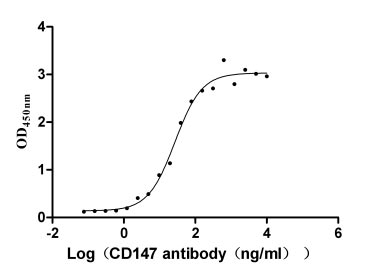
Immobilized CD147 at 2 μg/ml can bind Anti-CD147 recombinant Antibody, the EC50 is 21.95-33.12 ng/ml.
References
[1] Miyauchi, T., Kanekura, T., et al. Basigin, a new, broadly distributed miber of the immunoglobulin superfamily, has strong homology with both the immunoglobulin V domain and the b-chain of major histocompatibility complex class II antigen [J]. J. Biochi. 1990, 107, 316-323.
[2] Takashi Muramatsu. Basigin (CD147), a multifunctional transmibrane glycoprotein with various binding partners [J]. J. Biochi. 2016, 1-10.
[3] Curtin, K.D., Meinertzhagen, I.A., and Wyman, R.J. Basigin (iMPRIN/CD147) interacts with integrin to affect cellular architecture [J]. J. Cell Sci. 2005, 118, 2649-2660.
[4] Miyauchi, T., Masuzawa, Y., and Muramatsu, T. The basigin group of the immunoglobulin superfamily: complete conservation of a segment in and around transmibrane domains of human and mouse basigin and chicken HT7 antigen [J]. J. Biochi. 1991, 110, 770-774.
[5] Schlegel, J., Redzic, J.S., et al. Solution characterization of the extracellular region of CD147 and its interaction with its enzyme ligand cyclophilin A [J]. J. Mol. Biol. 2009, 391, 518-535.
[6] Redzic, J.S., Armstrong, G.S., et al. The retinal specific CD147 Ig0 domain: from molecular structure to biological activity [J]. J. Mol. Biol. 2011, 411, 68-82.
[7] Lijuan Xiong, Carl K. Edwards, et al. The Biological Function and Clinical Utilization of CD147 in Human Diseases: A Review of the Current Scientific Literature [J]. Int. J. Mol. Sci. 2014, 15.
[8] Dana P, Saisomboon S, et al. CD147 augmented monocarboxylate transporter-1/4 expression through modulation of the Akt-FoxO3-NF-κB pathway promotes cholangiocarcinoma migration and invasion [J]. Cell Oncol (Dordr). 2019 Nov 15.
[9] Ke Wang, Wei Chen, et al. SARS-CoV-2 invades host cells via a novel route: CD147-spike protein [J]. BioRxiv.
[10] Alexandra Landras, Coralie Reger de Moura, et al. CD147 Is a Promising Target of Tumor Progression and a Prognostic Biomarker [J]. Cancers (Basel).2019, 11(11).
[11] Fei F, Li S, et al. The roles of CD147 in the progression of gliomas [J]. Expert Rev Anticancer Ther. 2015, 15(11):1351-9.
[12] X i n Qu, Chunting Wang, et al. The Roles of CD147 and/or Cyclophilin A i n Kidney Diseases [J]. Mediators Inflamm.2014, 2014():728673.
[13] J. Y. Kim, W. J. Kim, et al., The stimulation of CD147 induces MMP-9 expression through ERK and NF-kappaB in macrophages: implication for atherosclerosis [J]. Immune Network. 2009, 9(3):90–97.
[14] X. Zhu, Z. Song, et al. CD147: a novel modulator of inflmmatory and immune disorders [J]. Current Medicinal Chiistry. 2014, 21(19): 2138–2145.
上一篇: 免疫组化与病理诊断
下一篇: SARS-CoV-2入侵人体潜在靶点汇总











