肿瘤免疫治疗新兴靶点ROR1,究竟有多大潜力?
日期:2022-04-26 10:56:08
2020年10月29日,基石药业宣布与LegoChem Biosciences公司达成一项授权协议,获得在韩国以外地区开发和商业化LCB71的独家授权。LCB71是一款靶向ROR1的抗体偶联药物(ADC),合作金额总计可超过3.6亿美元。目前该ADC药物正处于临床I期。无独有偶,一周后,11月5日,默沙东(MSD)公司和VelosBio公司联合宣布,双方已达成协议,默沙东将斥资27.5亿美元收购VelosBio公司。VelosBio公司是一家致力于开发靶向受体酪氨酸激酶样孤儿受体1(ROR1)的“first-in-class”抗癌疗法的生物医药公司。其主打在研产品VLS-101是一款靶向ROR1的抗体偶联药物(ADC),目前正分别在一项2期临床试验和一项2期临床试验中用于治疗血液癌症和实体瘤。那ROR1究竟是什么?该靶点为何会如此受默沙东和基石药业的青睐?让我们带着这两个问题阅读完这篇文章,这篇文章包含以下几个部分:
1、什么是ROR1?
ROR1是受体酪氨酸激酶样孤儿受体(ROR)家族成员之一,属于I型受体酪氨酸激酶(receptor tyrosine kinase, RTK)家族。与核受体中的ROR家族不同,ROR是一类膜受体。它们与家族中的原肌球蛋白激酶受体家族(tropomyosin-related kinase, Trk)、骨骼肌特异性酪氧酸激酶样受体家族(muscle specific knase, MuSK)和神经营养因子酯氨酸激酶受体家族(neurotrophic tyrosine kinase receptor, NT-RTK)关系密切,由于ROR蛋白最初发现时配体未知,所以被定义为孤儿受体 [1]。
ROR家族的另一个成员是ROR2,ROR1与ROR2氨基酸序列的同源性达58%。其中ROR1又含有2种亚型:完整的细胞膜受体型ROR1以及截短型变异体。截断型变异体主要分为无胞外结构的膜结合型ROR1I与只含胞外结构的可溶型ROR1 [2]。可溶型ROR1的表达在正常人与肿瘤患者中并无差异,血清中的表达量很低或者检测不到,且与疾病的进展和严重程度无关,而完整结构的膜结合型ROR1在多种肿瘤组织特异性高水平表达 [3]。后文中所提到的ROR1都是指完整结构的膜结合型ROR1。
2、ROR1的结构与功能
ROR1是一种跨膜受体酪氨酸激酶蛋白。ROR1编码基因共2814bp,位于染色体1p31.3。ROR1膜蛋白由937个氨基酸组成,分子量约105 kDa。ROR1结构在生物种间高度保守,如人与鼠的ROR1氨基酸序列同源性可达97%。如图1所示,人源ROR1由一个胞外的免疫球蛋白样结构域(Ig)、两个富含半胱氨酸的结构域(FZD)、近膜kringle结构域、单次跨膜结构以及一个胞内酪氨酸激酶结构域(TKD)、两个丝/苏氨酸富集结构域(S/TRD)和一个脯氨酸富集结构域(PRD)组成 [4]。
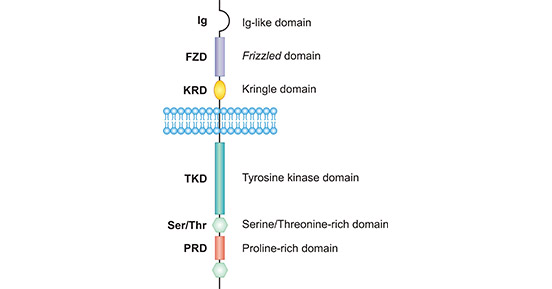
图1. The structure of ROR1
*图片参考文献发表在Protein Cell上[4]。
免疫球蛋白样结构域和半胱氨酸富集结构域与ROR1结合配体的功能相关。其中FZD结构域由10个保守的半胱氨酸残基和5个相应的二硫键组成。FZD结构还见于平滑肌家族受体(如Smo)、卷曲家族受体(如sFRP)、金属羧肽酶Z(CPZ)、collagen α1 XVIII和低密度脂蛋白受体相关蛋白 (LRP)。这些蛋白大都可以结合Wnt蛋白并参与Wnt通路的信号转导。目前大量研究己经证实ROR1也是通过FZD结合Wnt5a并激活非经典Wnt信号通路 [5] [6]。 Kringle结构域在ROR家族中比较保守,由80个氨基酸组成 [7]。其结构特点是含有三个由二硫键形成的环状结构,这三个环状结构也参与了ROR受体识别Wnt蛋白的过程。
ROR的酪氨酸激酶结构域在生物体高度保守,和Trk、MuSK的酪氨酸激酶结构域极其相似。但ROR1蛋白在这段高度保守的区域内存在某些氨基酸序列的改变,提示其胞内激酶活性有可能发生改变。丝/苏氨酸、脯氨酸富集结构域是由丝/苏氨酸富集结构域、脯氨酸富集结构域、丝/苏氨酸富集结构域三个结构域串联而成。该区域存在潜在的磷酸化位点、与下游信号传导有关。
3、Wnt5a/ROR1与肿瘤
目前关于ROR1信号传导的主流说法是,ROR1可通过介导非经典Wnt信号通路(non-canonical Wnt pathways)的信号传递,在多种生理过程中发挥重要作用,其中包括调节细胞分裂、增殖、迁移、和细胞趋化,尤其是Wnt5a。Wnt5a是典型的非经典Wnt信号通路的激活因子,参与NF-κB亚基p65的磷酸化,激活肿瘤细胞中NF-κB通路,促进细胞迁移和侵袭,EMT、癌转移等。接下来,我们具体了解下ROR1是如何通过Wnt5a信号通路激活肿瘤细胞的。
Wnt5a/ROR1在多种癌症中的高度表达。作为Wnt5a的受体,ROR1参与激活肿瘤细胞NF-κB通路。NF-κB通路是炎症反应和免疫调控的掌舵者,在多种肿瘤类型中组成性激活。如图2所示,Wnt5a激活受体ROR1或FZD5,导致Dvl2/3激活和Akt磷酸化。Akt继而促进IKKα磷酸化激活IKK复合体,IKK复合体负责IκBα降解和NF-κB亚基p65的磷酸化。磷酸化的p65转移到细胞核促进包括Wnt5a在内的靶基因转录表达。Wnt5a的分泌又促进新一轮的自主反馈循环。自主反馈循环ROR1/Akt/p65通路的激活会进一步促进促炎因子(如IL-6)和趋化因子(如CCL2)的分泌。
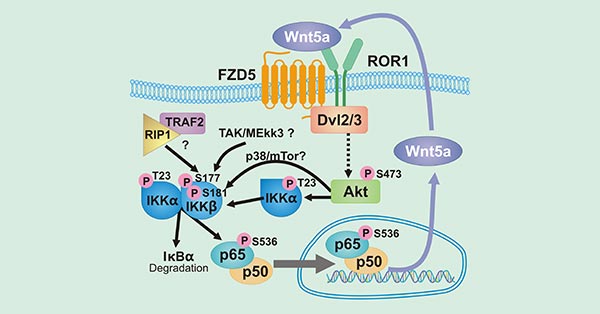
图2. The diagram of Wnt5a/ROR1 signaling
此外,有多项研究已将ROR1的表达与YAP / TAZ转录的激活相关联,从而增强肿瘤发生和化学耐药性 [8] [9]。如图3所示,Wnt5a与ROR1 / FZD复合物的结合,然后通过结合Gα12/13进一步激活RhoA,从而抑制Lats1/2活性,进而导致YAP / TAZ去磷酸化和核易位。易位到细胞核里的YAP/TAZ与TEAD结合后可以诱导涉及细胞增殖、干细胞自我更新和肿瘤发生基因的转录。增加的YAP/TAZ转录反过来又可以上调ROR1表达。
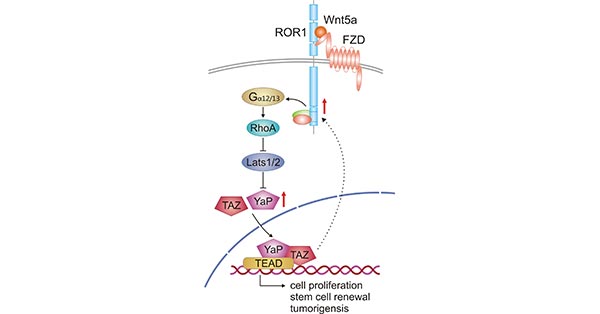
图3. Crosstalk between Wnt5a-ROR1 signaling and YAP/TAZ pathway
*图片参考文献发表在Cells上[10]。
4、靶向ROR1的临床意义
ROR1被认为是个非常有潜力的靶点,因为它作为酪氨酸激酶受体,具有可药性;其次,它在细胞表面表达;更重要的是,它在肿瘤细胞中高度表达,而在成人健康组织中表达量很低。目前有多家公司在开发靶向ROR1的抗癌疗法,其中包括单克隆抗体、抗体偶联药物(ADC)、双特异性抗体、以及CAR-T疗法等多种治疗模式(见下表)。免疫检查点疗法(ICT)已经改变了许多肿瘤的治疗模式,然而有些肿瘤类型对ICT的响应率低,这大部分要归因于TME中高度的免疫抑制和肿瘤缺少T细胞浸润。在这种情况下,采用ICT联合靶向ROR1/Wnt5a的疗法有可能能解决响应率低的问题。
| 药物名称 | 药物类型 | 研发公司 | 适应症 | 研发状态 |
|---|---|---|---|---|
| NBE-002 | ADC | NBE-Therapeutics AG | 实体瘤、三阴性乳腺癌 | 临床II期 |
| NVG-111 | 双特异性抗体 | Novalgen Ltd. | B细胞慢性淋巴细胞白血病 套细胞淋巴瘤 非霍奇金淋巴瘤 |
临床II期 |
| Zilovertamab vedotin | ADC | MSD R&D (China) Co. Ltd. | 乳腺癌 非小细胞肺癌 三阴性乳腺癌 |
临床II期 |
| LCB-71 | ADC | CStone Pharmaceuticals Co. Ltd. | 淋巴瘤 实体瘤 血液肿瘤 |
临床I期 |
| ROR1R-CAR | CAR-T | The University of Texas M.D. Anderson Cancer Center | 白血病 | 临床I期 |
| LYL-797 | CAR-T | Lyell Immunopharma, Inc. | 肿瘤 | 临床申请 |
| huXBR1-402-G5-PNU | ADC | NBE-Therapeutics AG | 白血病 | 临床前 |
| ROR1 x CD3 DART | 双特异性抗体 | MacroGenics, Inc. | 肿瘤 | 临床前 |
| TRS-006 | 双特异性抗体 | Zhejiang Teruisi Pharmaceutical Inc. | 肿瘤 | 临床前 |
| APVO-425 | 双特异性抗体 | Emergent BioSolutions, Inc. | 三阴性乳腺癌 | 临床前 |
| NM32-2668 | 双特异性抗体 | Numab Therapeutics AG | 肿瘤 | 临床前 |
| ROR1 Bispecific | 双特异性抗体 | Aptevo Therapeutics, Inc. | 血液肿瘤 | 临床前 |
| huXBR1-402-G5-PNU | ADC | NBE-Therapeutics AG | 急性淋巴细胞白血病 B细胞慢性淋巴细胞白血病 套细胞淋巴瘤 |
临床前 |
| ROR1 CAR-T | CAR-T | Oncternal Therapeutics, Inc. | 血液肿瘤 | 临床前 |
| cirmtuzumab-ADC-7 | ADC | VelosBio, Inc. | 肿瘤 | 临床前 |
| ELN-11 | ADC | Elasmogen Ltd. | 肿瘤 | 临床前 |
*表格数据来源于公开资料
为鼎力协助各药企针对ROR1靶点在白血病和肿瘤等药物方面的研发工作,CUSABIO推出ROR1活性蛋白产品(Code: CSB-MP020067HU1d7),助力您在ROR1机制方面的研究或其潜在临床价值的探索。

Greater than 95% as determined by SDS-PAGE.
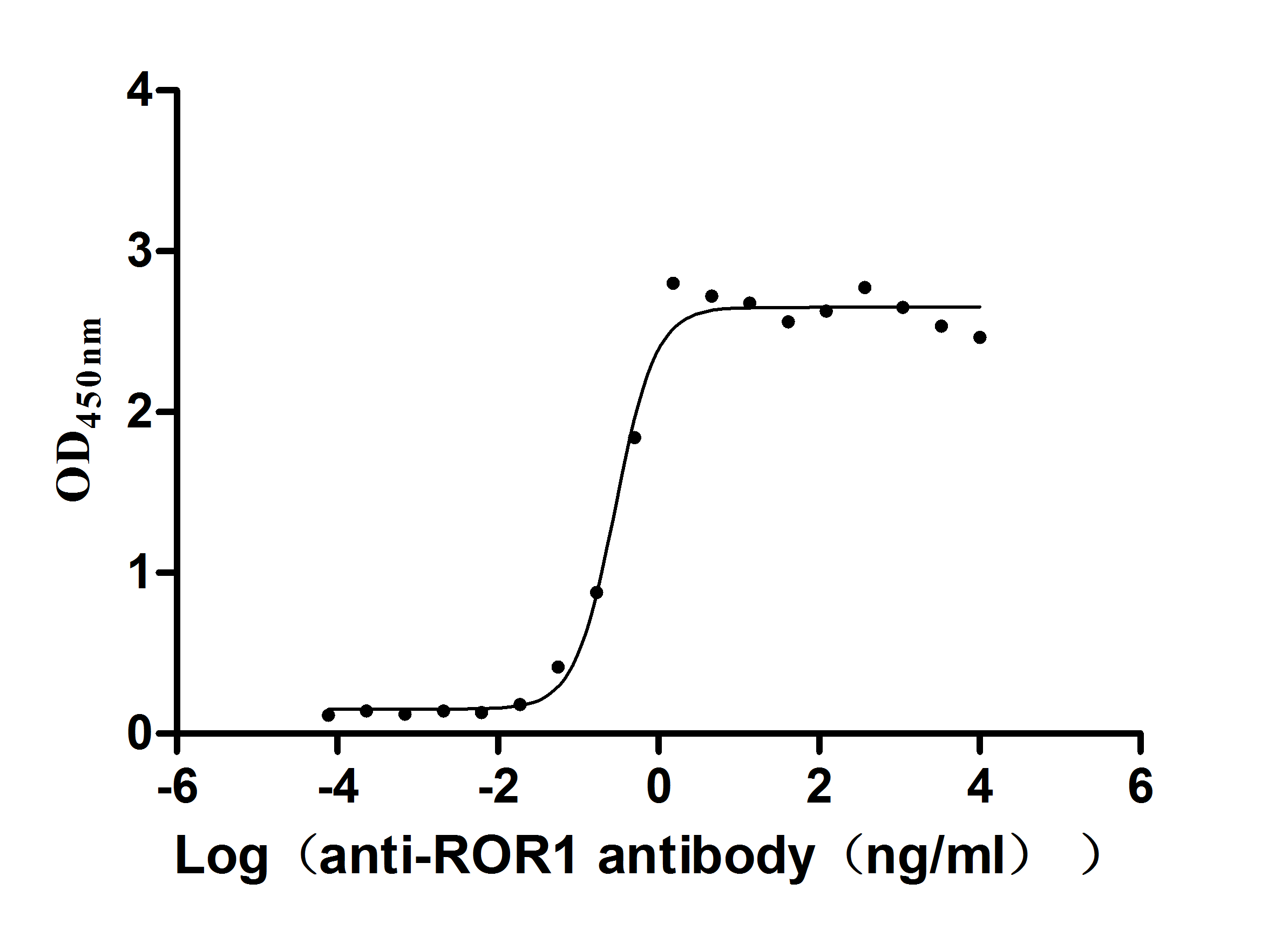
Immobilized ROR1 at 2 μg/ml can bind anti-ROR1 antibody (CSB-RA020067A1HU), the EC50 is 0.2450-0.3416 ng/mL.
参考文献:
[1] Forrester WC. The Ror receptor tyrosine Kinase family [J]. CMLS Cell Mol Life Sci. 2002, 59:83-06.
[2] Boreherding N, Kusner D, Liu GH, et al. ROR1, an embryonic protein with an emerging role in cancer biology [J]. Protein Cell. 2014, 5:496-502.
[3] Baskar S, K wong KY, .Hofer T, et al. Unique cell surface expression of receptor tyrosine kinase ROR1 in human B-cell chronic lymphocytic leukemia [J]. Clin Cancer Res. 2008, 14:396-404.
[4] Nicholas Borcherding, David Kusner, Guang-Hui Liu, et al. ROR1, an embryonic protein with an emerging role in cancer biology [J]. Protein Cell. 2014, 5(7):496–502.
[5] Mikels AJ, Nusse R. Purified Wnt5a protein activates or inhibits β-catenin–TCF signaling depending on receptor context [J]. PLoS Biol. 2006, 4:e115.
[6] Nomi M, Oishi I, Kani S, et al. Loss of mRor1 enhances the heart and skeletal abnormalities in mRor2-deficient mice: redundant and pleiotropic functions of mRor1 and mRor2 receptor tyrosine kinases [J]. Mol Cell Biol. 2001, 21:8329–8335.
[7] Wamg HY, Lie T, Malbon CC, et al. Structure-function analysis of Frizzleds [J]. Cell Signal. 2006, 18: 934-941.
[8] Zhang, S., Zhang, H., Ghia, E.M., et al. Inhibition of chemotherapy resistant breast cancer stem cells by a ROR1 specific antibody [J]. Proc. Natl. Acad. Sci. USA. 2019, 116, 1370–1377.
[9] Islam, S.S., Uddin, M., Noman, A.S.M., et al. Antibody-drug conjugate T-DM1 treatment for HER2+ breast cancer induces ROR1 and confers resistance through activation of Hippo transcriptional coactivator YAP1 [J]. EBioMedicine. 2019, 43, 211–224.
[10] Hanna Karvonen, Harlan Barker, Laura Kaleva, et al. Molecular Mechanisms Associated with ROR1-Mediated Drug Resistance: Crosstalk with Hippo-YAP/TAZ and BMI-1 Pathways [J]. Cells. 2019, 8, 812: 2-12.











