CD69:淋巴细胞活化最早表达的分子,作为多向性调控者参与血液和自身免疫疾病!
日期:2023-05-24 09:51:03
近日,《Theranostics》杂志在线发表了题为HSF1 promotes CD69+Treg differentiation to inhibit colitis progression的研究论文 [1]。研究发现,CD69在维持Treg免疫抑制功能中起重要作用,Treg中敲低CD69容易诱发炎症性肠病等自身免疫性疾病。此外,HSF1通过激活CD69转录促进CD69+Tregs分化,这对Tregs的免疫抑制功能至关重要。尤其是对于治疗自身免疫性疾病的患者来说,通过增加CD69+Treg的数量将有望缓解疾病症状,改善病情进展。
CD69作为淋巴细胞活化最早表达的分子,也就是当免疫系统激活时,CD69成为最早的信号,调节T细胞、B细胞、自然杀伤细胞等多种免疫细胞的功能,因此,CD69被认为是一种多向性调控者,在免疫系统中发挥着重要的作用。越来越多的研究表明,CD69在血液和免疫疾病中发挥重要的调节作用。那么,CD69更多的生物学功能是怎样的?它在免疫调节中的机制是如何?带着疑问,让我们去一起了解探索。
1. 什么是CD69?
1.1 CD69的结构
CD69(又称AIM,EA-1,Leu23和MLR-3)是淋巴细胞活化最早表达的膜表面分子。人CD69是由199个氨基酸组成的完整的II型跨膜糖蛋白 [2],包括40个残基的细胞内区,21个残基的跨膜区和138个残基的细胞外区。细胞外区有C-型凝集素(Ca2+依赖性糖基识别区域(CRD)),CD69亦属于C-型凝集素受体家族 [3-4]。细胞内的末端Ser/Thr通常被磷酸化,CD69与CD23、CD72有相同性 [3-4]。CD69又属于NK细胞特异的遗传因子复合体,不同的是,NKR-P1、Ly-49与NKG2分子只表达在NK细胞上,而CD69可在多种细胞上表达,说明CD69有多种特性 (图1) [2]。
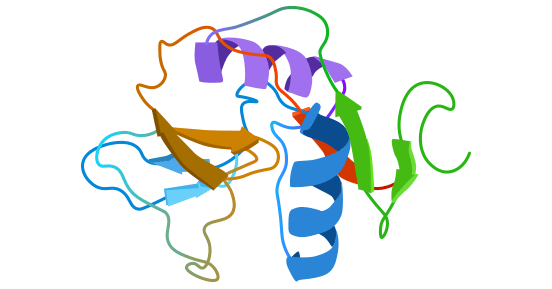
图1. CD69结构示意图 [2]
1.2 CD69的表达及功能
CD69是淋巴细胞激活后最早表达的表面抗原,后来发现经诱导后它几乎可在所有的血细胞上表达。CD69可诱导表达在T细胞、B细胞、NK细胞、单核细胞、中性和嗜酸性粒细胞、胸腺细胞等。CD69这种仅在细胞活化后表达的特性,使其成为细胞活化的标记分子。例如,T细胞活化标志分子,具有代表性的:IL-2受体CD25、转铁蛋白受体CD71、CD69,而CD69是表达最早的分子 [5-7]。
CD69也可作为细胞共刺激信号,如CD69+T细胞伴随IL-12β、IL-18α和IL-16β mRNA水平增高,并在重组IL-12或IL-18的作用下,促进干扰素-γ(interferon-γ,IFN-γ)的产生。近年研究揭示CD69在促进细胞活化的同时,还可能与细胞的凋亡密切相关 [8-9]。虽然CD69的配体还未明确,有研究提示CD69可能与Galectin-1(Gal-1)结合调控Th17(图2) [8]。总之,CD69交联可产生细胞内信号传导及多种免疫反应,对造血细胞的生物学功能有广泛的作用。
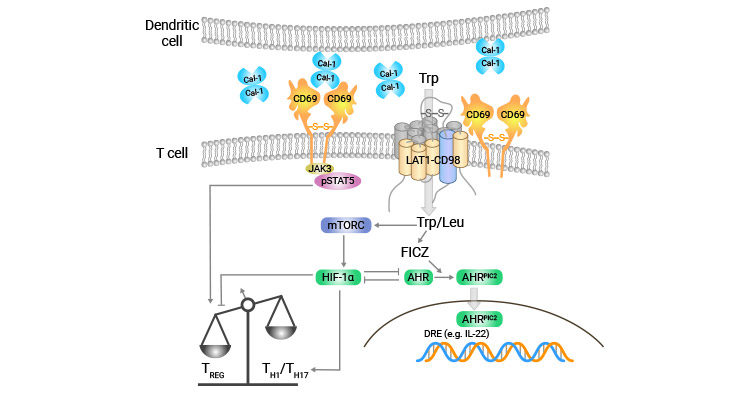
图2. CD69可能与Galectin-1(Gal-1)结合调控Th17 [8]
2. CD69在细胞活化和凋亡中的双向免疫调节机制
CD69是一个多向性的免疫调节分子,对多种造血细胞的活化和分化具有重要作用。CD69自被发现后,初始研究基本上是关于CD69在细胞活化中的作用。近年来发现,CD69在T细胞凋亡中亦有重要作用。CD69介导细胞活化和细胞凋亡的分子机制仍不明确。
2.1 CD69和细胞活化
静止状态的T细胞不表达CD69,但当T细胞受抗CD3/TCR(T cell receptor,TCR)、CD2、CD28、蛋白激酶C(PKC)的激活物PMA、PHA等刺激活化后可诱导性表达CD69。
在CD69介导的T细胞活化中CD3/TCR复合体是必要的(图3) [10]。PMA通过激活GTP连接和Ras蛋白参与了细胞内的信号传递,这对于T细胞上CD69的表达起到了核心作用。
图3. CD69介导的T细胞活化中CD3/TCR复合体是必要的 [10]
NK细胞在静止状态也不表达CD69,当IL-2、IL-7、IL-12、IFNA、PMA和CD16交联可使NK细胞活化,诱导CD69的表达 [10-11]。多种不同信号转导中的蛋白激酶 C(protein kinase C,PKC)和蛋白酪氨酸激酶(protein tyrosine kinase,PTK)参与其中 [10-11]。CD69启动的NK细胞细胞毒活性受CD94的调节 [12];另有报道CD69能活化细胞外信号调节激酶ERK,而CD69启动的ERK活化受CD94/NKG2-A抑制性受体的负调节 [13]。
对脾脏和淋巴结中的B细胞,脂多糖(Lipopolysaccharide,LPS)可诱导其CD69分子表达;对外周血液中嗜酸性粒细胞EOS,体外IL-2、IL-3、IL-5、IL-13、GM-CSF、IFN-γ可诱导CD69表达 [14-15]。
2.2 CD69和细胞凋亡
CD69在体内与细胞的凋亡密切相关。在体内活化的具有CD69高表达的T细胞,在体外易于快速自发凋亡。与死亡受体CD95相比,CD69介导的凋亡有其自己的特点。CD95介导的凋亡几乎涉及所有细胞类型,而明确可由CD69介导的凋亡细胞为T细胞、活化的嗜酸性粒细胞EOS和单核细胞。
研究提示CD69介导的单核细胞凋亡与3个不同的信号通路相关:1)依赖于NO;2)与磷脂酶A2/磷脂氧化酶级联反应相关;3)受百日咳毒素(PTX)敏感的G蛋白影响;4)CD69介导TGF-β合成 [16]。
Caspase是一类在细胞凋亡过程中起关键作用的分子。EOL-1株EOS在CD45、CD45R、CD45RB、CD95、CD69单抗培养后,凋亡增加,caspase-8和caspase-9抑制剂可抑制单抗诱导的凋亡;CD69交联可诱导caspase-3、caspase-8激活。抗CD69单抗可诱导EOS凋亡及bcl-2表达下降,但在粒细胞-巨噬细胞集落刺激因子GM-CSF存在,胞内bcl-2浓度不变时,CD69单抗可诱导GM-CSF培养的CD69+细胞凋亡,bcl-2表达下降,提示CD69诱导的凋亡与bcl-2依赖的信号转导有关 [17]。
成熟T细胞活化诱导凋亡机制可能是FAS,研究发现,体内激活的具有CD69高表达的扁桃腺T细胞体外易于自发性和快速凋亡,细胞趋化因子CXCL12/SDF-1、TIL16、IL17、IL12、IL15等可抑制凋亡;磷酸酰肌醇3激酶(PI3K)抑制剂可加速凋亡,提示体内激活CD69+T细胞有内源性的凋亡敏感性的增加,而其机制涉及多种外源信号 [18]。
3. CD69在疾病中的作用
CD69作为T淋巴细胞激活后最早表达的表面分子,是T细胞介导的免疫应答的重要组成。当其表达之后,可通过提高Ca2+浓度、上调细胞内TNF-α、IFN-γ等细胞因子的分泌以及IL-2及其受体的合成与表达,并作为共刺激信号促进T细胞进一步活化和增殖。现有研究表明,CD69对多种血细胞的激活、增殖和分化起重要作用,并与血液系统疾病及免疫相关性疾病的发病机理有关。
3.1 CD69和血液系统疾病
在多种血液系统恶性肿瘤(包括淋巴瘤、急性或慢性白血病、多发性骨髓瘤)外周血淋巴细胞亚群中发现,CD4+和CD8+的T细胞上CD69、CD71等活化标志分子表达明显增加,说明这类疾病存在T细胞激活。
急性髓系白血病((Acute myeloid leukemia,AML)起源于造血干细胞的异常增殖和分化。在AML中,白血病细胞不成熟并快速增殖,最终会取代正常造血组织,导致贫血、感染和出血等症状。在AML中,CD69表达率明显降低。由于CD69的缺乏,一系列细胞因子,如IL2、TNF-α等分泌亦减低,难以形成效应T细胞而产生免疫应答。经化疗获得完全缓解后,CD69表达率则明显升高,表明AML患者存在T细胞活化受抑、免疫功能受损 [19]。
慢性淋巴细胞白血病(Chronic Lymphocytic Leukemia,CLL)是一种以CD5+CD19+B淋巴细胞克隆性增殖为特征的恶性增生性疾病。在CLL中,用丝裂原体外刺激B细胞,发现CD69的表达与正常对照相似,但CD95的上调性表达受损。进一步研究揭示CLL患者瘤细胞表达CD23,CD25,CD69,CD71等表面活化抗原,而CD69表达水平可能与CLL患者外周血淋巴细胞数目、更差的临床分期等因素密切相关 [20]。
在骨髓增生异常综合征(Myelodysplastic Syndromes,MDS)单核细胞中,CD69的表达量明显增加,这可能与MDS患者免疫功能失调有关。CD69的高表达可能会导致单核细胞对病原体的清除能力下降,从而使MDS患者更容易感染。
3.2 CD69和自身免疫相关性疾病
对于CD69的研究大都集中在系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病上。这些研究发现CD69在自身免疫性疾病患者外周血中处于高表达状态,经有效治疗后,CD69表达水平明显回落,且CD69水平与疾病的活动明显相关。
系统性红斑狼疮(Systemic Lupus Erythematosus,SLE)是以T、B淋巴细胞功能改变为特征的自身免疫性疾病。在刺激实验中,SLE患者的淋巴细胞CD69表达比正常人群细胞呈高反应,且SLE病人淋巴细胞对多种刺激表现适度的增殖。然而,SLE患者CD4+和CD8+T细胞,CD69的表达无明显差异,提示CD4+和CD8+T细胞的活化,均需CD69的参与,CD69所起的作用很可能是在活化早期传递活化信号 [22]。
在类风湿性关节炎(Rheumatoid Arthritis,RA)滑膜液中,CD4+和CD8+T淋巴细胞CD69的表达均升高,表明这两个T细胞亚群均被激活。对比RA、血清阴性脊柱关节病(SSd)和结晶体关节炎(CAA)三组患者在关节滑膜液中CD69的表达,发现CD69+淋巴细胞的百分比在三组患者中没有差异,但是RA患者关节滑膜液中CD69表达水平最高。此外,RA组患者的淋巴细胞CD69表达与滑膜液IL-15水平相关 [23-24]。
在自身免疫性心肌炎的小鼠中,CD69能通过调节心脏特异的Th17细胞来负性调节心肌炎症。Th17细胞是一种免疫细胞,其参与了多种炎症性疾病的发生和发展过程,包括心肌炎。在体内CD69能通过活化Jak3/Stat5通路调节T细胞向Th17细胞分化 [25]。
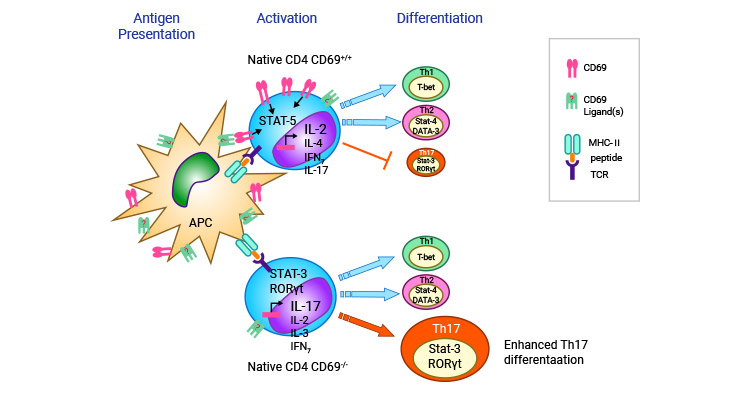
图4. CD69调节T细胞向Th17细胞分化 [28]
3.3 CD69和其它疾病
有研究表明冠心病(Coronary Heart Disease,CHD)患者的CD69、DKK-1、IL-10、IL-6、TC、TG、LDL高表达,并且随着冠脉狭窄病变程度加重 [26-27]。早期研究还揭示,哮喘患者气道中T细胞有CD69表达,在细胞激活后,CD69通过对TGF-β生成与分泌的调节来激发T细胞的凋亡 [28]。CD69诱导活化细胞凋亡功能为哮喘治疗提供新思路。另有学者在实体瘤(胃癌、肝癌、大肠癌等)的研究中发现,患者外周血CD69表达水平明显减低,并与肿瘤分期呈负相关,手术切除病灶或化疗后,CD69表达水平则有所回升 [29-31]。
4. 靶向CD69的研发药物及临床意义
最新的Pharmsnap数据显示,GeneFrontier Corp.正在临床前模型中验证一款针对CD69的单克隆抗体药物(GFC-101),可用于治疗肠易激综合征、类风湿关节炎以及呼吸障碍。作为细胞最早表达的激活蛋白,CD69可以引发一系列免疫反应。目前,更多干预CD69表达水平的药物或抗体正在进一步研究中,例如,在治疗CLL患者时,高表达CD69的瘤细胞不太容易受到苯达莫司汀(Bendamustine)的影响,相比之下,外周血细胞则更容易受到影响。预先使用B细胞受体抑制剂降低CD69水平可能有助于减少苯达莫司汀低应答病例的发生 [32]。
此外,CD69的配体及生物功能等目前仍未探清。近期的研究表明,Gla-1可能是CD69的一种配体,与CD69分子胞外结构结合。这种Gla-1-CD69配受体结合方式代表了一条新的通路,可控制Th17介导的炎症和炎症带相关组织损伤 [8]。最新研究发现CD69还可通过与S1PR1结合,激活S1PR1并导致其内化,在淋巴细胞活动中发挥重要的调节作用 [33]。随着对CD69研究的深入,我们将获得更多关于CD69的生物学功能和临床应用方面的重要信息。未来,在血液病和自身免疫疾病治疗中,有望开发以CD69为靶点的新型免疫治疗方法。
为鼎力协助各药企针对CD69在血液和免疫等疾病在临床中的研究,CUSABIO推出CD69活性蛋白产品(CSB-MP004952HU;CSB-EP004952HU-B),助力您在CD69机制方面的研究或其潜在临床价值的探索(点击查看CD69系列产品:CD69蛋白; CD69抗体)。
CD69 蛋白:
Recombinant Human Early activation antigen CD69(CD69),partial (Active)
Recombinant Human Early activation antigen CD69(Cd69),partial,Biotinylated
by SDS-PAGE
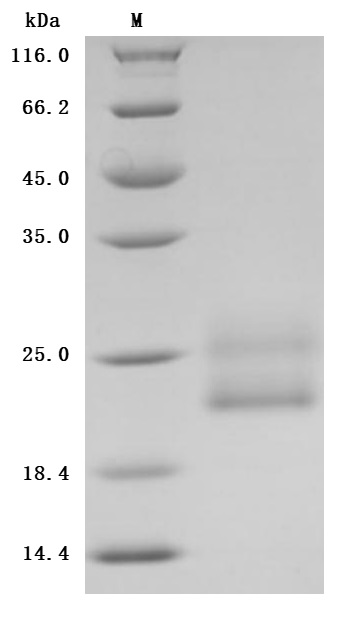
The purity was greater than 96.7% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
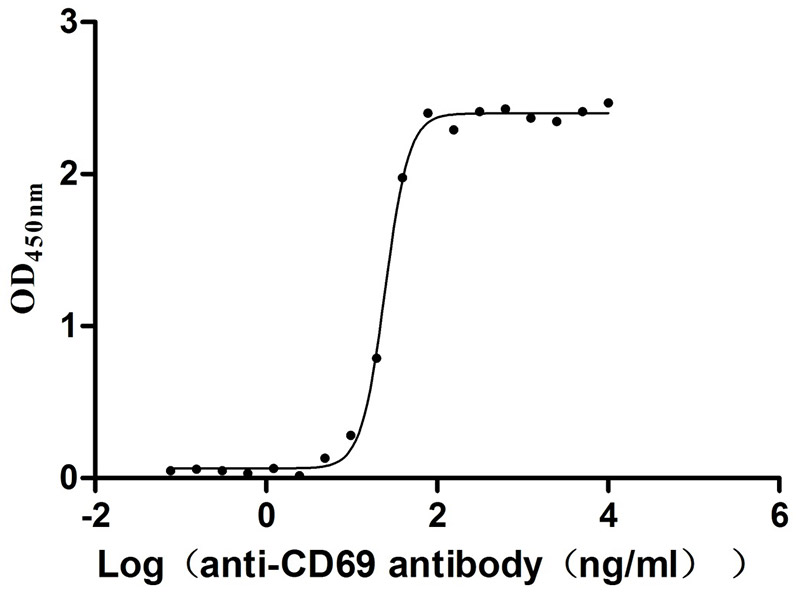
Immobilized Human CD69 at 2μg/mL can bind Anti-CD69 recombinant antibody (CSB-RA004952MA1HU), the EC50 is 23.17-26.04 ng/mL
by SDS-PAGE
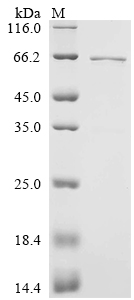
The purity was greater than 90% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
CD69 稳转细胞株:
参考文献:
[1] Yu, Lei, et al. "HSF1 promotes CD69+ Treg differentiation to inhibit colitis progression." Theranostics 13.6 (2023): 1892.
[2] Dohnálek, Jan, and Tereza Skálová. "C-type lectin-(like) fold–Protein-protein interaction patterns and utilization." Biotechnology Advances 58 (2022): 107944.
[3] Koyama-Nasu, Ryo, et al. "The cellular and molecular basis of CD69 function in anti-tumor immunity." International Immunology 34.11 (2022): 555-561.
[4] Vandeveer, George H., et al. "Discovery of structural diverse reversible BTK inhibitors utilized to develop a novel in vivo CD69 and CD86 PK/PD mouse model." Bioorganic & Medicinal Chemistry Letters 80 (2023): 129108.
[5] Lauzurica, Pilar, et al. "Phenotypic and functional characteristics of hematopoietic cell lineages in CD69-deficient mice." Blood, The Journal of the American Society of Hematology 95.7 (2000): 2312-2320.
[6] Chen, Chun-Kai, et al. "Increased expressions of CD69 and HLA-DR but not of CD25 or CD71 on endometrial T lymphocytes of nonpregnant women." Human immunology 42.3 (1995): 227-232.
[7] Peggs, Karl S., et al. "Immunotherapy with CD25/CD71-allodepleted T cells to improve T-cell reconstitution after matched unrelated donor hematopoietic stem cell transplant: a randomized trial." Cytotherapy 25.1 (2023): 82-93.
[8] Cibrián, Danay, and Francisco Sánchez‐Madrid. "CD69: from activation marker to metabolic gatekeeper." European journal of immunology 47.6 (2017): 946-953.
[9] Agaugué, Sophie, et al. "Human natural killer cells exposed to IL-2, IL-12, IL-18, or IL-4 differently modulate priming of naive T cells by monocyte-derived dendritic cells." Blood, The Journal of the American Society of Hematology 112.5 (2008): 1776-1783.
[10] Matic, J., Deeg, J., Scheffold, A., Goldstein, I., & Spatz, J. P. (2013). Fine tuning and efficient T cell activation with stimulatory aCD3 nanoarrays. Nano letters, 13(11), 5090–5097.
[11] Tian, Yunfei, et al. "Development of a Monoclonal Antibody to Pig CD69 Reveals Early Activation of T Cells in Pig after PRRSV and ASFV Infection." Viruses 14.6 (2022): 1343.
[12] Borrego, F., et al. "CD69 is a stimulatory receptor for natural killer cell and its cytotoxic effect is blocked by CD94 inhibitory receptor." Immunology 97.1 (1999): 159.
[13] Zingoni, Alessandra, et al. "CD69‐triggered ERK activation and functions are negatively regulated by CD94/NKG2‐A inhibitory receptor." European journal of immunology 30.2 (2000): 644-651.
[14] Ishizaki, Shunsuke, et al. "Role of CD69 in acute lung injury." Life sciences 90.17-18 (2012): 657-665.
[15] Lamana, Amalia, et al. "CD69 modulates sphingosine-1-phosphate-induced migration of skin dendritic cells." Journal of Investigative Dermatology 131.7 (2011): 1503-1512.
[16] Ramı́rez, Rafael, et al. "CD69-induced monocyte apoptosis involves multiple nonredundant signaling pathways." Cellular immunology 172.2 (1996): 192-199.
[17] Aouad, Salah M., et al. "Caspase-3 is a component of Fas death-inducing signaling complex in lipid rafts and its activity is required for complete caspase-8 activation during Fas-mediated cell death." The Journal of Immunology 172.4 (2004): 2316-2323.
[18] Deng, Caishu, Elzbieta Goluszko, and Premkumar Christadoss. "Fas/Fas ligand pathway, apoptosis, and clonal anergy involved in systemic acetylcholine receptor T cell epitope tolerance." The Journal of Immunology 166.5 (2001): 3458-3467.
[19] Qiu, Guo, Xi Xu, and Qifa Liu. "CD69 Marks Leukemic Regenerating Cells and Regulates Their Metabolism in AML." Blood 140.Supplement 1 (2022): 8780-8782.
[20] Del Poeta, Giovanni, et al. "CD69 is independently prognostic in chronic lymphocytic leukemia: a comprehensive clinical and biological profiling study." Haematologica 97.2 (2012): 279-287.
[21] Davison, Glenda M., Nicolas Novitzky, and Rygana Abdulla. "Monocyte derived dendritic cells have reduced expression of co-stimulatory molecules but are able to stimulate autologous T-cells in patients with MDS." Hematology/oncology and stem cell therapy 6.2 (2013): 49-57.
[22] Portales-Perez, D., et al. "Abnormalities in CD69 expression, cytosolic pH and Ca2+ during activation of lymphocytes from patients with systemic lupus erythematosus." Lupus 6.1 (1997): 48-56.
[23] Atzeni, Fabiola, et al. "CD69 expression on neutrophils from patients with rheumatoid arthritis." Clinical and experimental rheumatology 22.3 (2004): 331-334.
[24] Afeltra, A., et al. "Expression of CD69 antigen on synovial fluid T cells in patients with rheumatoid arthritis and other chronic synovitis." Annals of the rheumatic diseases 52.6 (1993): 457-460.
[25] Martín, Pilar, et al. "CD69 association with Jak3/Stat5 proteins regulates Th17 cell differentiation." Molecular and cellular biology 30.20 (2010): 4877-4889.
[26] Ivanovska, Nina, and Petya Dimitrova. "Bone resorption and remodeling in murine collagenase-induced osteoarthritis after administration of glucosamine." Arthritis research & therapy 13.2 (2011): 1-13.
[27] Peng, Jianqiao, and Yi Xiang. "Value analysis of CD69 combined with EGR1 in the diagnosis of coronary heart disease." Experimental and Therapeutic Medicine 17.3 (2019): 2047-2052.
[28] Martín, Pilar, et al. "The leukocyte activation antigen CD69 limits allergic asthma and skin contact hypersensitivity." Journal of Allergy and Clinical Immunology 126.2 (2010): 355-365.
[29] Cai, Yang, Wei Zhu, and Guanghua Feng. "Alteration of CD69 and HLA-DR-positive T Cells in Patients with Gastric Cancer after Operations and its Clinical Significances." Journal of Medical Research (2006).
[30] Bruni, Elena, et al. "Intrahepatic CD69+ Vδ1 T cells re-circulate in the blood of patients with metastatic colorectal cancer and limit tumor progression." Journal for Immunotherapy of Cancer 10.7 (2022).
[31] Tang, Kaihua, et al. "CD69 serves as a potential diagnostic and prognostic biomarker for hepatocellular carcinoma." Scientific Reports 13.1 (2023): 7452.
[32] Montraveta, Arnau, et al. "CD69 expression potentially predicts response to bendamustine and its modulation by ibrutinib or idelalisib enhances cytotoxic effect in chronic lymphocytic leukemia." Oncotarget, 2015, vol. 7, num. 5, p. 5507-5520 (2015).
[33] Chen, Hongwen, et al. "Transmembrane protein CD69 acts as an S1PR1 agonist." Elife 12 (2023): e88204.