DKK1:经典的Wnt/β-catenin通路拮抗剂,癌症双向调控靶点?
日期:2023-07-26 14:11:06
近年来,DKK1在肿瘤治疗中引起关注!临床研究显示其广泛应用前景。君实生物(Junshi Biosciences)的JS015注射液已于去年获得IND受理,一种用于晚期恶性实体瘤的重组人源化抗DKK1单克隆抗体。此外,Leap Therapeutics公司的Sirexatamab(DKN-01,曾名LY-2812176)正在肝癌、胆管癌、胃癌等肿瘤中进行临床II期研究,而另一款DKK1抗体BHQ-880已在2020年完成了多发性骨髓瘤的II期临床试验。目前,DKK1作为经典Wnt信号通路的拮抗剂,不仅是肿瘤诊断和预后评价的血清学标志物,更是重要的肿瘤治疗新靶点!
1. 什么是DKK1?
1.1 DKK1的结构
Dickkopf相关蛋白1(Dickkopf-related protein 1,DKK1)是Wnt/B-catenin信号通路的典型抑制剂,属于DKK家族(其余包括DKK2、DKK3和DKK4)。DKK1由人类DKK1基因编码,位于10q11.2,长度约为3.5kb,编码一种分子量约为28.7KDa的分泌型糖蛋白,含约266个氨基酸。DKK1的结构包括:一个N端的信号序列、两个保守的富半胱氨酸区域(Dkk_N和辅脂肪酶折叠区域)以及一个靠近蛋白C端的N-糖化位点。其信号序列由20~30个氨基酸组成,负责定位DKK1肽链在内质网,并介导DKK1的细胞外分泌。辅脂肪酶折叠区域是由多个短的β叠和二硫键构成的类指结构,能与Wnt受体LRP5/LRP6及穿膜蛋白Kremen1/2结合成三聚体,从而诱导内吞作用并抑制Wnt信号通路。Dkk_N区域还含有一个保守的富胱氨酸序列(图1) [1-3]。
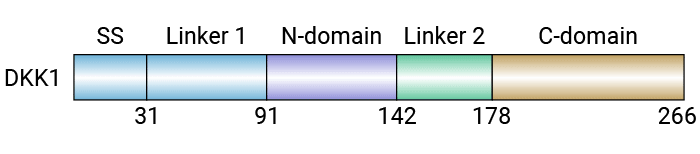
图1. DKK1的结构示意图 [1]
1.2 DKK1的表达和功能
DKK1主要由成骨细胞、骨细胞分泌,其次也表达于很多组织和细胞类型,包括胎盘、皮肤、前列腺、血管内皮、肾脏、成骨细胞和骨细胞等多个部位。DKK1作为一种分泌型糖蛋白,主要通过与Wnt蛋白竞争性结合LRP5/6受体,拮抗Wnt/β-catenin信号通路活性,调节细胞增殖、分化及癌变,影响细胞凋亡、瘤细胞侵袭和转移。越来越多的研究证实DKK1在肿瘤发生发展中呈现多样化的特点,甚至在同一种细胞中,因生理环境不同表现出相反的调节作用,其功能相对较复杂 [3-6]。
2. DKK1拮抗Wnt/β-catenin信号通路的调节机制
DKK1被视为Wnt/β-catenin信号通路的典型抑制因子,对细胞生命活动具有重要调控作用,在多种肿瘤的发展中扮演不可替代的角色。最新研究表明,尽管DKK1通常作为传统Wnt/β-catenin信号通路的抑制剂,但在某些研究中未能发挥其抑制剂的作用,这可能与β-catenin基因的变异有关。
目前的研究认为,DKK1通过至少两种方式抑制经典Wnt信号通路。首先,它与Frizzled相关蛋白质竞争性地阻止Frizzled与Wnt结合。其次,DKK1可以与细胞膜的Wnt受体LRP5/6和共受体Kremen1/2结合,形成聚合物并使其内吞,从而关闭Wnt信号,终止靶基因异常转录进程。此外,DKK1本身也是经典Wnt信号通路的靶基因,其启动子区域含有β-catenin结合位点。一些研究认为转录生成的DKK1能通过负反馈机制抑制上游基因的表达,与信号链上的其他因子共同维持内环境的稳态(图2) [7-12]。
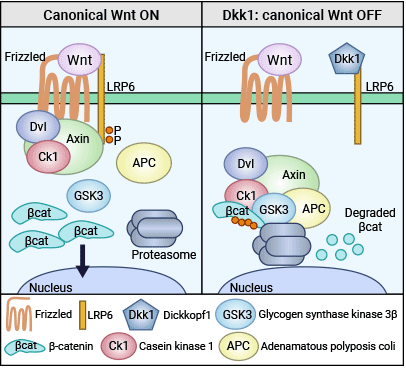
图2. DKK1拮抗Wnt/β-catenin信号通路的调节机制 [12]
3. DKK1在肿瘤等其它疾病中的作用
DKK1主要通过Wnt/β-catenin信号通路发挥作用,以往研究表明DKK1通过该通路参与了多种疾病的发病机制。尤其在肿瘤中,DKK1在不同研究条件下呈现出截然不同的结果。据报道,在多发性骨髓瘤 [11]、肝胞癌 [12]、肝/肾母细胞癌 [13]、非小细胞肺癌 [14]、头颈部癌 [15]、食管癌 [16]、胰腺癌 [17]等肿瘤中DKK1往往表达增高,呈现促癌基因的特征;在胃癌 [18]、膀胱癌 [19]、黑色素瘤 [20]、结直肠癌 [21]中,DKK1表达降低,呈现抑癌基因特征。
3.1 DKK1和多发性骨髓瘤
DKK1在多发性骨髓瘤MM中的作用是促进骨破坏,而抑制DKK1可以减轻骨破坏程度。高表达的DKK1与广泛的骨破坏相关,因为它抑制了骨髓干细胞向成骨细胞的分化。近年来,抑制DKK1的抗体和疫苗成为治疗多发性骨髓瘤的新方法。研究发现,抗DKK1疫苗能够引发CD4+和CD8+T细胞反应,而保护裸鼠免受MM侵袭。DKK1联合MMSA-1的多表位抗原疫苗比DKK1/MMSA-1单抗原疫苗诱导的T细胞免疫反应更强,增强了对骨髓瘤细胞及MM骨破坏的抑制作用 [22]。因此,靶向DKK1可能为多发性骨髓瘤治疗带来新的方向。
3.2 DKK1和胃癌
研究发现,胃癌细胞中DKK1表达强,正常胃黏膜中表达较弱。DKK1高表达与胃癌晚期、远处转移、淋巴侵润和血管侵犯相关。敲除DKK1可减弱胃癌细胞的增殖、迁移和侵袭能力。DKK1阳性的胃癌患者存活期较低。因此,血清中DKK1含量增加和胃癌组织中DKK1表达增加有助于胃癌的诊断和预测。Sirexatamab(DKN-01)是一种针对DKK1的靶向药物,在临床治疗胃癌方面显示出潜力。数据显示,Sirexatamab通过结合DKK1降低血管增生,并上调关键细胞因子IFNγ、IL-15和IL-33的水平,促进肿瘤细胞死亡。它还可以激活Wnt信号通路,重编程免疫抑制细胞MDSC,降低其免疫抑制活性(图3) [23-25]。
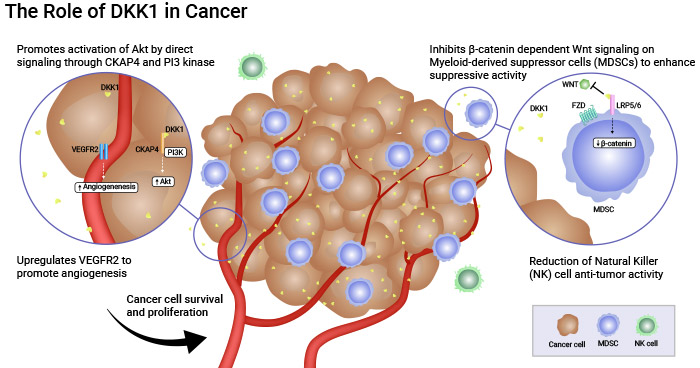
图3. Sirexatamab(DKN-01)在临床治疗胃癌方面显示出潜力 [25]
3.3 DKK1和结直肠癌
血管生成拟态(Vasculogenic Mimicry,VM)是肿瘤细胞在特定条件下形成的类似血管壁结构,可输送血液,促进肿瘤生长和血管构建。参与VM的肿瘤细胞容易发生血道转移,对化疗和抗血管生成治疗不敏感,导致患者预后差。研究发现,存在VM的结肠癌组织中DKK1表达较低,DKK1过表达的HCT116细胞形成管状结构能力明显减弱,且VE-cadherin表达降低。此外,DKK1可抑制裸鼠移植瘤组织中HCT116细胞形成VM。因此,DKK1过表达可抑制结直肠癌VM形成 [26]。
3.4 DKK1和乳腺癌
DKK1在乳腺癌中的作用是复杂的,既可能具有抑制肿瘤的效果,也可能具有促进肿瘤的效果。在某些情况下,DKK1被认为是抑制乳腺癌的因素,特别是对于骨转移的抑制。它可以增强破骨细胞的活性,并抑制乳腺癌细胞向骨骼进行转移。因此,高血清DKK1水平可以作为乳腺癌骨转移的特异性诊断指标 [27]。然而,有研究表明,DKK1在乳腺癌中也可能具有促进血管生成、促进乳腺癌细胞迁移和侵袭的能力。DKK1可以通过VEGFR2信号级联反应诱导血管生成,增加乳腺癌细胞的侵袭和血管生成能力 [28-29]。
3.5 DKK1和胰腺癌
采用无创血清学检测胰腺癌血清中CA19-9、s-ULBP2、DKK1表达水平与良性胰腺病患者及健康人群的差别,实验结果显示,胰腺癌患者血清CA19-9、s-ULBP2、DKK1含量明显高于良性胰腺病组及健康对照组。通过Logistic回归分析及ROC曲线分析,提示CA19-9的敏感度最高,DKK1的特异性最高。研究认为,三者联合检测可提高胰腺癌诊断准确率且可评估胰腺癌的临床治疗效果 [30]。
3.6 DKK1和膀胱癌
基于GEPIA数据库,DKK1在膀胱癌组织中相对于癌旁组织表达量下降,DKK1高表达者总体生存率较DKK1低表达者要减小。ELISA检测血清中DKK1浓度显示,膀胱癌中血清浓度显著高于健康者,且淋巴结转移的膀胱癌DKK1血清浓度显著高于未转移者。III期+IV期膀胱癌患者DKK1浓度明显高于I期+II期患者。然而,实验与数据库中的结果相矛盾。可能的原因是测量对象不同(血清蛋白水平vs.组织中基因水平) [19, 31]。因此,需要进一步的验证DKK1在膀胱癌发展中的具体用机制,探索其作为新的治疗靶点的可能性。
3.7 DKK1和其它疾病
除了与肿瘤相关,DKK1还与多种疾病有关。在帕金森病的6-OHDA损伤大鼠模型中,DKK1被诱导表达于腹侧中脑,敲低DKK1可以减轻MPP+诱导的PC12细胞凋亡,并促进β-catenin和p-Ser9-GSK-3β的表达 [32]。临床前研究显示,DKK1不仅抑制成骨细胞,同时还激活破骨细胞,导致骨稳态破坏和抑制骨形成。研究表明DKK1可能参与强直性脊柱炎(Ankylosing Spondylitis,AS)等新骨形成的过程 [33]。
在牙周炎研究中,下调DKK1可以抑制促炎细胞因子IL-1β、IL-6、IL-8的表达,促进成骨标志物BMP-2、OCN、RunX2的mRNA表达以及钙结节生成,同时促进人牙周膜干细胞(hPDLSCs)成骨分化,从而抑制牙周炎的发展。进一步研究DKK1在这些疾病中的作用,有助于发现新的治疗方法和药物 [34-35]。
4. DKK1的临床在研药物
来自Pharmsnap的数据表明(表1),BHQ-880和Sirexatamab等药物作为DKK1抑制剂,正在进行临床研究,用于治疗多发性骨髓瘤等多种肿瘤。同时,DKK1负载的树突状细胞疫苗和JS015单克隆抗体也显示出潜力。值得一提的是,Sirexatamab在一线治疗晚期胃癌和胃食道结合部癌的2a期临床试验初步结果显示,客观缓解率(ORR)达到68.2%,DKK1高表达肿瘤患者的ORR更高达90% [36]。
此外,还有其它DKK1抑制剂和调节剂处于临床前或药物发现阶段,用于肝癌,卵巢癌,子宫内膜癌,前列腺癌,免疫球蛋白a肾病等疾病治疗。因此,通过针对DKK1的靶向治疗方法,利用不同类型的药物,如单克隆抗体、重组多肽和小分子化药物,有望开发出更有效的选择,为肿瘤或自身免疫性疾病的治疗带来新的希望。
| 药物 | 靶点 | 作用机制 | 在研适应症 | 药物最高研发状态(全球) | 药物类型 | 在研机构 |
|---|---|---|---|---|---|---|
| BHQ-880 | DKK1 | DKK1抑制剂 | 多发性骨髓瘤 | 临床2期 | 单克隆抗体 | Novartis AG; MorphoSys AG; Novartis Pharma AG |
| Sirexatamab (DKN-01) | DKK1 | DKK1抑制剂 | 结直肠癌;胃腺癌;食管癌;胃食管交界处癌;胆道肿瘤;肝癌;卵巢癌;子宫内膜癌;前列腺癌;胃癌;多发性骨髓瘤;非小细胞肺癌;肉瘤;鳞状细胞癌 | 临床2期 | 单克隆抗体 | 飞跃治疗公司 (Leap Therapeutics, Inc.);礼来制药 Eli Lilly & Co. |
| DKK1 loaded dendritic cell vaccine(Case Comprehensive Cancer Center) | DKK1 | 免疫刺激剂 | 淀粉样变性; 免疫球蛋白a肾病; 意义不明的单克隆丙种球蛋白病;多发性骨髓瘤;阴燃多发性骨髓瘤 |
早期临床1期 | 预防性疫苗 | The Case Comprehensive Cancer Center |
| JS015 | DKK1 | DKK1抑制剂 | 晚期恶性实体瘤 | 临床申请批准 | 单克隆抗体 | 上海君实生物医药科技股份有限公司 (Shanghai Junshi Biosciences Co., Ltd.) |
| DKK1-CAR-iNKT | DKK1 | / | 肿瘤 | 临床前 | 单克隆抗体 | 苏达有限公司 (Arovella Therapeutics Ltd.) |
| anti-DKK1 antibodies | DKK1 | DKK1调节剂 | 肿瘤 | 临床前 | 生物药 | 扭轉生物科技有限公司 (Twist Bioscience Corp.) |
| APC-002 | DKK1 | DKK1抑制剂 | 食管癌;胃癌 | 临床前 | 生物药 | 安沛治疗有限公司 (Aptacure Therapeutics Ltd.) |
| Recombinant human R-spondin 1 | DKK1 | DKK1调节剂 | / | 临床1期 | 重组多肽 | / |
| RN-564 | DKK1 | DKK1抑制剂 | / | 临床1期 | 单克隆抗体 | / |
| IIIC3 (Enzo Biochem, Inc.) | DKK1 | DKK1抑制剂 | / | 药物发现 | 小分子化药 | / |
| Mab-B3 | DKK1 | DKK1抑制剂 | / | 药物发现 | 单克隆抗体 | / |
表1:DKK1的在研临床药物
为鼎力协助科研和药企人员针对DKK1在肿瘤和自身免疫等疾病相关的临床应用研究,CUSABIO推出DKK1活性蛋白(Code: CSB-MP006920HU(A4))产品,助力您在DKK1机制方面的研究或其潜在临床价值的探索(点击查看DKK1全系列产品:蛋白;抗体;试剂盒)。
DKK1蛋白
Recombinant Human Dickkopf-related protein 1(DKK1) (Active) (Code: CSB-MP006920HU(A4))
-SDS.jpg)
The purity was greater than 95% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
-AC1.jpg)
Immobilized Human DKK1 at 2 μg/mL can bind Anti-DKK1 recombinant antibody (CSB-RA006920MA1HU), the EC50 is 1.283-2.544 ng/mL.
参考文献:
[1] Chu, Hang Yin, et al. "Dickkopf-1: A promising target for cancer immunotherapy." Frontiers in Immunology 12 (2021): 658097.
[2] Diarra, Danielle, et al. "Dickkopf-1 is a master regulator of joint remodeling." Nature medicine 13.2 (2007): 156-163.
[3] Bafico, Anna, et al. "Novel mechanism of Wnt signalling inhibition mediated by Dickkopf-1 interaction with LRP6/Arrow." Nature cell biology 3.7 (2001): 683-686.
[4] Zhu, Guohua, et al. "Expression and role of Dickkopf-1 (Dkk1) in tumors: from the cells to the patients." Cancer Management and Research (2021): 659-675.
[5] Yamaguchi, Yuji, et al. "Regulation of skin pigmentation and thickness by Dickkopf 1 (DKK1)." Journal of Investigative Dermatology Symposium Proceedings. Vol. 14. No. 1. Elsevier, 2009.
[6] Ke, Hua Zhu, et al. "Sclerostin and Dickkopf-1 as therapeutic targets in bone diseases." Endocrine reviews 33.5 (2012): 747-783.
[7] Leijten, Jeroen Christianus Hermanus, et al. "Gremlin 1, frizzled‐related protein, and Dkk‐1 are key regulators of human articular cartilage homeostasis." Arthritis & Rheumatism 64.10 (2012): 3302-3312.
[8] Dun, Xiaoyi, et al. "Differential expression of DKK-1 binding receptors on stromal cells and myeloma cells results in their distinct response to secreted DKK-1 in myeloma." Molecular cancer 9.1 (2010): 1-9.
[9] Niida, Atsushi, et al. "DKK1, a negative regulator of Wnt signaling, is a target of the β-catenin/TCF pathway." Oncogene 23.52 (2004): 8520-8526.
[10] Zhou, Yu-Xin, et al. "Nomogram Incorporating the WNT/β-Catenin Signaling Pathway for Predicting the Survival of Cutaneous Melanoma." International Journal of General Medicine (2021): 2751-2761.
[11] Purro, Silvia A., Soledad Galli, and Patricia C. Salinas. "Dysfunction of Wnt signaling and synaptic disassembly in neurodegenerative diseases." Journal of molecular cell biology 6.1 (2014): 75-80.
[12] Fulciniti, Mariateresa, et al. "Anti-DKK1 mAb (BHQ880) as a potential therapeutic agent for multiple myeloma." Blood, The Journal of the American Society of Hematology 114.2 (2009): 371-379.
[13] Shen, Qiujin, et al. "Serum DKK1 as a protein biomarker for the diagnosis of hepatocellular carcinoma: a large-scale, multicentre study." The lancet oncology 13.8 (2012): 817-826.
[14] Sun, Jinlin, Xudong Chen, and Yansen Wang. "Comparison of the diagnostic value of CEA combined with OPN or DKK1 in non‑small cell lung cancer." Oncology Letters 20.3 (2020): 3046-3052.
[15] Gosepath, Eva M., et al. "Acquired cisplatin resistance in the head–neck cancer cell line Cal27 is associated with decreased DKK1 expression and can partially be reversed by overexpression of DKK1." International journal of cancer 123.9 (2008): 2013-2019.
[16] Song, Qingping, et al. "miR-33a-5p inhibits the progression of esophageal cancer through the DKK1-mediated Wnt/β-catenin pathway." Aging (Albany NY) 13.16 (2021): 20481.
[17] Igbinigie, Eseosaserea, et al. "Dkk1 involvement and its potential as a biomarker in pancreatic ductal adenocarcinoma." Clinica chimica acta 488 (2019): 226-234.
[18] Jiang, Jiang, et al. "FOXC1 negatively regulates DKK1 expression to promote gastric cancer cell proliferation through activation of Wnt signaling pathway." Frontiers in Cell and Developmental Biology 9 (2021): 662624.
[19] Sun, D. K., et al. "Serum Dickkopf-1 levels as a clinical and prognostic factor in patients with bladder cancer." Genet Mol Res GMR 14.4 (2015): 18181-18187.
[20] Liao, Yangying, et al. "Suppressive role of microRNA-130b-3p in ferroptosis in melanoma cells correlates with DKK1 inhibition and Nrf2-HO-1 pathway activation." Human Cell 34.5 (2021): 1532-1544.
[21] Rawson, James B., et al. "Promoter methylation of Wnt antagonists DKK1 and SFRP1 is associated with opposing tumor subtypes in two large populations of colorectal cancer patients." Carcinogenesis 32.5 (2011): 741-747.
[22] Lu, Chenyang, et al. "A novel multi‐epitope vaccine from MMSA‐1 and DKK 1 for multiple myeloma immunotherapy." British journal of haematology 178.3 (2017): 413-426.
[23] Klempner, S. J., et al. "Safety and efficacy of a DKK1 inhibitor (DKN-01) in combination with pembrolizumab (P) in patients (Pts) with advanced gastroesophageal (GE) malignancies." Annals of Oncology 29 (2018): viii222.
[24] Jarman, Edward J., et al. "DKK1 drives immune suppressive phenotypes in intrahepatic cholangiocarcinoma and can be targeted with anti‐DKK1 therapeutic DKN‐01." Liver International 43.1 (2023): 208-220.
[25] https://www.sec.gov/Archives/edgar/data/1509745/000110465921117855/tm2128111d1_ex99-2.htm
[26] Yao, Lingli, et al. "Dickkopf‐1‐promoted vasculogenic mimicry in non‐small cell lung cancer is associated with EMT and development of a cancer stem‐like cell phenotype." Journal of Cellular and Molecular Medicine 20.9 (2016): 1673-1685.
[27] Zhuang, Xueqian, et al. "Differential effects on lung and bone metastasis of breast cancer by Wnt signalling inhibitor DKK1." Nature cell biology 19.10 (2017): 1274-1285.
[28] Niu, Jie, et al. "DKK1 inhibits breast cancer cell migration and invasion through suppression of β-catenin/MMP7 signaling pathway." Cancer cell international 19.1 (2019): 1-13.
[29] Choi, Sung Hoon, et al. "Dickkopf-1 induces angiogenesis via VEGF receptor 2 regulation independent of the Wnt signaling pathway." Oncotarget 8.35 (2017): 58974.
[30] Cui, Dapeng, et al. "Value analysis of CA19-9, s-ULBP2 and Dkk1 in the diagnosis of pancreatic cancer." The Journal of Practical Medicine (2017): 4086-4089.
[31] Wei, Ruqiong, et al. "Analyzing the prognostic value of DKK1 expression in human cancers based on bioinformatics." Annals of translational medicine 8.8 (2020).
[32] Dun, Yaoyan, et al. "Inhibition of the canonical Wnt pathway by Dickkopf-1 contributes to the neurodegeneration in 6-OHDA-lesioned rats." Neuroscience letters 525.2 (2012): 83-88.
[33] Daoussis, Dimitrios, et al. "Evidence that Dkk‐1 is dysfunctional in ankylosing spondylitis." Arthritis & Rheumatism: Official Journal of the American College of Rheumatology 62.1 (2010): 150-158.
[34] Li, Bei, et al. "GCN5 modulates osteogenic differentiation of periodontal ligament stem cells through DKK1 acetylation in inflammatory microenvironment." Scientific Reports 6.1 (2016): 26542.
[35] Wang, Chengze, et al. "HOXA10 inhibit the osteogenic differentiation of periodontal ligament stem cells by regulating β-catenin localization and DKK1 expression." Connective Tissue Research 62.4 (2021): 393-401.
[36] Yamabuki, Takumi, et al. "Dikkopf-1 as a novel serologic and prognostic biomarker for lung and esophageal carcinomas." Cancer research 67.6 (2007): 2517-2525.
上一篇: 一抗和二抗的区别











