四次跨膜蛋白CD81:丙型肝炎病毒(HCV)关键受体,外泌体重要标记蛋白,抗病毒或抗肿瘤研究前景靶点!
日期:2023-12-22 09:46:50
最近,Cancers杂志发表了一篇题为“Targeting of Tetraspanin CD81 with Monoclonal Antibodies and Small Molecules to Combat Cancers and Viral Diseases”的综述论文 [1]。该报道指出,CD81为一种潜在的抗病毒和抗癌的药物靶点,是一些病毒(如丙型肝炎病毒HCV、人类免疫缺陷病毒HIV等)的共受体,同时也在肿瘤的发生和转移中起着重要的作用。此外,针对CD81的药物研究策略包括使用单克隆抗体和小分子化合物,通过阻断CD81与其伴侣的结合,抑制CD81的功能,在相关疾病中发挥作用。同时,CD81作为广泛报道的外泌体标记蛋白,有研究表明其在药物输送和疾病研究中扮演关键角色,或可用作癌症研究的药物载体!今天,我们一起来了解下四次跨膜蛋白CD81!
1. 什么是CD81?
1.1 CD81的结构
CD81(又名Tetraspanin-Associated Protein 1,TAPA-1)是首个被认定的HCV感染靶细胞的受体分子,最初是在筛选能抑制B淋巴细胞瘤增殖的单克隆抗体的过程中被发现的,属于四次跨膜蛋白超家族(Tetraspanins/TM4SF)(点击了解“什么是TM4SF家族”)。CD81由四个跨膜区、两个胞浆区(N端和C端),以及一个胞外结构城(EC)构成。其中,EC分为EC1和EC2,分别由28和80个氨基酸残基组成。EC1位于跨膜区TM1与TM2之间,形成了一个小环(SEL),对维持CD81在细胞表面正确构象起着重要作用。而EC2位于TM3与TM4之间,形成了一个大环(LEL),决定了CD81的物种特异性,同时介导了CD81与HCV(丙型肝炎病毒)包膜蛋白E2的结合。在LEL中,由四个半胱氨酸残基形成的两个二硫键是HCV E2与CD81相互识别的关键因素 (图1)[1-2]。
1.2 CD81的表达和功能
CD81可表达在除红细胞和血小板以外其他的多种组织细胞表面,在细胞的生长、发育和运动、蛋白转运、细胞融合、细胞与细胞之间的相互作用、先天免疫抑制中都发挥着至关重要的作用。CD81作为通道蛋白,是丙型肝炎病毒(HCV)、疟原虫等病原体感染的关键因素,这主要是由于CD81蛋白能与其他四聚体腺和细胞特异性伴侣蛋白相互结合。四跨膜蛋白超家族TM4SF,CD9、CD63、CD81和CD82,它们通常可以作为外泌体的标志物,是许多疾病相关病理变化的潜在标志物。此外,CD81等多种跨膜蛋白形成的精卵互作蛋白网络,参与到精卵互作过程中,与精卵膜互作异常,不孕等因素相关。更值得注意的是,CD81基因位于肿瘤细胞中的抑癌基因区域,陆续研究表明CD81参与调控肿瘤生长和转移等生物学过程 [3-5]。
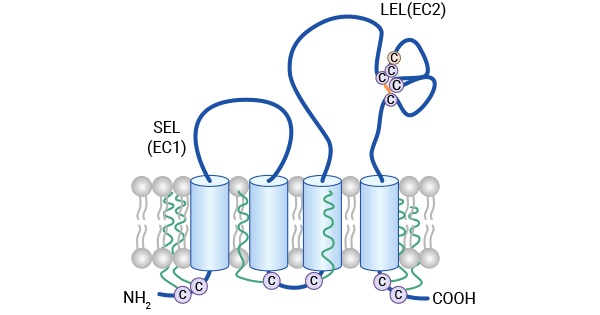
图1. CD81的结构 [1]
2. CD81相关的作用机制
2.1 CD81与病毒感染相关机制
CD81能以非共价键结合的方式与多种分子形成复合物,促进细胞间的相互作用、信号传导、以及调节细胞内外的分子通道。例如,CD81蛋白可以在B细胞中与CD21蛋白、CD19蛋白和Leu13蛋白形成复合物,参与B细胞激活。尤其是在病毒感染研究方面,CD81大的细胞外环结构(CD81-LEL)绑定HCV E2糖蛋白形成E2:CD81-LEL,其互相作用对HCV基因组有效复制很重要。此外,CD81与CLDN-1相互作用形成CD81-CLDN-1受体复合物,有助于HCV侵入宿主细胞的受体绑定前环节以协助病毒内化到细胞中。无论如何,CD81被视为HCV重要受体,引导病毒颗粒进入胞内,且还可能影响病毒与靶细胞间的信号传递 (图2)[6-7]。
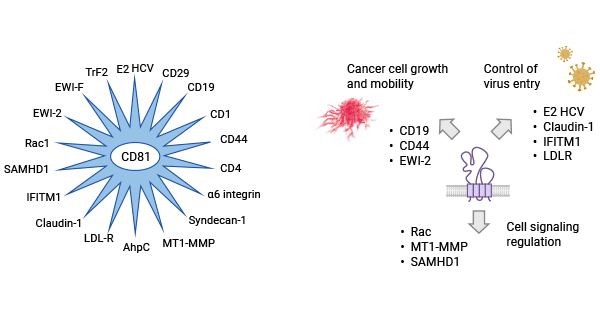
图2. CD81与病毒感染相关机制 [6]
2.2 CD81与细胞形态相关机制
研究发现CD81蛋白能与Integrin a4β1在T细胞中的Molt4和Jurkat细胞中进行结合,其β1家族Integrin 也能与CD53蛋白、CD63蛋白和CD82蛋白结合。在T细胞系中还发现CD81蛋白能与CD82蛋白结合。CD81的固定化抗体能诱导T细胞形态的变化,形成细胞突起。在治疗大鼠星形胶质细胞的过程中,采用CD81单克隆抗体时,也发现CD81抗体会影响细胞突起,导致细胞突起程度的增加。对于T细胞和CD82单克隆抗体,也发现了类似的情况,而细胞松驰素D和秋水仙碱可以抑制这种作用。以上结果说明CD81蛋白和CD82蛋白都与细胞形态的变化有关 [8-10]。
2.3 CD81与肿瘤相关机制
CD81可以与整合素或四跨膜区蛋白超家族中的其他成员等在细胞膜上相互结合,形成大分子复合物,发挥信号转导的作用;同时它还可以与磷酸肌醇及蛋白酪氨酸磷酸化等信号转导系统相关联,影响第二信使系统功能的发挥。例如,一项研究报道,在非小细胞肺癌(NSCLC)细胞中同时过表达CD81和ITGB1并进行Co-IP实验,发现CD81能与ITGB1结合。ITGB1属于整合素(Integrin)受体家族。Integrin参与了细胞分化以及肿瘤的凋亡和转移等多种信号通路。当在非小细胞肺癌细胞中同时过表达CD81、ITGB1和ITGA3并进行Co-IP实验时,发现CD81能促进ITGB1与ITGA3的结合(促进Integrin的活化),从而激活AKT通路和ERK1/2通路,促进非小细胞肺癌细胞的增殖和迁移。这强调了CD81在肿瘤进展中的关键作用,为未来肿瘤研究提供了新线索(图3) [11-13]。
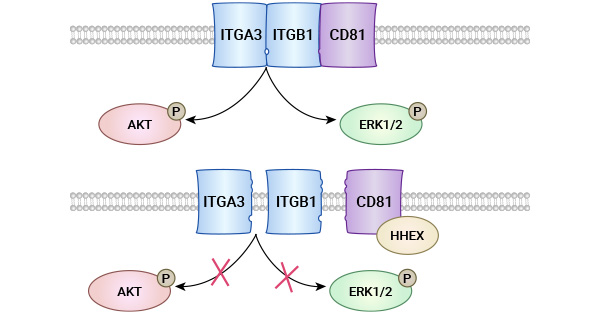
图3. CD81与肿瘤相关机制 [13]
3. CD81和多种疾病研究
3.1 CD81和丙型肝炎病毒研究
病毒感染细胞需要病毒的糖蛋白与细胞表面的相关受体蛋白紧密相连,这样的紧密相连是病毒感染过程中的重要步骤。人感染HCV后主要有慢性肝炎、肝癌和肝硬化的情况。CD81蛋白是在HCV感染人的过程中的细胞膜上必不可少的一个糖蛋白。有研究结果表明,抗CD81蛋白的抗体能阻断不同类型的HCV的感染。此外,研究发现用小RNA敲低肝癌细胞中的CD81能避免HCV的感染。CD81作为HCV的主要受体,除了直接与HCV的糖蛋白E2相互结合,CD81还与HCV的辅助受体Claudin-1、Claudin-6、Claudin-9、Occludin和SR-BI结合形成复合体,为随后的HCV吞噬提供支持 [14-18]。
3.2 CD81与癌症研究
CD81不仅在感染和免疫系统中发挥作用,而且在肿瘤发生和转移中也起到关键作用。研究发现,在肿瘤细胞种,eg. B细胞淋巴瘤、其它血液病和非血液病恶性肿瘤细胞,CD81蛋白含量高于正常细胞。在患者体内CD15蛋白和CD81蛋白能促进肿瘤的产生,而CD63蛋白和CD82蛋白能抑制肿瘤的产生 [19-20]。CD81蛋白在各种癌细胞中的功能不一致,例如在肝癌细胞中,CD81蛋白含量较少的细胞更有转移潜能 [21]。在胃癌细胞、膀胱癌细胞中,发现了相似的结果 [19, 22]。与上述结果相反的是,CD81蛋白表达量较高的黑色素瘤细胞更容易发生迁移、侵袭和转移 [23]。进一步研究揭示,CD81通过Akt依赖的Sp1激活信号通路诱导MT1-MMP的表达,进而刺激黑色素瘤细胞的运动,增加黑色素瘤的侵袭和转移 [23-24]。此外,CD81的缺失也严重损害了调节性T细胞和髓源性抑制细胞的功能 [25]。
3.3 CD81与其它疾病研究
陆续研究揭示,CD81作为外泌体表面可靠的膜标志物,在多种疾病中可能发挥调控作用,例如,研究发现,人间充质干细胞来源的外泌体(hUCMSCs-Exo),CD9、CD81和TSG101在改善微循环方面具有多种功能,与微血管功能障碍相关 [26];抑郁障碍患者外周血中星形胶质细胞源性外泌体的CD81蛋白水平高于健康对照组,但在轻中度和重度抑郁障碍患者中,CD81水平相关性较低。这表明星形胶质细胞源性外泌体CD81可能参与了抑郁障碍的发展 [27];从高血压病史的患者中分离出细胞外囊泡(EV),并通过纳米颗粒追踪分析,血浆和尿液EV富含小EV,并表达外泌体标记物(CD63、CD9和CD81),暗示它们可能在高血压的病理生理学中可能发挥着一定的功能 [28]。
在不同恶性潜能的胰腺囊性病变中,研究表明囊液是细胞外囊泡(EV)的丰富来源,这些EV表现出CD63和CD81的阳性和阴性特征。研究人员推测,通过分析囊液来源的EV,或许能够对这些病变的患者进行更精准的分类 [29]。在宫颈癌中,通过透射电子显微镜和纳米颗粒跟踪来分析外泌体,进一步基于蛋白质印迹法检测CD63、CD81、TSC101、Bcl-2、Bax、Caspase 3和RSF1蛋白水平,可以帮助研究宫颈癌的发病机制 [30];癌症相关成纤维细胞(CAF)分泌的外泌体通过传递非编码RNA或小蛋白参与肿瘤进展,从CAF/NF中提取的外泌体显示出CD63、CD81和TSG101的高表达 [31]。总之,CD81在外泌体中的变化呈现出潜在的疾病特异性,暗示着其可能成为微血管功能障碍、抑郁障碍、高血压、胰腺囊性病变、以及肿瘤进展等研究的新关键靶点。
4. CD81的临床研究前景
目前,四次跨膜蛋白CD81临床研究尚处于早期阶段,暂未有药物在研。然而,CD81作为四次跨膜蛋白家族的一员,其在HCV感染和肿瘤中扮演的角色,值得引起关注。其大胞外环(EC2)是其与众多蛋白结合的主要区域,也是药物设计的主要靶点。目前,针对CD81的mAb研究已取得了进展,主要用于研究CD81的表达和功能,特别是在病毒感染和癌症转移方面。例如,CD81是丙型肝炎病毒(HCV)进入细胞的重要受体,因此,针对CD81的入胞抑制剂具有巨大的研究价值。此外,CD81还与多种癌症相关的蛋白质(如CD19、CD44、EWI-2等)形成复合物,影响癌细胞的增殖、迁移和转移。其它四次跨膜蛋白,如CD3,CD20,CD37,CCR8,CD40L,CD48/NKG2D ligand等等,已成为抗肿瘤等疾病药物研发的重要靶点。期待在不久的将来,基于CD81的药物能够成功进入临床开发!
为鼎力协助各药企针对CD81在丙型肝炎病毒和癌症等疾病在临床中的研究,CUSABIO推出CD81活性蛋白(CSB-MP004960HU)和抗体(CSB-RA004960A0HU ; CSB-RA004960MA1HU)产品,助力您在CD81机制方面的研究或其潜在临床价值的探索。
j9九游会登录入口首页 CUSABIO CD81 蛋白
Recombinant Human CD81 antigen (CD81), partial (Active) Code: CSB-MP004960HUd7
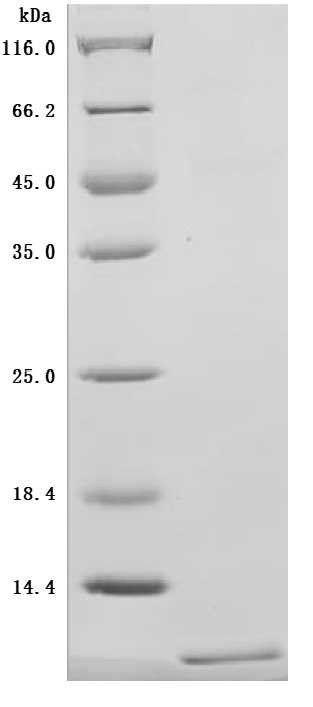
The high purity is greater than 95% as determined by SDS-PAGE.
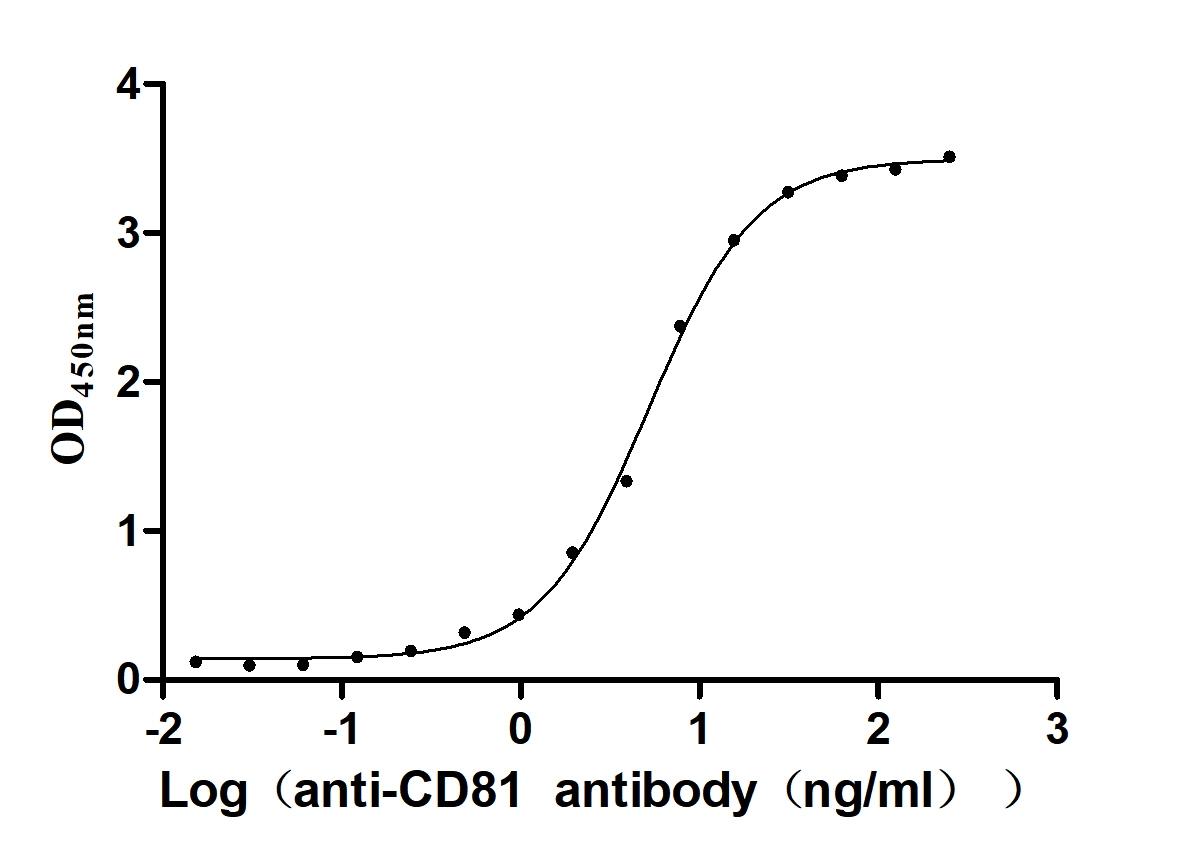
Immobilized Human CD81 at 2μg/mL can bind Anti-CD81 recombinant antibody(CSB-RA004960MA1HU). The EC50 is 4.166-5.578 ng/mL.
参考文献:
[1] Bailly, Christian, and Xavier Thuru. "Targeting of Tetraspanin CD81 with Monoclonal Antibodies and Small Molecules to Combat Cancers and Viral Diseases." Cancers 15.7 (2023): 2186.
[2] Fénéant, Lucie, Shoshana Levy, and Laurence Cocquerel. "CD81 and hepatitis C virus (HCV) infection." Viruses 6.2 (2014): 535-572.
[3] Koutsoudakis, George, et al. "The level of CD81 cell surface expression is a key determinant for productive entry of hepatitis C virus into host cells." Journal of virology 81.2 (2007): 588-598.
[4] Akazawa, Daisuke, et al. "CD81 expression is important for the permissiveness of Huh7 cell clones for heterogeneous hepatitis C virus infection." Journal of virology 81.10 (2007): 5036-5045.
[5] Inoue, G. A. K. U., N. O. R. I. O. Horiike, and M. O. R. I. K. A. Z. U. Onji. "The CD81 expression in liver in hepatocellular carcinoma." International journal of molecular medicine 7.1 (2001): 67-138.
[6] Bailly, Christian, and Xavier Thuru. "Targeting of Tetraspanin CD81 with Monoclonal Antibodies and Small Molecules to Combat Cancers and Viral Diseases." Cancers 15.7 (2023): 2186.
[7] Wünschmann, Sabina, et al. "Characterization of hepatitis C virus (HCV) and HCV E2 interactions with CD81 and the low-density lipoprotein receptor." Journal of virology 74.21 (2000): 10055-10062.
[8] Todros-Dawda, Izabela, et al. "The tetraspanin CD53 modulates responses from activating NK cell receptors, promoting LFA-1 activation and dampening NK cell effector functions." PLoS One 9.5 (2014): e97844.
[9] CHAN12, BOSCO MC, et al. "Integrin α2βΐ on rat myeloma cells modulates interaction of α4β1 integrin with vascular cell adhesion molecule-1 but not hbronectin." Cells, Proteins and Materials: Festschrift in Honor of the 65th Birthday of Dr. John L. Brash (2003): 119.
[10] Tippett, Emma, et al. "Characterization of tetraspanins CD9, CD53, CD63, and CD81 in monocytes and macrophages in HIV-1 infection." Journal of Leukocyte Biology 93.6 (2013): 913-920.
[11] Rubio, Karla, et al. "Extracellular vesicles induce aggressive lung cancer via non-canonical integrin-EGFR-KRAS signaling." bioRxiv (2022): 2022-08.
[12] Rubio, Karla, et al. "Non-canonical integrin signaling activates EGFR and RAS-MAPK-ERK signaling in small cell lung cancer." Theranostics 13.8 (2023): 2384.
[13] Guo Wenjie. Molecular mechanism of HHEX regulating integrin signaling pathway in lung cancer cells through CD81 [D]. Shandong University, 2021.
[14] Meertens, Laurent, et al. "The tight junction proteins claudin-1,-6, and-9 are entry cofactors for hepatitis C virus." Journal of virology 82.7 (2008): 3555-3560.
[15] Farquhar, Michelle J., et al. "Hepatitis C virus induces CD81 and claudin-1 endocytosis." Journal of virology 86.8 (2012): 4305-4316.
[16] Krieger, Sophie E., et al. "Inhibition of hepatitis C virus infection by anti‐claudin‐1 antibodies is mediated by neutralization of E2–CD81–Claudin‐1 associations." Hepatology 51.4 (2010): 1144-1157.
[17] Harris, Helen J., et al. "CD81 and claudin 1 coreceptor association: role in hepatitis C virus entry." Journal of virology 82.10 (2008): 5007-5020.
[18] Fofana, Isabel, et al. "Functional analysis of claudin-6 and claudin-9 as entry factors for hepatitis C virus infection of human hepatocytes by using monoclonal antibodies." Journal of virology 87.18 (2013): 10405-10410.
[19] Vences-Catalán, Felipe, et al. "CD81 as a tumor target." Biochemical Society Transactions 45.2 (2017): 531-535.
[20] Belov, Larissa, et al. "Extensive surface protein profiles of extracellular vesicles from cancer cells may provide diagnostic signatures from blood samples." Journal of extracellular vesicles 5.1 (2016): 25355.
[21] Li, Yandong, et al. "KLF4-mediated upregulation of CD9 and CD81 suppresses hepatocellular carcinoma development via JNK signaling." Cell death & disease 11.4 (2020): 299.
[22] Yoo, Tae-Hyoung, et al. "CD81 is a candidate tumor suppressor gene in human gastric cancer." Cellular Oncology 36 (2013): 141-153.
[23] Hong, In-Kee, et al. "The tetraspanin CD81 protein increases melanoma cell motility by up-regulating metalloproteinase MT1-MMP expression through the pro-oncogenic Akt-dependent Sp1 activation signaling pathways." Journal of Biological Chemistry 289.22 (2014): 15691-15704.
[24] Hong, In-Kee, et al. "Tetraspanin CD81/TAPA-1 up-regulates MT1-MMP involved in melanoma cell motility through Akt-dependent Sp1 activation signaling pathways." Cancer Research 70.8_Supplement (2010): 526-526.
[25] Vences-Catalán, Felipe, et al. "Tetraspanin CD81 promotes tumor growth and metastasis by modulating the functions of T regulatory and myeloid-derived suppressor cells." Cancer research 75.21 (2015): 4517-4526.
[26] Fan, Weijian, et al. "Human umbilical cord mesenchymal stem cell-derived exosomes promote microcirculation in aged diabetic mice by TGF-β1 signaling pathway." Diabetology & Metabolic Syndrome 15.1 (2023): 234.
[27] Xie, Xin-hui, et al. "Hyper-inflammation of astrocytes in patients of major depressive disorder: Evidence from serum astrocyte-derived extracellular vesicles." Brain, Behavior, and Immunity 109 (2023): 51-62.
[28] Ahmad, Sarfaraz, et al. "Chymase in Plasma and Urine Extracellular Vesicles: Novel Biomarkers for Primary Hypertension." medRxiv (2023): 2023-11.
[29] Benke, Márton, et al. "MiR-200b categorizes patients into pancreas cystic lesion subgroups with different malignant potential." Scientific Reports 13.1 (2023): 19820.
[30] Chen, Zhilong, et al. "Exosome-delivered circRNA circSYT15 contributes to cisplatin resistance in cervical cancer cells through the miR-503-5p/RSF1 axis." Cell Cycle (2023): 1-18.
上一篇: 细胞因子风暴和病毒感染 你必须知道的
下一篇: 了解肝炎 抗击肝炎











