纳米抗体,强大的新型抗体!
日期:2023-12-26 09:04:49
随着全球范围内COVID-19的爆发,我们迫切需要安全有效的抗病毒抗体作为对抗新冠病毒(SARS-CoV-2)的新药物和治疗选择。谈到治疗性抗体时,单克隆抗体(mAb)会浮现在我们的脑海中。确实,单克隆抗体(mAb)是制药业中最大且增长最快的领域之一。在SARS和MERS爆发期间,一些中和性单克隆抗体被开发出来,并确认其在治疗冠状病毒感染方面的潜力。然而,它们的临床应用仍受制于耗时昂贵的真核系统抗体生产过程。在这里,我们专注于一种针对mAb缺陷开发的新型抗体。这是一种由骆驼免疫球蛋白制成的单域抗体,也称为VHH或纳米抗体。那么,什么是纳米抗体?纳米抗体有哪些优势?
1. 纳米抗体的发现
纳米抗体(Nbs)以其小分子量和独特的分子结构而特点明显。这些特点使得它们在疾病诊断和治疗等许多领域中具有广泛的应用前景。
纳米抗体是在20世纪80年代被发现的。当时,两名大学生向比利时布鲁塞尔自由大学的免疫学教授Hamers抱怨实验课程的结果已经被知晓,不具有挑战性。于是,Hamers教授将冰箱中剩余的半升睡眠病骆驼血液交给了Muyldermans等人,告诉他们尝试从中提纯出骆驼抗体。Muyldermans等人惊讶地发现,从骆驼血液中提纯出的某些抗体并不属于所有脊椎动物的标准类型,而是一种全新的、更简单的变异抗体。这一结果让每个人都感到困惑。Hamers教授随即组建了一个研究团队,对这种抗体进行了专门的研究。从那时起,骆驼抗体从一个学生的实验迅速演变为Hamers教授及其同事研究的主要项目。在1993年,Hamers等人首次在《Nature》杂志上报告了骆驼和鲨鱼中存在一种天然缺乏轻链的重链抗体(HcAb)[1]。与传统的单克隆抗体相比,骆驼抗体除了缺少轻链外,在重链变异区和铰链区之间没有CH1区,只有一个重链变异区(VHH)和两个传统的CH2和CH3区。这个VHH被称为纳米抗体。关于纳米抗体的结构,我们将在下一节介绍。
2. 纳米抗体的定义
纳米抗体(Nbs),也称为VHH抗体,是一种来源于羊驼重链IgG抗体(HCAb)的单一变异区域抗体,位于重链上。Nbs通常被视为传统抗体的一种替代品,并且在生产和使用方面存在显著的差异,这些差异影响了它们的适用性。Nbs和传统抗体之间的主要区别与它们的结构和领域有关。如图1所示,传统抗体具有两个变异区域,分别称为VH和VL,它们相互提供稳定性和结合特异性。Nbs具有VHH领域并且缺少VL领域,但仍然具有很高的稳定性。缺少VL领域还意味着Nbs具有亲水性的一侧。
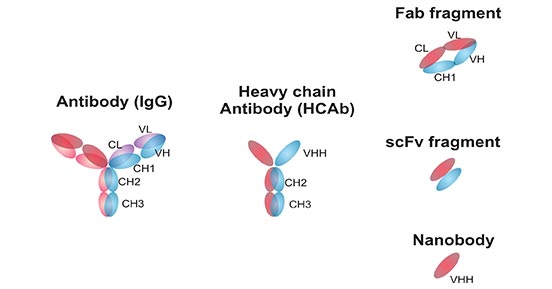
图1. 抗体和抗体片段的结构和示意图
*图片来源于发表在《肛门生物肛门化学》上的出版物 [2]
重链抗体的VHH片段与传统抗体的VH特性不同,但独立克隆和表达的VHH结构具有与原始重链抗体相当的结构稳定性和与抗原的结合活性,目前已知可以结合目标抗原的最小单位[3]。结构分析结果显示,VHH晶体宽度为2.5纳米,长度为4.8纳米,其分子量仅约为15KDa。
3. 纳米抗体的生产过程
纳米抗体(Nbs)越来越受到欢迎,作为研究试剂,越来越多的论文在文献中使用了Nbs。在2018年9月3日,EMA批准了赛诺菲公司的纳米抗体药物(Caplacizumab,又称Cablivi),用于治疗成人获得性血栓性血小板减少性紫癜(aTTP)。Cablivi成为首个特异性aTTP治疗药物,也是首个上市的纳米抗体药物。
随着首个纳米抗体药物的批准,如何大规模生产稳定的Nbs成为急需解决的问题。目前,免疫文库是生产Nbs的最常见选择。如图2所示,可以通过使用免疫原进行主动免疫或使用未免疫的驼科动物(如骆驼、单峰驼、美洲驼或羊驼)采集含有淋巴细胞的血液来获得遗传信息。一旦特定序列被扩增并插入克隆载体,就可以通过噬菌体展示技术进行筛选过程,以分离出最合适的Nbs,或使用其他方法,如细胞表面展示、mRNA/cDNA展示或质谱鉴定等方法[4]。进行这种筛选的最常用策略是基于噬菌体展示选择。
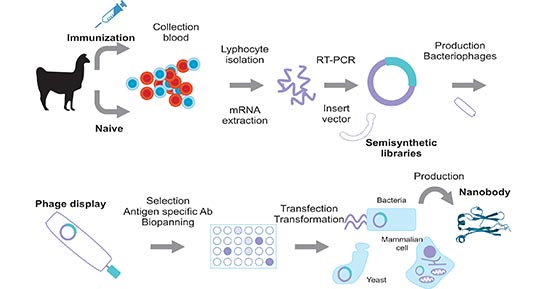
图2. 使用噬菌体展示库的纳米抗体生产方案
*图片来源于发表在《肛门生物肛门化学》上的出版物 [2]
4. 纳米抗体的优势
纳米抗体(Nbs)的独特特性使其在许多方面相比传统抗体具有显著优势。它们将单克隆抗体的理想特性与小分子药物的一些有益特性相结合。
Nbs在高温条件下具有很强的稳定性,能够保持生物活性,便于运输和储存。此外,Nbs在强酸和强碱条件下也很稳定,因此可以制备口服制剂,而传统抗体在高温、强酸和强碱条件下容易分解,需要低温储存[5] [6];
由于其结构特点,Nbs可以深入到抗原的内部[7],因此它们可以识别传统抗体无法接触到的抗原;
Nbs非常小,可以进入肿瘤组织内部完全清除肿瘤,还可以通过血脑屏障进入脑组织[8]。传统抗体的分子量是Nbs的十倍,组织渗透性较差;
Nbs的结构简单,可以在大肠杆菌和酵母等较简单的微生物系统中大规模生产,从而显著降低研发和生产成本,并解决抗体制品的大规模制备问题。
然而,Nbs作为体外诊断试剂仍存在一些障碍。由于Nbs的分子量较小,它们的结构在用于临床诊断试剂的开发之前需要进行修饰。然而,常用的结构修饰技术会对Nbs的生物活性产生负面影响,从而严重限制了纳米抗体产品的应用。
5. 纳米抗体的应用
Nbs具有许多有趣的应用,其中许多尚处于早期阶段的开发。这些应用包括基础研究和临床治疗。这些应用主要分为三个部分,涉及研究、诊断和治疗。
5.1 在研究中的纳米抗体应用
• Nbs作为亲和捕获试剂:与较大的抗体格式相比,由于其小尺寸和单一域格式,Nbs具有更高的亲和力结合表面和较低的非特异性背景结合。通过其单价的结合方式,它们可以在温和条件下被洗脱,其高稳定性允许重复使用[9] [10]。
• Nbs作为晶体化引导蛋白:由于Nbs能够将蛋白质锁定在特定构象中,稳定柔性结构域并将聚集表面屏蔽在溶剂中,因此Nbs在晶体化具有良好的表现[11] [12]。它们已在许多蛋白质晶体化研究中使用,并且这些相同的特性也被用来稳定淀粉样β前纤维和防止成熟淀粉样纤维的形成。
• 细胞内靶标成像和免疫调节:在细胞内起作用的抗体被称为“细胞内抗体”。由于Nbs在还原性细胞内环境中也能非常好地折叠成功能性实体,Nbs与融合的荧光蛋白一起在细胞内表达,可以用于跟踪其在活细胞中的抗原活性[13]。它们还可以用于功能性地敲除细胞中的抗原,并融合信号肽以定位到特定的亚细胞区域。
5.2 在诊断中的纳米抗体应用
• Nbs作为新型生物传感器中的探针:可以在医学、环境和食品分析领域中用于生物传感器。它们的特异性功能基序容易引入,其小尺寸允许高容量的结合表面,从而提高了灵敏度。
• 用于非侵入性体内成像的Nbs:由于其小尺寸,Nbs可用作非侵入性分子成像的示踪剂,用于研究疾病过程,可实现快速组织穿透和血液清除。
5.3 在治疗中的纳米抗体应用
• Nbs在抗毒素治疗中的应用:目前正在使用多克隆免疫球蛋白片段制备抗毒素,其效力低且不稳定。此外,它们还具有严重的不良影响。Nbs的小尺寸使它们可以在体内扩散,并与小毒素的生物分布相匹配,当纳米抗体捕获毒素后,复合物仍然足够小,可以通过肾脏迅速排除。
• 抗感染的纳米抗体:可以作为抗细菌、病毒和寄生虫感染的药物进行开发。针对呼吸道合胞病毒的Nbs的I期临床试验表明,Nbs可以抵抗感染。Nbs不具有传统抗体的Fc区域,因此它们不会中和和消除病原体。然而,它们具有自身固有的中和作用。
• 基于免疫的治疗中的Nbs:可以通过抑制配体-受体相互作用,如拮抗抗von Willebrand因子以阻止血栓形成的启动,或抑制抗TNF-α以治疗关节炎等方式,用于对抗癌症和其他疾病。
6. 纳米抗体在SARS-CoV-2治疗中的最新进展
在本部分,我们收集了几个关于纳米抗体在SARS-CoV-2治疗中的最新研究进展,如下所示:
• 2020年5月5日,Jason S. McLellan等人在《Cell》杂志上发表了题为“Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid Antibodies”的研究。该研究发现,他们从用预稳定的冠状病毒棘蛋白免疫的骆驼体内分离出了单域抗体(VHHs)。这些VHHs能够中和中东呼吸综合症冠状病毒(MERS-CoV)或严重急性呼吸综合症冠状病毒1(SARS-CoV-1)的S假型病毒。该研究还表明,针对SARS-CoV-1 S的VHH和SARS-CoV-2 S之间存在交叉反应,并证明这种交叉反应的VHH以双价人类IgG Fc融合体的形式中和了SARS-CoV-2 S假型病毒。这些研究结果为通过VHH中和致病性冠状病毒提供了分子基础,并暗示这些分子在冠状病毒爆发期间可能作为有用的治疗药物[14]。
• 2020年5月14日,中国复旦大学的研究人员在《Cell Host & Microbe》杂志上在线发表了题为“Identification of Human Single-Domain Antibodies against SARS-CoV-2”的论文。研究人员成功建立了一个噬菌体展示的人类单域抗体文库。这个多功能平台可以迅速分离人类纳米抗体(Nbs)并筛选SARS-CoV-2抗体。Nbs不仅可以单独使用,还可以与其他抗体合作;小尺寸的特性也成为构建双特异性或多特异性抗体的理想模块,有效防止病毒逃逸突变的出现以及许多其他优势。因此,这些全人源纳米抗体有望成为临床治疗COVID-19的有效预防和治疗药物[15]。
• 2020年6月6日,中国的一个科研团队在《Cell》杂志上在线发表了题为“Development of an inactivated vaccine candidate, BBIBP-CorV, with potent protection against SARS-CoV-2”的研究。他们报告了一种规模试验性生产的灭活SARS-CoV-2疫苗候选剂(BBIBP-CorV),该疫苗能够在小鼠、大鼠、豚鼠、兔子和非人灵长类动物中诱导高水平的中和抗体效价,从而提供对SARS-CoV-2的保护。此外,BBIBP-CorV在疫苗制造方面具有高效的生产能力和良好的遗传稳定性。这些结果支持进一步在临床试验中评估BBIBP-CorV的价值[16]。
参考文献:
[1] Hamers-Casterman, C., T. Atarhouch, et al. Naturally occurring antibodies devoid of light chains [J]. Nature. 1993, 363:446-448.
[2] J.-Pablo Salvador & Lluïsa Vilaplana. Nanobody: outstanding features for diagnostic and therapeutic applications [J]. Bioanal Chem. 2019.
[3] Cui Li, Zhuoran Tang, et al. Natural Single-Domain Antibody-Nanobody: A Novel Concept in the Antibody Field [J]. J Biomed Nanotechnol. 2018. 14:1-19.
[4] Liu W, Song H, et al. Recent advances in the selection and identification of antigen-specific nanobodies [J]. Mol Immunol. 2018, 96:37–47.
[5] Perez JM, Renisio JG, et al. Thermal unfolding of a llama antibody fragment: a two-state reversible process [J]. Biochemistry. 2001, 40(1):74–83.
[6] Dumoulin M, Conrath K, et al. Single-domain antibody fragments with high conformational stability [J]. ProteinSci. 2002, 11(3):500–15.
[7] Conrath KE, Lauwereys M, et al. Beta-lactamase inhibitors derived from single-domain antibody fragments elicited in the Camelidae [J]. Antimicrob Agents Chemother. 2001, 45(10):2807–2812.
[8] McMurphy T, Xiao R, et al. The anti-tumor activity of a neutralizing nanobody targeting leptin receptor in a mouse model of melanoma [j]. PLoS One. 2014, 9(2):e89895.
[9] Verheesen P, Ten Haaft MR, et al. Beneficial properties of single-domain antibody fragments for application in immunoaffinity purification and immuno-perfusion chromatography [J]. Biochim. Biophys. Acta. 2003, 1624(1–3), 21–28.
[10] Gholamreza HassanzadehGhassabeh, Nick Devoogdt, et al. Nanobodies and their potential applications [J]. Nanomedicine. 2013, 8(6): 1013–1026.
[11] Baranova E, Fronzes R, et al. SbsB structure and lattice reconstruction unveil Ca2+ triggered S-layer assembly. Nature. 2012, 487(7405):119–122.
[12] Rasmussen SGF, Choi H-J, et al. Structure of a nanobody-stabilized active state of the beta(2) adrenoceptor [J]. Nature. 2011, 469(7329): 175–180.
[13] Ries J, Kaplan C, et al. A simple, versatile method for GFPbased super-resolution microspcopy via nanobodies [J]. Nat. Methods. 2012, 9(6), 582–584.
[14] Daniel Wrapp, Dorien De Vlieger, et al. Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid Antibodies [J]. Cell. 2020, 181(5): 1004-1015.
[15] Yanling Wu, Cheng Li, et al. Identification of Human Single-Domain Antibodies against SARS-CoV-2 [J]. Cell Host & Microbe. 2020, 27(6):891-898.
[16] Hui Wang, Yuntao Zhang, et al. Development of an inactivated vaccine candidate, BBIBP-CorV, with potent protection against SARS-CoV-2 [J]. Cell. 2020.











