蛋白激酶概述: 定义、类型、功能、激活机制等
日期:2024-01-31 09:01:35
1978年,第一个癌基因Rous肉瘤病毒(v-Src)的转化因子被证明是一种蛋白激酶。1981年,人们发现PKC可被肿瘤促进剂磷脂醇 12-肉豆蔻酸13-乙酸酯(PMA)激活。这些发现证明了蛋白质磷酸化在疾病发病机制中的重要作用,并为针对蛋白激酶/磷酸酶的药物开发打开了大门。
本文将介绍蛋白激酶的定义、类型、功能和研究。
1. 什么是蛋白激酶?
蛋白激酶(PKs)属于激酶家族,是一种磷酸转移酶,负责将ATP中的γ-磷酸转移到底物蛋白质的特定氨基酸残基上。这一过程被称为蛋白质磷酸化,它是一个可逆的动态过程,由蛋白激酶和磷酸酶的竞争活动调节。在真核生物中,磷酸化主要发生在蛋白质的Ser和Thr残基上,也发生在Tyr残基上。
蛋白激酶具有相似的三维催化结构域。催化结构域由250到300个氨基酸组成,包括一个较大(通常为 α-螺旋状的C端子域和一个较小(通常为 β-片状)的N端子域 [1][10]。N 端和C端由肽支架连接,形成一个深槽,使肽底物和ATP分子能够结合。ATP结合区可根据ATP结合情况和酶的活化状态旋转成“开”和“关”两种构象 [2]。
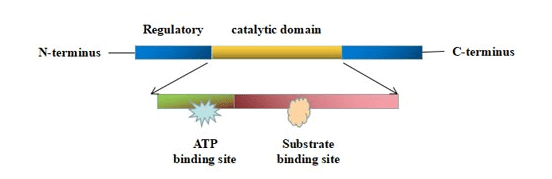
图1. 蛋白激酶的结构
此外,蛋白激酶还具有非催化结构域,可以连接底物和招募其他信号蛋白。
2. 蛋白激酶有哪些类型?
蛋白激酶按其磷酸化的氨基酸残基可分为五大类,包括丝氨酸/苏氨酸蛋白激酶(ST-PKs)、酪氨酸蛋白激酶(TKs)、组氨酸特异性激酶、双重特异性蛋白激酶和天冬氨酸/谷氨酸特异性蛋白激酶。
2.1 丝氨酸/苏氨酸蛋白激酶
丝氨酸/苏氨酸蛋白激酶是一个庞大的蛋白激酶家族,主要包括以下激酶:细胞周期蛋白依赖性激酶、丝裂原活化蛋白激酶、蛋白激酶D、纳豆激酶、DNA依赖性蛋白激酶和极光蛋白激酶以及胰激肽原酶。
图2. 钙/钙调蛋白依赖性蛋白激酶的晶体结构
细胞周期蛋白依赖性激酶: 细胞周期蛋白依赖性激酶(CDKs)是丝氨酸/苏氨酸激酶。CDKs亚基需要与相应的细胞周期蛋白结合才能激活。激活的CDKs具有蛋白激酶活性,能使不同的底物蛋白磷酸化,从而启动或调节细胞周期。
CDK 在细胞周期调控网络中起着核心作用,其主要生物学作用是调控细胞周期的不同阶段,从G1、S、G2到M期,并完成整个周期 [3]。
CDKs激活的底物主要包括视网膜胶质瘤蛋白、肿瘤抑制基因p107、p103等,具有促进细胞周期相变、启动DNA合成、运行细胞分裂、促进细胞周期运转等重要功能。CDK还参与调控神经细胞的转录、mRNA处理和分化。
表 1:模式生物中控制细胞周期的细胞周期蛋白依赖性激酶
| 物种 | 激酶 | 原名 | 功能 |
|---|---|---|---|
| 酿酒酵母(Saccharomyces cerevisiae) | Cdk1 | Cdc28 | All cell-cycle stages |
| 酿酒酵母(Schizosaccharomyces pombe) | Cdk1 | Cdc2 | All cell-cycle stages |
| 黑腹果蝇(Drosophila melanogaster) | Cdk1 | Cdc2 | M |
| Cdk2 | Cdc2c | G1/S, S, possibly M | |
| Cdk4 | Cdk4/6 | G1, promotes growth | |
| Xenopus laevis | Cdk1 | Cdc2 | M |
| Cdk2 | / | S, possibly M | |
| 人(Homo sapiens) |
Cdk1 | Cdc2 | M |
| Cdk2 | / | G1, S, possibly M | |
| Cdk4 | / | G1 | |
| Cdk6 | / | G1 |
表格信息来源于维基百科
丝裂原活化蛋白激酶: 有丝分裂原激活蛋白激酶(MAPK)是细胞中的一类丝氨酸/苏氨酸蛋白激酶,是控制胚胎发生、细胞分化、细胞增殖和细胞死亡的重要组成部分。MAPK参与引导细胞对各种刺激(如有丝分裂原、渗透压、热休克和促炎细胞因子)的反应。
有丝分裂原活化蛋白激酶的基本形态没有催化作用,需要磷酸化激活。MAP激酶受磷酸化级联调节。它受由MAP激酶、MAPK激酶和MAPKK激酶组成的三级级联调节 [4]。然而,每种 MAPK 激酶都可以被一种以上的 MAPKK 激酶激活,从而增加了MAPK信号的复杂性和多样性。
哺乳动物至少能表达四组不同的MAPK: 细胞外信号相关激酶(ERK)-1/2;Jun N端激酶(JNK1/2/3);p38蛋白(p38α/ß/γ/δ);ERK5。这些蛋白由特定的MAPKKs激活: ERK1/2由MEK1/2激活,p38由MKK3/6激活,ERK5由MKK4/7(JNK1/2)激活,ERK5由MEK5激活。
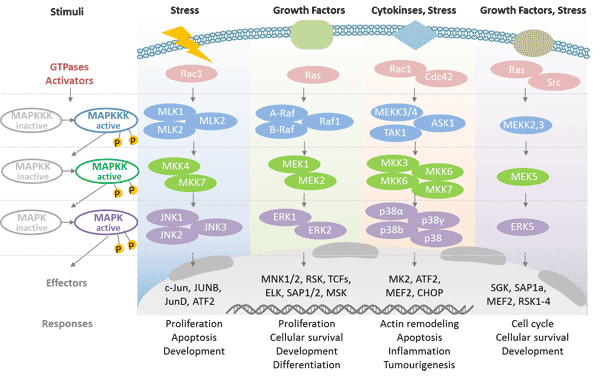
图3. MAPK的级联调控
蛋白激酶D:它属于一类新的Ser/Thr蛋白激酶,由蛋白激酶 C(PKC)激活。PKD参与调控细胞功能,如细胞高尔基反向膜转运、细胞生长、增殖、迁移、分化和凋亡 [5]。
● PKD与心血管:PKD可保护心肌,减少钙超载对心肌细胞的损伤 [6]。激活PKD可增强心肌收缩力 [7]。
● PKD与神经元:PKD影响海马神经元中转铁蛋白受体(TFR)和低密度受体相关蛋白(LRP)的转运。
● PKD与免疫调节:PKD还参与调节炎症因子的释放。
● PKD与肿瘤细胞:PKD可通过调节基质金属蛋白酶(MMP)的表达来促进肿瘤的侵袭和转移。
胰激肽原酶 胰激肽原酶是人体内激肽酶家族中的一种蛋白水解酶。PK酶可通过激肽改善感觉或运动神经的传导速度,抑制血小板聚集,防止血栓形成,扩张血管,增强微循环,减轻缺血和缺氧 [8]。PKase与前列腺素E1(PGE1)在改善糖尿病周围神经病变(DPN)的病理变化和改善2型糖尿病患者的神经功能方面具有相同的功效。因此,PKase将成为治疗糖尿病神经病变的潜在新药 [9]。
2.2 酪氨酸激酶
酪氨酸激酶分为非受体酪氨酸蛋白激酶(NRTKs)、受体酪氨酸激酶(RTKs)和核酪氨酸蛋白激酶。
● 非受体酪氨酸蛋白激酶(NRTKs)
非受体酪氨酸蛋白激酶的重要结构域主要有 SH1、SH2、SH3、PH、PTB 等,它们在激酶的催化反应、酶定位、活性调控以及与其他分子的相互作用中发挥着重要作用。
非受体酪氨酸蛋白激酶分为11个家族,至少有30个成员。它们介导各种生长因子受体、细胞因子受体、淋巴细胞抗原受体和粘附分子整合素的信号转导。
非受体酪氨酸蛋白激酶主要包括:
- SRC 激酶家族:原癌基因c-Src的产物,参与抗原受体、细胞因子受体和整合素介导的跨膜信号传导。
- JAK 激酶家族(Janus 激酶):包括JAK1、JAK2、JAK3和TYK2。它们主要介导细胞因子受体的跨膜信号转导。
- Sky/ZAP-70家族:包括Sky和zeta链相关蛋白-70。它介导淋巴细胞抗原受体和某些细胞因子受体的信号转导,在淋巴细胞分化、发育和活化过程中具有重要作用。
此外,受体酪氨酸蛋白激酶还包括CSK家族、Tec家族和粘附斑块激酶家族等。最后,我们总结了非受体酪氨酸蛋白激酶,并将其列于表2中。
表2:非受体酪氨酸蛋白激酶
| 家族 | 激酶 |
|---|---|
| ABL family | ABL1, ARG |
| ACK family | ACK1, TNK1 |
| CSK family | CSK, MATK |
| FAK family | FAK(PTK2), PYK2 |
| FES family | FES, FER |
| FRK family | FRK, PTK6(BRK), SRMS |
| JAK family | JAK1, JAK2, JAK3, TYK2 |
| SRC family | SRC, FGR, FYN, YES1, BLK, HCK, LCK, LYN |
| TEC family | TEC, BMX, BTK, ITK, TXK |
| SYK family | SYK, ZAP70 |
● 受体酪氨酸激酶(RTK)
是许多多肽生长因子、细胞因子和激素的高亲和性细胞表面受体。目前已发现约20种不同的RTK类别。
表3: 受体酪氨酸激酶
| 分类 | 受体家族 | 激酶 |
|---|---|---|
| RTK class I | EGF receptor family | EGFR, ERBB2, ERBB3, ERBB4 |
| RTK class II | Insulin receptor family | INSR |
| RTK class III | PDGF receptor family | PDGFRA, PDGFRB |
| RTK class IV | VEGF receptors family | VEGFR1(FLT1), VEGFR2(KDR), VEGFR3(FLT4) |
| RTK class V | FGF receptor?family | FGFR1, FGFR2, FGFR3, FGFR4, FGFRL1 |
| RTK class VI | CCK receptor family | CCKAR, CCKBR |
| RTK class VII | NGF receptor family | NGFR |
| RTK class VIII | HGF receptor family | MET |
| RTK class IX | Eph receptor family | EPHA1, EPHA2, EPHA3, EPHA4, EPHA5, EPHA6, EPHA7, EPHA8, EPHA9, EPHA10, EPHB1, EPHB2, EPHB3, EPHB4, EPHB5, EPHB6 |
| RTK class X | AXL receptor family | AXL |
| RTK class XI | TIE receptor family | TIE1,TIE2 |
| RTK class XII | RYK receptor family | RYK |
| RTK class XIII | DDR receptor family | DDR1, DDR2 |
| RTK class XIV | RET receptor family | RET |
| RTK class XV | ROS receptor family | ROS1 |
| RTK class XVI | LTK receptor family | LTK |
| RTK class XVII | ROR receptor family | ROR1, ROR2 |
| RTK class XVIII | MuSK receptor family | MUSK |
| RTK class XIX | LMR receptor | LMTK2 |
| RTK class XX | Undetermined | / |
● 核酪氨酸蛋白激酶
涉及转录过程和细胞周期的调节。
2.3 组氨酸特异性蛋白激酶
组氨酸蛋白激酶是一种使底物蛋白中的组氨酸磷酸化的激酶,主要包括双组分组氨酸蛋白激酶,它可以调节对环境刺激的反应。
双组分哺乳动物组氨酸蛋白激酶:支链α-酮酸脱氢酶激酶(BCKDHK)和丙酮酸脱氢酶激酶(PDHK)。
2.4 双特异性蛋白激酶
双特异性蛋白激酶具有双特异性激酶活性,既可为丝氨酸/苏氨酸激酶,也可为酪氨酸激酶。
2.5 天冬氨酸/谷氨酸特异性蛋白激酶
蛋白质的酰基是磷受体。天冬氨酸/谷氨酸特异性蛋白激酶可将天冬氨酸/谷氨酸磷酸化。
3. 蛋白激酶的功能?
蛋白激酶通过磷酸化目标蛋白,在细胞内发挥分子开关的动态调节功能。它们在细胞信号传导、细胞代谢调节和其他重要的细胞功能中形成了一个纵横交错的网络。
蛋白激酶磷酸化是真核生物中最常见、最重要的翻译后修饰之一。它在生物体的基因表达、细胞增殖、分化、凋亡、信号转导、免疫调节、新陈代谢、运动、膜转运、肿瘤发生等各个方面发挥着重要作用。
蛋白激酶主要通过两种方式调控信号转导。一种是通过磷酸化调节蛋白质的活性。另一种是通过蛋白质的逐步磷酸化放大信号,从而引起细胞对外界刺激的反应。
4. 蛋白激酶如何被激活?
蛋白激酶是通过其催化环的磷酸化激活的,而催化环的磷酸化又会激活一连串事件,导致亚基的不同氨基酸发生磷酸化。
与其他蛋白质的相互作用控制着蛋白激酶的活性。这可能发生在多个蛋白激酶之间的多层蛋白激酶级联过程中。其他蛋白质与蛋白质之间的相互作用,如涉及 Ca2+/钙调蛋白激酶的相互作用,则以依赖第二信使或受体-配体相互作用的方式调节激酶的活性。第三相互作用是噬蛋白酶对目标蛋白磷酸化水平的调节,噬蛋白酶是蛋白激酶的功能拮抗剂。
亚细胞定位在决定蛋白激酶的活性和特定物理功能方面起着重要作用。蛋白激酶的氨基酸序列基序或与激酶活性相关的其他蛋白质可能决定了蛋白激酶的亚细胞分布。
5. 蛋白激酶与疾病研究
蛋白激酶通过调节底物蛋白的活性、相互作用和稳定构象,间接调控细胞功能,在细胞信号传导途径、免疫反应、细胞周期调节和能量平衡等方面发挥着关键作用。
一旦磷酸化过程出现异常,相关的信号通路就会出现功能障碍。因此,蛋白质磷酸化异常与多种疾病相关,从癌症 [11] 到炎症性疾病、糖尿病并发症 [12] 、感染性疾病、神经系统疾病、神经退行性疾病 [13] 和心脏功能障碍 [14]。
CDK 的异常表达可导致消化系统肿瘤和 [15] 血液系统肿瘤,如骨髓增生异常综合征(MDS)和急性粒细胞白血病(AML)。此外,CDK 的异常表达还见于乳腺肿瘤 [16]和其他恶性肿瘤,如肺癌 [17]、食管鳞状细胞癌 [18]、恶性黑色素瘤、脂肪肉瘤 [19]、髓母细胞瘤 [20]和前列腺癌。
蛋白激酶突变导致的疾病可通过靶向特定蛋白激酶进行治疗。蛋白激酶已成为治疗疾病的药物靶点 [21],美国食品和药物管理局(FDA)已批准多种蛋白激酶抑制剂用于癌症治疗。不同的蛋白激酶抑制剂用于不同的蛋白激酶。
蛋白酶抑制剂已被用于治疗类风湿性关节炎(RA)。目前的蛋白酶抑制剂主要是非受体酪氨酸激酶(JAK)抑制剂、脾脏酪氨酸激酶(Syk)抑制剂、丝裂原活化蛋白激酶 p38 抑制剂 [22][23]。此外,一些研究人员发现,蛋白激酶是控制肥胖和糖尿病的开关。
由于酪氨酸激酶在细胞中的信号传导作用,它也是一个重要的药物靶点 [24]。目前使用的抗肿瘤 PTK 抑制剂主要是嘧啶类化合物、蛋白肽 PTK 抑制剂和萜类化合物。此外,胸苷激酶 1(TK1)已被证明在肿瘤的早期检测、疗效评估和预后判断中具有重要作用。
参考文献:
[1] Taylor SS, Radzio-Andzelm E. Three protein kinase structures define a common motif [J]. Structure. 1994;2:345–355.
[2] Sowadski JM, Epstein LF, Lankiewicz L, Karlsson R. Conformational diversity of catalytic cores of protein kinases [J]. Pharmacol Ther. 1999;82:157–164.
[3] Schlegel U, Schmidt-Wolf I G H, Deckert M. Primary CNS lymphoma: clinical presentation, pathological classification, molecular pathogenesis and treatment [J]. Journal of the Neurological Sciences, 2000, 181(1): 1-12.
[4] Chang L, Karin M. Mammalian MAP kinase signalling cascades [J]. Nature, 2001, 410(6824): 37-40.
[5] Wang Q J. PKD at the crossroads of DAG and PKC signaling [J]. Trends in Pharmacological Sciences, 2006, 27(6): 317-323.
[6] Koncz P, Szanda G, Fülöp L, et al. Mitochondrial Ca uptake is inhibited by a concerted action of p38 MAPK and protein kinase D [J]. Cell Calcium, 2009, 46(2): 122-129.
[7] Bardswell S C, Cuello F, Rowland A J, et al. Distinct Sarcomeric Substrates Are Responsible for Protein Kinase D-mediated Regulation of Cardiac Myofilament Ca2+ Sensitivity and Cross-bridge Cycling [J]. Journal of Biological Chemistry, 2010, 285(8): 5674.
[8] Ye L, Zhang S, Greder L, et al. Effective Cardiac Myocyte Differentiation of Human Induced Pluripotent Stem Cells Requires VEGF [J]. Plos One, 2013, 8(1): e53764.
[9] Jin Y P, Su X F, Li H Q, et al. The Therapeutic Effect of Pancreatic Kininogenase on Treatment of Diabetic Peripheral Neuropathy in Patients with Type 2 Diabetes [J]. Experimental & Clinical Endocrinology & Diabetes, 2016, 124(10): 618-621.
[10] Hanks S K, Quinn A M. Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members [J]. Methods in Enzymology, 1991, 200(200): 38-62.
[11] Liu X, Winey M. The MPS1 family of protein kinases [J]. Annual Review of Biochemistry, 2012, 81(81): 561.
[12] Geraldes P, King G L. Activation of protein kinase C isoforms and its impact on diabetic complications [J]. Circulation Research, 2010, 106(8): 1319-1331.
[13] Su S C, Tsai L H. Cyclin-Dependent Kinases in Brain Development and Disease [J]. Annual Review of Cell & Developmental Biology, 2011, 27(1): 465.
[14] Young L H, Zaha V G. AMP-activated Protein Kinase Regulation and Biological Actions in the Heart [J]. Circulation Research, 2012, 111(6): 800-814.
[15] Al-Aynati M M, Radulovich N, Ho J, et al. Overexpression of G1-S cyclins and cyclin-dependent kinases during multistage human pancreatic duct cell carcinogenesis [J]. Clinical Cancer Research, 2004, 10(19): 6598.
[16] Lucas J J, Domenico J, Gelfand E W. Cyclin-dependent kinase 6 inhibits proliferation of human mammary epithelial cells [J]. Molecular Cancer Research Mcr, 2004, 2(2): 105.
[17] Sun Y, Tang J. Expression of Cyclin E and CDK5 in lung cancer [J]. Journal of Dalian Medical University, 2003, 25: 4-6.
[18] Nozoe T, Takahashi I, Baba H, et al. Relationship between intracellular localization of p34 cdc2, protein and differentiation of esophageal squamous cell carcinoma [J]. Journal of Cancer Research & Clinical Oncology, 2005, 131(3): 179-183.
[19] Hostein I, Pelmus M, Aurias A, et al. Evaluation of MDM2 and CDK4 amplification by real-time PCR on paraffin wax-embedded material: a potential tool for the diagnosis of atypical lipomatous tumours/well-differentiated liposarcomas [J]. Journal of Pathology, 2004, 202(1): 95-102.
[20] Mendrzyk F, Radlwimmer B, Joos S, et al. Genomic and protein expression profiling identifies CDK6 as novel independent prognostic marker in medulloblastoma [J]. Journal of Clinical Oncology, 2005, 23(34): 8853-8862.
[21] Sebolt-Leopold J S, English J M. Mechanisms of drug inhibition of signaling molecules [J]. Nature, 2006, 441(7092): 457-62.
[22] Goldstein D M, Gabriel T. Pathway to the clinic: inhibition of P38 MAP kinase. A review of ten chemotypes selected for development [J]. Current Topics in Medicinal Chemistry, 2005, 5(10).
[23] Gracie J A, Leung B P, Mcinnes I B. Novel pathways that regulate tumor necrosis factor-α production in rheumatoid arthritis [J]. Current Opinion in Rheumatology, 2002, 14(3): 270.
[24] Rask-Andersen M, Zhang J, Fabbro D, et al. Advances in kinase targeting: current clinical use and clinical trial [J]. Trends in Pharmacological Sciences, 2014, 35(11): 604-620.
上一篇: 表观遗传组蛋白修饰途径
下一篇: 蛋白质翻译后修饰(PTM)











