探索神经退行性变:研究者全面指南
日期:2024-06-12 12:08:40
"神经退行性"一词由前缀"neuro-"表示与神经或神经系统的联系,"-degeneration"在这种情况下指的是从较高到较低效能、活力或本质质量水平下降的过程。因此,神经退行性包括任何神经系统或神经细胞经历功能丧失、结构丧失或两者兼有的病理状况。
1. 什么是神经退行性?
神经退行性(ND)是一种现象,表现为特定脑区的神经元细胞功能和结构的缓慢和进行性丧失,这是包括阿尔茨海默病(AD)、帕金森病(PD)、肌萎缩侧索硬化症(ALS)、亨廷顿病(HD)等在内的各种神经退行性疾病(NDD)的主要病理生理特征。
2. 四种经典的神经退行性疾病
神经退行性疾病涉及进行性神经元死亡和神经功能障碍,导致逐渐增加的残疾、认知能力如记忆和决策能力的下降,以及运动功能如行走、书写和吞咽,或两者的结合,具体取决于特定疾病。神经退行性疾病通常逐渐发展,通常持续数年才达到终末阶段。这里介绍四种经典的神经退行性疾病:
阿尔茨海默病的两个主要病理特征包括大脑中外细胞的弥漫性和神经炎性β-淀粉样斑块的沉积,以及细胞内超磷酸化tau神经纤维缠结的形成 [1,2]。Aβ的产生和清除之间的不平衡,以及含有tau的神经纤维缠结(NFT)的形成,破坏了神经元和突触的正常功能,最终导致记忆、判断、决策、对周围环境的意识和独立自我照顾能力的逐渐恶化。
帕金森病有两个主要病理特征:黑质致密部(SNpc)中含多巴胺的神经黑素细胞的逐渐丧失,以及残存神经元细胞质中含α-突触核蛋白的Lewy体的存在 [3]。这些变化导致身体主要肌肉的震颤、肌强直和运动迟缓/运动不能。
ALS的特点是条纹肌逐渐减弱和瘫痪,这是由于大脑和脊髓中的上、下运动神经元的病理性退化所致。病理标志是细胞内蛋白聚集体的积累,其中最丰富的蛋白是TAR DNA结合蛋白43 [4, 5]。
在亨廷顿病中,含mHTT的包涵体导致神经元的退化和丧失,特别是在纹状体中,影响身体的主要肌肉,导致严重的运动限制和最终死亡 [6]。
| 神经退行性疾 | 神经病理学标志 | 风险因素 |
|---|---|---|
| Alzheimer's disease | Neuroinflammation, neuronal loss, neurofibrillary tangles, Aβ plaques | Family history, age, history of head trauma, genetics, environment factors, female gender, vascular risk factors |
| Parkinson's disease | Frontal cortex atrophy and ventricular enlargement, α-synuclein-containing Lewy bodies, and loss of dopaminergic neurons | Age, factor in the environment, male gender genetics, psychiatric symptoms ethnicity [7,8] |
| Amyotrophic lateral sclerosis | TAR DNA-binding protein 43 aggregations | Familial aggregation Physical activity, occupational and environmental exposure (for example, to pesticides, solvents, or heavy metals), genetics, head injury, and smoking |
| Huntington's disease | neuronal loss, psychiatric symptoms, striatal atrophy | Genetic mutation in HTT, inheritance |
神经退行性疾病共享共同的标志,包括病理性蛋白聚集、突触和神经网络缺陷、异常蛋白质稳态、细胞骨架异常、能量和稳态改变、DNA和RNA缺陷、炎症和神经元细胞死亡 [9]。
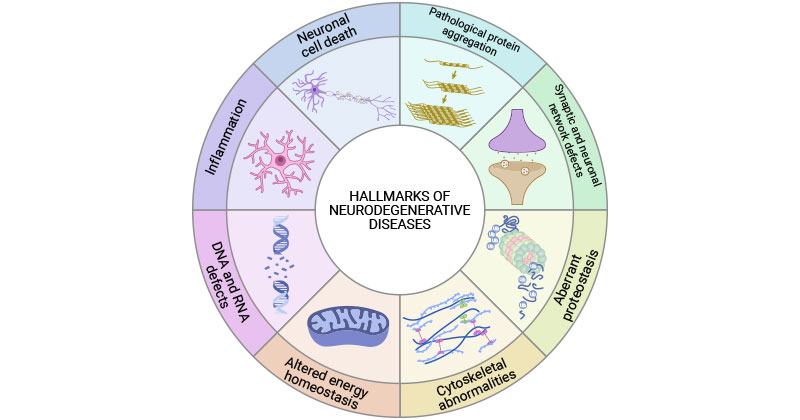
图1. 神经退行性疾病的共同标志
这张图片引用自:https://www.sciencedirect.com/science/article/pii/S0092867422015756
3. 神经退行性的共同病理机制
神经退行性是一个复杂的过程,受遗传、环境和与衰老相关的内源性因素影响。然而,确切的病理作用和潜在的分子机制仍未完全理解。
神经退行性背后的共同病理机制包括环境因素、代谢应激、遗传贡献、神经血管耦合和神经炎症。
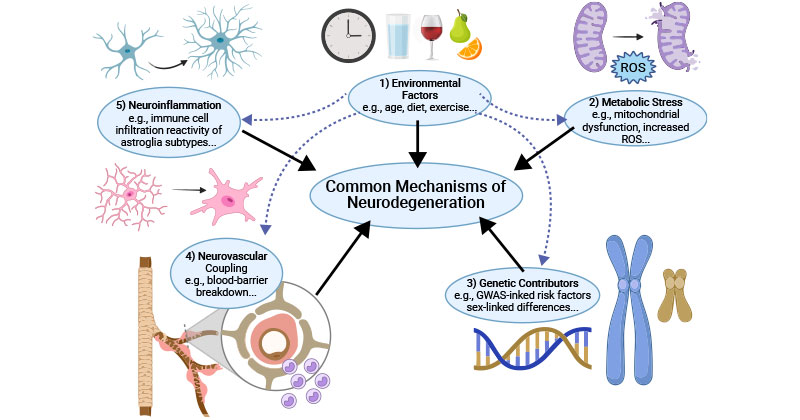
图2. 神经退行性的共同机制
这张图片引用自:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8935795/
3.1 环境因素
年龄、饮食、运动和暴露于神经毒素等环境因素,可以触发或加剧潜在的神经退行性事件,包括蛋白质错误折叠和聚集、线粒体功能障碍、氧化应激和炎症。年龄是一个主要的风险因素,由有丝分裂后细胞组成的组织,如大脑和视网膜中的神经元,特别容易受到衰老的影响。饮食和运动越来越被认为是维持中枢神经系统(CNS)健康的关键要素 [10]。
3.2 代谢应激
代谢应激的特征是能量代谢中断和氧化应激增加。易退化的神经元需要更高的能量水平来维持它们的结构和功能完整性。因此,能量代谢的任何干扰都能产生巨大的能量需求,最终导致细胞应激 [11]。
线粒体高度动态调节以满足神经元的代谢需求。线粒体功能障碍或遗传突变改变线粒体动力学,将对神经元产生灾难性影响。线粒体功能障碍主要由于在线粒体在氧化能量代谢中的关键作用,导致代谢应激。增加的ATP产生导致更高的活性氧(ROS)产生。
抗氧化物不足、清除酶受损和线粒体功能障碍可以引起氧化应激,影响线粒体DNA(mtDNA),导致线粒体质量控制和电子传递链酶异常,从而引起代谢缺陷。
3.3 遗传贡献
在某些情况下,特定的基因突变直接与神经退行性疾病的发展相关。例如,APP、PSEN1和PSEN2基因的突变与家族性阿尔茨海默病相关,而HTT基因的突变导致亨廷顿病。
某些遗传变异或多态性可能会增加个体对神经退行性疾病的敏感性,而不会直接引起疾病。例如,APOE4是AD和帕金森病痴呆(PDD)的共同风险因素。这些遗传风险因素通常通过全基因组关联研究识别,有助于遗传和环境影响的复杂相互作用。
许多神经退行性疾病是多基因的,涉及多个具有小个体效应的基因 [12]。这些遗传变异的累积影响,连同环境因素,有助于个体的整体风险。
在中枢神经系统(CNS)中,性别差异源于由性腺激素及其与性染色体上转录基因产物的相互作用引起的长期和短期表观遗传改变 [13,14]。性激素和性染色体都有助于CNS对疾病和衰老的反应。
3.4 神经血管耦合
神经血管耦合(NVC)是细胞协调增强脑血流量(CBF)以满足神经元活动期间升高的代谢需求的过程。NVC对神经生理健康至关重要。NVC由多种细胞类型共同介导,统称为神经血管单元(NVU),包括血管细胞、胶质细胞和神经元,它们维持血脑屏障(BBB)的完整性并调节CBF的供应。
对神经活动的CBF增强也提出有助于通过血液或血管周围机制清除正常功能和代谢的废物副产品。神经活动和CBF之间相互作用的变化扰乱了向活跃脑细胞的底物供应,并阻碍了可能有害的脑代谢副产品的清除,破坏了可能导致脑功能障碍的脑微环境。
大量研究表明,神经血管解耦与包括AD、PD和ALS在内的神经退行性疾病的发病和进展有关。神经退行性疾病的早期病理生理改变,如AD、PD和ALS,涉及BBB功能障碍和CBF减少 [15,16]。
3.5 神经炎症
神经炎症不仅由神经退行性引起,也参与这一过程。它显著促进了大多数神经退行性疾病的发病机制和进展。
在AD中,炎症作为Aβ聚集和tau缠结积累之间的联系 [17]。
在PD中,α-突触核蛋白聚集、环境毒素或氧化应激通过与其Toll样受体相互作用刺激小胶质细胞的激活 [18]。Toll样受体的参与和随后的下游通路激活引发了一系列事件,导致NF-κB激活、炎症体形成启动和细胞因子水平升高 [18]。这一连续的炎症过程导致多巴胺能细胞损伤和随后的细胞死亡 [18]。
小胶质细胞NLRP3炎症体的激活被确认为ALS中神经炎症的重要贡献者 [19]。NF-κB蛋白作为ALS中炎症的主要调节器。研究表明,TDP-43蛋白病通过启动线粒体DNA的细胞质释放激活细胞质DNA感应cGAS-STING通路,从而引发炎症 [19,20]。
4. 临床表现和生物标志物
神经退行性疾病的临床表现包括各种神经系统症状,如认知能力下降、运动障碍和行为改变。神经退行性疾病的生物标志物包括异常蛋白质聚集体、神经递质失衡和遗传变异,为诊断和监测疾病进展提供见解。
| 神经退行性疾病 | 临床表现 | 生物标志物 |
|---|---|---|
| Alzheimer's disease | Memory impairment, cognitive decline, language and communication difficulties, impaired spatial and visual skills, difficulty in planning and organizing and with activities of daily living, behavior and personality changes | Aβ42, Aβ40, Tau , APOEε4, PSEN1, PSEN2 |
| Parkinson's disease | Motor symptoms including resting tremors, bradykinesia/akinesia, muscle rigidity, postural instability, masked face, speech changes; certain non-motor symptoms including cognitive impairment, mood disorders, sleep disturbances, and autonomic dysfunction | SNCA/PARK1/4, LRRK2/PARK8, PARK7/DJ-1, UCHL1/PARK5, SYNJ1/PARK20, DNAJC6/PARK19, DNAJC13/PARK21,β-Glucocerebrosidase, Aβ42, Tau, NFL, NURR1, VPS35/PARK17, EIF4G1/PARK18, BDNF, IGF-1, Let-7f-5p, miR-125a-5p, miR-151a-3p, miR-27a-3p and miR-423-5p [7] |
| Amyotrophic lateral sclerosis | Muscle weakness and atrophy, spasticity, difficulty in speaking and swallowing, impaired motor control, fasciculations, respiratory complications, emotional and cognitive changes | SOD1, FUS, C9orf72, TDP-43/TARDBP, TAF15, EWSR1, ATXN2, HnRNPA1, MATR3, TIA1/TIAR, CHCHD10, TBK1, TUBA4A, NEK1, C21orf2, CCNF, KIF5A, ANXA11, GLT8D1, SPG11, CHIT1, MiR-27a, miR-34a, miR-124, miR-142-5p, miR-155 and miR-338-3p, |
| Huntington's disease | Chorea, motor impairment, cognitive decline, behavior changes, psychiatric problems, dystonia, speech difficulties, loss of coordination, gait disturbances | HTT and mHTT |
5. 神经退行性疾病当前研究
近年来,关于神经退行性疾病病理学的研究不断涌现,推动了对这些复杂疾病认识的深入,这有助于开发有效的治疗方法,改善这些毁灭性疾病患者的整体管理和护理。
越来越多的研究表明,微生物群-肠-脑(MGB)轴在包括AD、PD和HD在内的多种神经退行性疾病的病理机制中发挥重要作用。肠道微生物群通过调节免疫系统、神经系统和微生物分子,并激活几个未知的潜在通路,介导大脑的生理活动。
Stefanie Grabrucker等人首次证实了肠道微生物群在阿尔茨海默病中的因果作用,通过它可以将阿尔茨海默病的症状转移到健康的年轻生物体 [21]。
Van Kessel等人发现,在大鼠模型中,多巴胺激动剂治疗与肠道蠕动减少和小肠细菌过度生长(SIBO)有关,并暗示这些效应是通过乳杆菌和双歧杆菌的相对丰度增加,同时伴随着毛螺菌科和普雷沃特菌科的下降介导的 [22]。
Gubert等人发现,亨廷顿病小鼠接受野生型粪便微生物群移植后,认知结果有所改善,尤其是雌性。他们提出了性别二态性和进行性肠道功能障碍的证据,以及微生物群的破坏,支持将微生物群操纵作为亨廷顿病治疗干预的第一个想法,特别是针对认知症状 [23]。MGB轴可以影响亨廷顿病的运动、精神和认知症状,以及体重减轻。
香港中文大学研究团队最近发现,由神经元中扰乱的转录因子YY1触发的信号通路可能导致ALS,表明YY1可以作为治疗这种不治之症的潜在药物靶标。
总之,神经退行性已被确定为神经退行性疾病中的关键病理生理变化。神经退行性疾病的特征是特定类型神经元的不可逆退化。神经退行性疾病是不可治愈和致残的疾病,它们的流行率部分由于全球人口老龄化而上升。因此,了解神经退行性疾病病理机制中涉及的复杂过程对于开发针对性干预措施以减缓或停止这些状况的进展至关重要。
参考文献:
[1] Bayer T.A., Wirths O. Intracellular accumulation of amyloid-Beta-a predictor for synaptic dysfunction and neuron loss in Alzheimer’s disease [J]. Front. Aging Neurosci. 2010;2:8.
[2] Pickett E.K., Herrmann A.G., et al. Amyloid beta and tau cooperate to cause reversible behavioral and transcriptional deficits in a model of Alzheimer’s disease [J]. Cell Rep. 2019;29:3592–3604.e5.
[3] Bartels A.L., Leenders K.L. Parkinson's disease: The syndrome, the pathogenesis and pathophysiology [J]. Cortex. 2009;45:915–921.
[4] Morris J. Amyotrophic lateral sclerosis (ALS) and related motor neuron diseases: An overview. Neurodiagn [J]. J. 2015;55:180–194.
[5] Wang G., Rayner S., Chung R., Shi B., Liang X. Advances in nanotechnology-based strategies for the treatments of amyotrophic lateral sclerosis [J]. Mater. Today Bio. 2020;6:100055.
[6] Ferguson, M. W., Kennedy, C. J., et al. (2022). Current and Possible Future Therapeutic Options for Huntington’s Disease [J]. Journal of Central Nervous System Disease, 14.
[7] Emamzadeh F.N., Surguchov A. Parkinson's disease: Biomarkers, treatment, and risk factors [J]. Front. Neurosci. 2018;12:612.
[8] Gorell J.M., Peterson E.L., Rybicki B.A., Johnson C.C. Multiple risk factors for Parkinson's disease [J]. J. Neurol. Sci. 2004;217:169–174.
[9] David M. Wilson III, Mark R. Cookson, et al. Hallmarks of neurodegenerative diseases [J]. Volume 186, Issue 4, 16 February 2023, Pages 693-714.
[10] Businaro R, Vauzour D, et al. Therapeutic Opportunities for Food Supplements in Neurodegenerative Disease and Depression [J]. Front Nutr. 2021;8:669846.
[11] Muddapu, V. R., Parvathy Dharshini, et al. (2020). Neurodegenerative Diseases – Is Metabolic Deficiency the Root Cause [J]? Frontiers in Neuroscience, 14.
[12] Ibanez L, Farias FHG, et al. Polygenic Risk Scores in Neurodegenerative Diseases: a Review [J]. Curr Genetic Med Rep. 2019;7:22–9.
[13] Chowen JA, Garcia-Segura LM. Role of glial cells in the generation of sex differences in neurodegenerative diseases and brain aging [J]. Mech Ageing Dev. 2021;196:111473.
[14] Lentini E, Kasahara M, Arver S, Savic I. Sex differences in the human brain and the impact of sex chromosomes and sex hormones [J]. Cereb Cortex. 2013;23:2322–36.
[15] Sweeney M. D., Kisler K., Montagne A., Toga A. W., Zlokovic B. V. (2018). The role of brain vasculature in neurodegenerative disorders [J]. Nat. Neurosci. 21 1318–1331.
[16] Yu, X., Ji, C., & Shao, A. (2020). Neurovascular Unit Dysfunction and Neurodegenerative Disorders [J]. Frontiers in Neuroscience, 14.
[17] Sobue, A., Komine, O. & Yamanaka, K. Neuroinflammation in Alzheimer's disease: microglial signature and their relevance to disease. Inflamm Regener 43, 26 (2023).
[18] Çınar, E., Tel, B. C., & Şahin, G. (2022). Neuroinflammation in Parkinson's Disease and its Treatment Opportunities [J]. Balkan Medical Journal, 39(5), 318-333.
[19] Smethurst, P. et al. Distinct responses of neurons and astrocytes to TDP-43 proteinopathy in amyotrophic lateral sclerosis [J]. Brain 143, 430–440 (2020).
[20] Mead, R. J., Shan, N., et al. (2023). Amyotrophic lateral sclerosis: A neurodegenerative disorder poised for successful therapeutic translation [J]. Nature Reviews Drug Discovery, 22(3), 185-212.
[21] Stefanie Grabrucker, Moira Marizzoni, et al. Microbiota from Alzheimer's patients induce deficits in cognition and hippocampal neurogenesis [J]. Brain, Volume 146, Issue 12, December 2023, Pages 4916–4934.
[22] Bullock, A., & Aidy, S. E. (2022). Parkinson's Disease Medication Alters Small Intestinal Motility and Microbiota Composition in Healthy Rats [J]. MSystems, 7(1).
[23] Gubert, C., Choo, J. M., et al. (2022). Faecal microbiota transplant ameliorates gut dysbiosis and cognitive deficits in Huntington’s disease mice [J]. Brain Communications, 4(4).
上一篇: 抗癌新势力:聚焦2024 ASCO年会上的ADC药物新星
下一篇: 前沿靶点速递:每周医学研究精选











