细胞焦亡
细胞焦亡 (pyroptosis),又称细胞炎症性坏死, 由Cookson等人于2001年首次提出并用来形容在巨噬细胞中发现Caspase-1依赖的细胞死亡方式[1]。细胞焦亡的细胞形态特点与调控机制与其他细胞死亡方式(如凋亡和坏死)都不一样。
1、细胞焦亡的特点
细胞焦亡主要通过炎症小体介导包含Caspase-1在内的多种Caspase的激活,造成包括GSDMD在内的多种Gasdermin家族成员发生剪切和多聚化,造成细胞穿孔,进而引起细胞死亡。相比于细胞凋亡(apoptosis),细胞焦亡发生的更快,并会伴随着大量促炎症因子的释放。
细胞发生焦亡时,细胞会发生肿胀,在细胞破裂之前,细胞上形成凸出物,之后细胞膜上形成孔隙,使细胞膜失去完整性,释放内容物,引起炎症反应,此时,细胞核位于细胞中央,随着形态学的改变,细胞核固缩,DNA断裂。
2、细胞焦亡信号通路
细胞焦亡主要由依赖Caspase-1信号通路和依赖Caspase-4、Caspase-5、Caspase-11信号通路调控[2]。
依赖Caspase-1信号通路又称为经典炎症小体信号通路。首先,病原相关分子模式(PAMPs)或宿主来源的危险信号分子(DAMPs)分别激活对应的模式识别受体(PRRs),NLRP1b、NLRP3、NLRC4、AIM2或Pyrin。如图1所示,活化 NLRP3 和NLRC4 炎症小体还分别需要激酶NEK7和配体结合NAIP蛋白。炎症小体激活后会募集炎症小体接头蛋白ASC和蛋白酶caspase-1共同形成大分子复合物。Caspase-1会直接裂解gasdermin D启动细胞焦亡。此外,Caspase-1还可以裂解pro-IL-1β与pro-IL-18前体来使 IL-1β和IL-18变成成熟的功能蛋白。gasdermin D裂解后的N端片段会在宿主细胞膜上形成一个孔来调节胞质内容物的释放。
依赖Caspase-4、5、11信号通路又称Caspase-1非依赖性信号通路或非经典炎症小体信号通路。顾名思义,该信号通路是由人源的caspase-4和caspase-5或鼠源的caspase-11触发[3]。这些炎性caspases可直接裂解gasdermin D并启动细胞焦亡。gasdermin D裂解后的N端片段同样可以激活NLRP3炎症小体与caspase-1-依赖性的IL-1β和IL-18成熟。
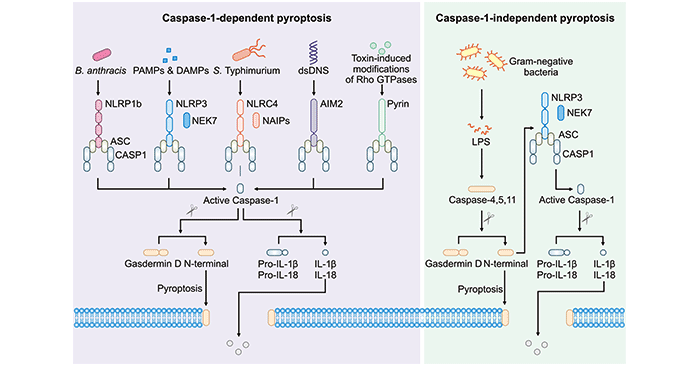
图1. Diagram of caspase-1-dependent pyroptosis and caspase-1-independent pyroptosis
3、细胞焦亡过程中的核心蛋白
在上段的机制中已经提到,细胞焦亡的发生发展受到很多蛋白分子或蛋白复合物的调控,比如炎症小体、GSDMD、caspase-1和 IL1β。
炎症小体是由胞浆内PRRs参与组装的多蛋白复合物,是天然免疫系统的重要组成部分,能够识别PAMPs或者DAMPs,招募和激活促炎症蛋白酶Caspase-1,启动机体炎症反应和抗病毒免疫的信号传导通路,使宿主免受感染。
GSDMD是一个保守蛋白家族GSDM的成员,在人类中,GSDMD 由 242 个氨基酸的氨基末端结构域和199 个氨基酸的羧基末端结构域通过 43 个氨基酸的连接而成,且C-端结构域会形成似“口袋”样结构与N-端结构域相互作用。N-端结构域,也称为“成孔结构域”,会在质膜形成GSDM孔。C-端结构域,也称为“阻遏域”,可以抑制N端结构域形成穿孔。GSDMD在免疫细胞和肠上皮细胞中表达。GSDMD的裂解是 Caspase-1 和Caspase-11 触发细胞焦亡的机制。GSDMD形成一个孔作为细胞焦亡的效应物[4]。
Caspase-1通常以无活性的前体形式存在,被炎症小体激活后,Caspase-1会切割GSDMD连接氨基酸序列,形成具有亲水性的C-端结构域和亲脂性的N-端结构域。此外,IL-1β和 IL-18前体也被Caspase-1 裂解为成熟形式,并通过GSDM形成的中空环状孔或膜破裂期间释放。Caspase-11可直接被细菌等“入侵者”激活,独立作用于GSDMD并产生N-端亲脂性结构域,寡聚化并与细胞膜结合形成焦亡孔。此外,Caspase-11还可以直接识别并结合细胞溶质脂多糖 (LPS),引发IFN-γ以启动细胞焦亡。.
j9九游会登录入口首页生物汇总了部分与细胞焦亡相关的热门靶点,点击对应靶点可查看所有相关试剂。
参考文献:
[1] Cookson BT, Brennan MA. Pro-inflammatory programmed cell death [J]. Trenda Microbiol, 2001, 9: 113-114.
[2] Man SM, Karki R, Kanneganti TD. Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases [J]. Immunol Rev. 2017;277(1):61-75.
[3] Stowe I, Lee B, Kayagaki N. Caspase-11: arming the guards against bacterial infection [J]. Immunological reviews. 2015, 265:75–84.
[4] Kovacs SB, Miao EA. Gasdermins: Effectors of Pyroptosis [J]. Trends Cell Biol. 2017, 27(9): 673-684.






