细胞因子与癌症
在癌症发生的过程中,癌细胞向周围释放各种细胞因子和生长因子,并招募和重新编程许多其他类型的细胞,以建立肿瘤微环境,包括肿瘤细胞、基质成纤维细胞、内皮细胞和浸润性白细胞,如巨噬细胞,以及T淋巴细胞和肿瘤相关树突状细胞(TADC)。此外,嗜酸性粒细胞、粒细胞、自然杀伤细胞(NK)和B细胞都存在于某些类型的肿瘤中(图1)。
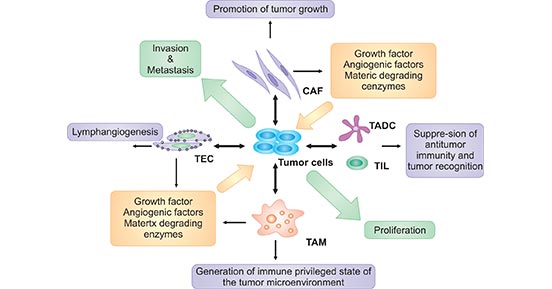
图1. 肿瘤微环境的组成部分与癌症的关系
*图片来源于Front Biosci 的出版物 [1]
不同细胞在肿瘤环境中产生的细胞因子在癌症发病过程中具有重要作用[1]。在感染、炎症和免疫等情况下释放的细胞因子可以起到抑制癌症发展和恶化的作用。大量的临床研究发现,癌症患者的细胞因子有以下几种,包括IL2、IL6、IL8、IL10、IL12、IL18、TNFα、TGFβ、IFNγ、巨噬细胞迁移抑制因子(MIF)和CXCR4等 [2]。在本文中,我们主要介绍这些细胞因子在癌症中的作用。
IL2与癌症
IL2主要来源于CD4+T细胞,为抗原刺激T淋巴细胞的生长因子,在适应性免疫中负责抗原识别后的T细胞克隆扩张。IL-2是对免疫系统具有多效性的重要细胞因子之一。癌症的进展或预后不良与IL2浓度降低或可溶性IL2受体浓度增加有关 [2]。多项研究显示,IL2以自分泌方式刺激黑色素瘤细胞系的肿瘤增殖[3]。此外,IL2已用于治疗转移性肾细胞癌和转移性黑色素瘤。
IL-2的生物功能由IL-2受体介导,属于I型细胞因子受体[4]。IL-2受体是由α、β、γ三个亚单位组成的三聚体复合物。β链和γ链参与信号传递,而α链只参与细胞因子的结合。IL-2与其受体的结合能诱导多种信号转导途径的激活。最开始,JAK1和JAK3招募到IL-2Rβγ或IL-2Rαβγ的胞质域。然后,激活的JAK激酶招募并磷酸化STAT1、STAT3、STAT5A和STAT5B。最后,STAT、PI3K-AKT和MAPK三大下游信号通路被激活(图2)。
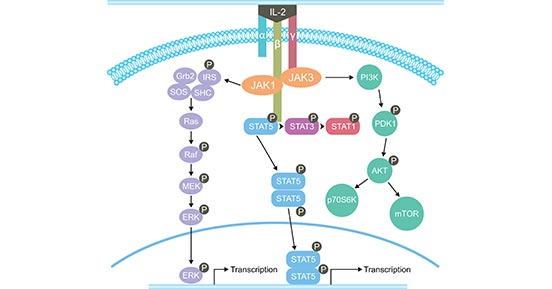
图2. IL-2的信号传导途径
*图片来源于Journal OncoImmunology 的出版物 [5]
IL6与癌症
IL-6由许多肿瘤产生,是一种增殖能力非常强的细胞因子,在恶性肿瘤的发病过程中起重要作用。高浓度的IL-6在癌症中被发现,且往往表达失调[6][7]。众多报道表明,IL-6在多种类型的肿瘤中过度表达。肿瘤微环境中IL-6水平高,说明炎症与癌症之间的联系密切。IL-6通过调节癌症相关标志物和多种信号通路,影响细胞凋亡、生存、增殖、血管生成、侵袭性和转移等,促进肿瘤的发生。此外,IL-6通过促进修复和诱导反信号(抗氧化和抗凋亡/促生存)通路,保护癌细胞免受治疗引起的DNA损伤、氧化应激和凋亡。最为关键的,可能是IL-6对信号的刺激作用,最终导致STAT-3的激活,而STAT-3是肿瘤与微环境相互作用、肿瘤摆脱免疫控制和血管生成的关键转录因子[8]。
IL8与癌症
IL8又称CXCL-8,是CXC趋化因子家族中的一员,由多种人类癌细胞产生。IL-8 mRNA可被TNF-α、LIF、IL-1β、IL-6、IL-8或IFN-β增强,表明IL-8在癌症的进展中起着举足轻重的作用。有人进一步提出,癌症环境的局部炎症有利于肿瘤的进展和转移。多种人类癌症模型说明了IL-8在癌症环境中的免疫调节作用[9][10][11]。IL-8是一种调节中性多形核白细胞(PMN)动员和活性的趋化因子。与黑色素瘤细胞共培养后,IL-8在PMNs中上调。黑色素瘤细胞诱导PMNs中的IκB-α降解;这表明NF-κB信号对PMNs中IL-8的分泌至关重要。来自PMN-黑色素瘤共培养物的IL-6和IL-1β协同,促进PMNs中IκB-α降解和IL-8合成。
IL10与癌症
IL-10具有高度的免疫抑制作用,在肿瘤细胞中常高表达,所以大多数人类癌症中循环血清中IL-10的浓度高。IL-10对肿瘤的发展有复杂的影响。许多研究认为IL-10能抑制肿瘤的发展,而有些报道则说明它具有促肿瘤发生的作用。IL-10可以抑制NF-κB的激活,进而抑制促炎性细胞因子的产生,包括TNF-α、IL-6和IL-12[12]。特别是IL-10还被证明在肿瘤消退过程中能调节细胞凋亡和抑制血管生成[13]。在乳腺癌和卵巢癌异种移植中表达IL-10可抑制肿瘤的生长和扩散[14]。IL-10可以通过下调主要组织相容性复合体(MHC)I类的表达,导致NK细胞介导的肿瘤细胞溶解能力增强,从而抑制肿瘤生长。IL-10能够下调VEGF、TNF-α和IL-6的产生,这也可能是其对肿瘤基质有抑制作用的原因[15]。
IL12与癌症
IL-12是一种促炎性的异源性细胞因子,由35kDa和40kDa亚单位组成。IL-12是T细胞和NK细胞产生IFNγ的必要条件。在生理免疫反应期间,IL-12的表达增加发生[16]。在许多癌症患者中,这一过程中IL-12表达是减少的,特别是在晚期,病情较大、较晚期的癌症,如星形细胞瘤、胶质母细胞瘤、肾细胞癌、头颈部鳞状细胞癌、恶性黑色素瘤、结直肠癌等。胃癌和结直肠癌患者随着病情的发展,受刺激的外周血单核细胞产生的IL-12明显减少。
IL18与癌症
除IL-12外,干扰素-γ的产生受IL-18的影响,IL-18主要由巨噬细胞和树突状细胞产生。IL-18是IL-1家族细胞因子的成员之一,与炎症介质有相同的结构特点和受体,在靶细胞中的功能也是相似的。与IL-12一样,IL-18在细胞先天性和适应性免疫系统中提供了重要的生理联系,从而促进Th1和记忆性CD8 T细胞的发育。临床前模型显示,IL-18单独使用具有抗肿瘤活性,与IL-2或IL-12联合使用更具有前景。在一项针对晚期癌症患者的I期研究中,静脉注射IL-18引起流感和炎症,以及多种轻度的代谢逆转和血液紊乱[17][18]。
TNFα与癌症
TNFα又称肿瘤坏死因子,是一种多功能的细胞因子,在细胞生存、增殖、分化和死亡等多种细胞进程中发挥重要作用。作为一种促炎症细胞因子,TNFα由炎症细胞分泌,可能参与炎症相关的致癌过程。关于癌症,TNF具有双重作用。一方面,TNF可能是一种内源性肿瘤促进剂,因为TNF能刺激癌细胞的生长、增殖、侵袭和转移,以及肿瘤的血管生成。另一方面,TNF可能是一种癌症杀手。TNF诱导癌细胞死亡的特性使其成为一种潜在的癌症治疗手段。如何全面的发挥TNF抑癌作用,降低其毒性还需要做更多的研究[19]。
TGFβ与癌症
TGF-β是一种对靶细胞具有多种功能的生长因子。它对组织和细胞的分化起着重要的调节作用,能刺激或抑制各种细胞的增殖。在癌症方面,TGFβ在人类癌症中起着双重作用。一方面,TGFβ对癌症的形成和发展起着重要的调控作用。另一方面,TGFβ虽然在正常细胞和早期癌肿中起着抑制肿瘤的作用,但在较晚期的侵袭性癌症中,TGFβ却转换了角色,事实上促进了肿瘤的进展[20]。
IFNγ与癌症
IFNγ主要由CD8+T细胞、CD4+T细胞和NK细胞分泌。IFNγ可激活巨噬细胞,并刺激APCs上的MHCⅠ类、MHCⅡ类和共刺激分子上调。IFNγ在小鼠模型中的抗肿瘤作用表明,它可以作用于多种恶性肿瘤。实际上,IFNγ在治疗人类癌症方面表现出的临床作用有限,但可能在其他细胞因子的体内发挥关键作用。IFNγ可抑制免疫抑制因子TGFβ和前列腺素E2的产生,而IFNγ产生的负性调节因子包括IL-4、IL-10和TGFβ。
MIF和癌症
MIF作为一种多功能的炎性细胞因子,在细菌、病毒等刺激后,自身大量分泌,同时刺激或者诱导各种细胞及细胞因子分泌聚集,发挥作用。MIF与许多癌症表型的肿瘤发生、血管生成和转移有关[21]。它在各种类型的细胞中表达,包括单核细胞、巨噬细胞、T和B淋巴细胞、嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞和中性粒细胞。MIF通过抑制经典的肿瘤抑制基因p53,潜在地促进肿瘤的发生,p53可以促进细胞周期停滞和凋亡,以应对DNA损伤。MIF可在正反馈调控中刺激促炎细胞因子TNFα、IFN-γ、IL1β、IL 6和IL8的表达。
CXCR4与癌症
CXCR4只与CXCL12结合,是研究最多的趋化因子受体之一。CXCR4是HIV1侵染宿主细胞的主要共受体之一。近几年的研究发现,CXCR4在超过23种人类癌症中过度表达。癌细胞CXCR4的过度表达有助于肿瘤的生长、侵袭、血管生成、转移、复发和治疗抵抗。CXCR4拮抗剂已被证实可以破坏肿瘤与基质的相互作用,使癌细胞对细胞毒性药物敏感,抑制肿瘤生长和转移[22]。
参考文献:
[1] Sheu BC, Chang WC, et al. Cytokine regulation networks in the cancer microenvironment [J]. Front Biosci. 2008, 13():6255-68.
[2] Lippitz BE. Cytokine patterns in patients with cancer: a systematic review [J]. Lancet Oncol.2013, 14(6):e218-28.
[3] Ito R, Kitadai Y, et al. Interleukin 1a acts as an autocrine growth simulator for human gastric carcinoma cells [J]. Cancer Res. 1993, 55:4102–6.
[4] Waldmann TA. The interleukin-2 receptor on normal and malignant lymphocytes [J]. Adv Exp Med Biol. 1987, 213:129–37.
[5] Tao Jiang, Caicun Zhou, et al. Role of IL-2 in cancer immunotherapy [J]. Journal OncoImmunology. 2016, 5(6).
[6] Kumari N, Dwarakanath BS, et al. Role of interleukin-6 in cancer progression and therapeutic resistance [J]. Tumour Biol. 2016, 37(9):11553-11572.
[7] Hong DS, Angelo LS, et al. Interleukin-6 and its receptor in cancer: implications for translational therapeutics [J]. Cancer. 2007, 110:1911-28.
[8] Grivennikov S Karin M. Autocrine IL-6 signaling: a key event in tumorigenesis [J]? Cancer Cell. 2008, 13:7-9.
[9] Hsin-Hsin P, L. Shile, J.H. Andrew, et al. Regulation of interleukin-8 expression in melanoma-stimulated neutrophil inflammatory response [J]. Exp Cell Res. 2007, 313, 551-559.
[10] Shile L, S. Arati, P. Hsin-Hsin, et al. Targeting Mutant (V600E) B-Raf in Melanoma Interrupts Immunoediting of Leukocyte Functions and Melanoma Extravasation [J]. Cancer Res. 2007, 67, 5814-5820.
[11] Solomayer E.F, I.J. Diel, et al. Metastatic breast cancer: clinical course, prognosis and therapy related to the first site of metastasis [J]. Breast Cancer Res Treat. 2000, 59, 271-278.
[12] Hoentjen F, R.B. Sartor, M. Ozaki, et al. STAT3 regulates NF-κB recruitment to the IL-12p40 promoter in dendritic cells [J]. Blood. 2005, 105, 689-696.
[13] Stuelten C.H, S. DaCosta-Byfield, et al. Breast cancer cells induce stromal fibroblasts to express MMP-9 via secretion of TNF-α and TGF-β [J]. J Cell Sci. 2005, 118, 2143-2153.
[14] Kohno T, H. Mizukami, et al. Interleukin-10–mediated inhibition of angiogenesis and tumor growth in mice bearing VEGF-producing ovarian cancer [J]. Cancer Res. 2003, 63, 5091-5094.
[15] Huang S, S.E. Ullrich, et al. Regulation of tumor growth and metastasis by interleukin-10: the melanoma experience [J]. J Interferon Cytokine Res. 1999, 19, 697-703.
[16] Seunghee Kim-Schulze, Bret Taback, et al. Cytokine Therapy for Cancer [J]. Surg Oncol Clin N Am. 2007, 16:793–818.
[17] Li Q, Car AL, et al. Synergistic effects of IL-12 and IL-18 in skewing tumor-reactive T-Cell responses towards a type 1 pattern [J]. Cancer Res. 2005, 65:1063 -70.
[18] Kim Margolin. Cytokine therapy in cancer [J]. Expert Opin. Biol. Ther. 2008, 8(10):1495-1505.
[19] Xia WANG and Yong LIN. Tumor necrosis factor and cancer, buddies or foes [J]? Acta Pharmacol Sin. 2008, Nov; 29(11): 1275–1288.
[20] Jean-Charles Neel, Laure Humbert, et al. The Dual Role of TGFβ in Human Cancer: From Tumor Suppression to Cancer Metastasis [J]. ISRN Molecular Biology. 2012.
[21] Ciaran O'Reilly, Mohammad Doroudian, et al. Targeting MIF in Cancer: Therapeutic Strategies, Current Developments, and Future Opportunities [J]. Medicinal Research Reviews. 2016.
[22] Samit Chatterjee, Babak Behnam Azad, et al. The Intricate Role of CXCR4 in Cancer [J]. Adv Cancer Res. 2014, 124: 31–82.






