PROM1:一种新的肿瘤干细胞CSCs表面标志物,未来新分子靶点!
日期:2023-02-15 16:19:22
近期,Science Translational Medicine杂志发表的一篇题为“Intracavity generation of glioma stem cell-specific CAR macrophages primes locoregional immunity for postoperative glioblastoma therapy”研究引起高度的关注 [1]。该研究团队开发了靶向CD133-GSC的嵌合抗原受体巨噬细胞(CAR-MΦ)免疫疗法,用于清除肿瘤切除后残留的CD133-GSCs。本项研究证实,在神经胶质瘤GBM小鼠模型中,靶向CD133-GSCs,可发挥抗肿瘤免疫作用,抑制GBM术后的复发率,并减少抗肿瘤药物的毒副作用。
CD133又叫PROM1,越来越多的实验证据支持PROM1可能是肿瘤(尤其是实体瘤)干细胞表面特异性表达的分子。目前为止,已有临床研究将PROM1作为靶点或作为靶向性杀死肿瘤干细胞的分子靶点。因此,PROM1极有可能成为治疗肿瘤的未来新分子靶点,为最终治疗恶性肿瘤提供新的途径!
1. 什么是PROM家族?
Prominin(PROM)家族有2个成员,Prominin-1和Prominin-2。Prominin来源于希腊语“prominere”突起,由于Prominin-1和Prominin-2均定位于细胞膜的突起,因而得名。Prominin-1主要在胰腺、肝脏、前列腺等上皮细胞和CSCs、胶质细胞等非上皮细胞表达,定位于细胞膜上表面突起。Prominin-2主要在肾小管等上皮细胞表达,定位于细胞膜的上表面和下表面的突起 [2-4]。目前,Prominin-1作为第一个被鉴定为“Prominin”的蛋白质,是一种新发现干细胞表面抗原标志,在肿瘤的诊断、治疗和预防方面发挥着重要作用,成为PROM家族热门的研究成员。
2. 什么是Prominin-1(PROM1)?
Prominin-1(PROM1,又名CD133)属于五次跨膜糖蛋白Prominin家族的成员。人类的Prominin-1和Prominin-2基因分别定位于染色体4p15.32和2q11.1。PROM家族成员具有相同的空间结构,为五次跨膜的胆固醇结合糖蛋白,N端位于细胞外侧,C端位于细胞内侧,细胞内的2个环富含半胱氨酸,细胞外的2个环分别包含4个N连接的糖基化位点(图1) [5]。1997年Miraglia等人在CD34+人造血干细胞和祖细胞(hematopoietic stem and progenitor cells,HSPCs)的表面发现CD133/PROM1后,人们对PROM1的研究便不断升温。
PROM1起初的功能是作为造血祖细胞的特异性标志物,随后科学家发现PROM1也可用于分离鉴定肿瘤干细胞(cancer stem cells,CSCs)。现有研究揭示,PROM1不仅能作为各种干细胞、CSCs以及肿瘤细胞的标记,还能介导PI3K/Akt、Akt、Src-FAK等信号通路,影响PROM1细胞的行为,其表达量与癌症治疗的效果也密切相关。因此,PROM1作为肿瘤治疗靶点或预后的标志物,越来越受到重视![6]
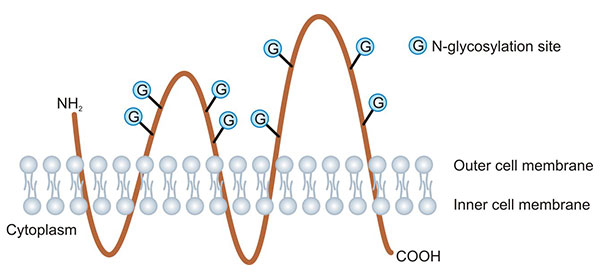
图1. PROM1蛋白结构示意图 [5]
3. PROM1相关的调控功能
目前对PROM1结构的分布及其他相关的研究推测PROM1具有以下功能:1)调节细胞增殖及分化;2)参与神经髓鞘形成;3)参与糖、铁代谢调节和细胞骨架改变 [7-9]。除了生物学功能,PROM1作为干细胞、CSCs和肿瘤细胞的标志物,在分子调控上也发挥着重要作用,与肿瘤细胞的信号通路转导相关,如p38MAPK及P13k/Akt途径、NOTCH、Ras/MEK/ERK、mTOR等信号。
在神经胶质瘤中,PROM1蛋白的C端胞质结构域第828位酪氨酸残基的磷酸化介导PROM1与p85之间的相互作用,通过激活PI3K/Akt信号通路,从而促进神经胶质瘤干细胞的致瘤能力。当敲低PROM1时则可有效抑制PI3K/Akt途径的活性,降低神经胶质瘤干细胞的自我更新和致瘤性。此外,PROM1酪氨酸残基的磷酸化能被PTPRK去除,PTPRK与PROM1羧基末端区域结合,催化PROM1的酪氨酸第828位和第852位去磷酸化,调节PROM1介导的Akt信号转导 (图2)[10-11]。
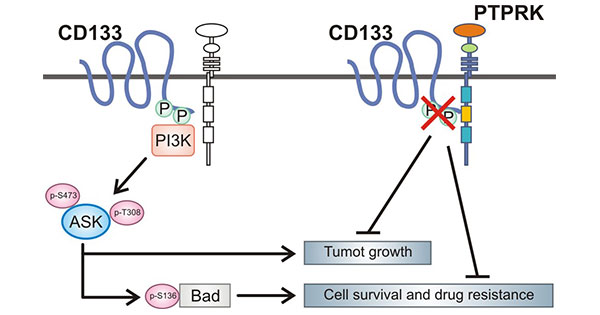
图2. PROM1相关的调控功能 [11]
同样在胶质瘤中,研究发现PROM1细胞的自我更新可能与HEDGEHOG-GLI(HH-GLI)通路相关,并且其表达了干细胞特征基因,如OLIG2、BMI1、BCAN、OCT.4、NANOG、PTEN、ABCG2、PDGFR-A、SOX2和NRD1。此外,PROM1/CD133+细胞比PROM1/CD133-细胞表达更高水平的神经前体细胞标志物CD90、CD44、CXCR4、nestin等等;同样,PROM1/CD133+细胞表达高水平的抗凋亡基因,如Bcl-2、Bcl-xL、FLIP、c-IAP2、XIAP、NAIP [12]。
4. PROM1在疾病中的作用
PROM1作为多种肿瘤共同的细胞表面标志物已成为研究热点。肿瘤干细胞(CSCs)在肿瘤的耐药、转移复发过程中发挥关键作用。研究发现PROM1/CD133+细胞在卵巢癌、神经系统肿瘤、肺癌、胰腺癌、前列腺癌、黑色素瘤等多种肿瘤中具有CSCs特征 [13]。因此,PROM1有望在干细胞相关疾病的治疗中发挥巨大作用。
4.1 PROM1和肿瘤干细胞相关疾病
在胶质瘤细胞系中,PROM1的高表达,可促进神经胶质瘤干细胞的自我更新和致瘤性。
另有研究提示,氧分压水平可能影PROM1的表达,甚至PROM1基因的转录翻译。在缺氧参与的PROM1表达调节中,缺氧诱导因子(hypoxia induced factor α,HIF-α)及SOX2起调节转录作用 [15]。另有实验数据表明,在胃肿瘤细胞系中SOX17的表达与PROM1的表达相关,而前者是维持自我更新能力和干细胞特性的重要转录因子 [16]。
在转移性乳腺癌患者的肿瘤细胞中发现PROM1与EMT标志物之间具有密切关系,N-钙粘蛋白与PROM1蛋白的表达呈正相关,揭示了在乳腺癌中肿瘤干细胞与上皮间质转化的相关性 [17]。在肝癌细胞中,PROM1/CD133+细胞的体外增殖能力,在免疫缺陷小鼠体内的成瘤能力均明显强于PROM1/CD133-细胞,且PROM1/CD133+细胞低表达成熟肝脏细胞 [18]。
在人转移性结肠癌标本中发现PROM1/CD133+及PROM1/CD133-细胞均能在体内外成瘤,但CD133+细胞表现出更强的侵袭性 [19]。在黑色素瘤中,CD133-和CD133+细胞均能成瘤,且均能分化使瘤体中CD133+/CD133-细胞比例与初始肿瘤相似 [20]。在卵巢癌中,CD133+细胞具有CSCs特征,且可通过CCL5介导的上皮间质转化导致非CSCs转移 [21]。
4.2 PROM1和其它疾病
早期临床试验表明,与CD34+细胞相比,PROM1/CD133+细胞可以改善移植的状况。循环中PROM1/CD133+细胞,可用于干细胞治疗肌肉萎缩症 [22];移植PROM1+骨髓可以改善梗死心肌的功能 [23]。此外,PROM1与视网膜功能相关密切相关,研究发现PROM1基因中一个单核苷酸转移突变会导致常染色体隐性视网膜变性疾病。敲除小鼠PROM1基因后表现出视网膜退化而失明 [24]。在人类内皮细胞系中的PROM1直接和血管内皮生长因子VEGF互相影响 [25]。PROM1的敲除还会导致肠道炎症的发生,推测其在维持肠道的平衡过程中发挥重要的作用 [26]。
5. PROM1的临床在研药物
目前已有多款针对PROM1的临床药物在研(表1),主要用于癌症治疗,如胶质母细胞瘤、卵巢上皮癌。其中靶向PROM1的ICT-121、COR-3、293C3-SDIE均为单克隆抗体免疫疗法,暂未公布临床数据。另外,随着肿瘤干细胞理论的不断进步完善,在探索治疗肿瘤的过程中,CSCs已经成为最重要的靶点之一。如前所述,已有研究团队开发出一种基于纳米载体-水凝胶超结构系统的CAR-MΦ细胞疗法,靶向CD133-GSCs,其在复发性胶质母细胞瘤的免疫治疗方面取得了突破性进展。PROM1作为多种实体肿瘤干细胞表面的特异性标志物,其扮演的角色中也越来越被关注。相信未来在更多的PROM1抗体被研发出来以后,联合各种现代分子实验技术,PROM1的更多生物学功能也会被进一步阐明,从而为癌症疾病提供新的治疗方法。
| 药物 | 靶点 | 作用机制 | 药物类型 | 在研适应症 | 在研机构 | 最高研发状态 |
|---|---|---|---|---|---|---|
| ICT-121 | CD133;EEF2 | CD133调节剂 | 树突状细胞疫苗 | 胶质母细胞瘤 | Torrey Pines Institute For Molecular Studies, Inc.;Formatech, Inc.; | 临床1期 |
| OXS-1650 | CD133 | 蛋白质生物合成抑制剂;CD133抑制剂;EEF2抑制剂 | ADC;单克隆抗体 | 实体瘤;卵巢上皮癌 | University of Minnesota;University of Minnesota Masonic Cancer Center;GT Biopharma, Inc. | 临床1期 |
| CNTY-103 | CD133 | 自然杀伤细胞替代物;免疫细胞毒性;CD133调节剂 | CAR-NK | 胶质母细胞瘤 | Century Therapeutics, Inc. | 临床前 |
| COR-3 | CD133;GPVI | CD133调节剂;GPVI抑制剂 | 单克隆抗体 | Acute Coronary Syndrome 急性冠状动脉综合征;Vascular restenosis 血管再狭窄;Cardiovascular Diseases 心血管疾病 |
advanceCOR GmbH | 临床前 |
| 293C3-SDIE | CD133 | CD133抑制剂 | 单克隆抗体;单链Fv片段抗体 | / | / | 药物发现 |
| rAAV vector prominin-1 gene therapy (Technische Universitat Dresden) | CD133 | CD133抑制剂 | 腺相关病毒基因治疗 | / | / | 药物发现 |
表1:PROM1的临床在研药物
为鼎力协助各药企针对PROM1在肿瘤临床中的研究,CUSABIO推出PROM1活性蛋白产品(Code: CSB-MP018751HU(A4)),助力您在PROM1机制方面的研究或其潜在临床价值的探索。
Recombinant Human Prominin-1(PROM1)-VLPs (Active)
-WB.jpg)
The high specifity was validated by SDS-PAGE. CSB-MP018751HU(A4) is detected by Mouse anti-6*His monoclonal antibody.
-AC1.jpg)
Immobilized PROM1 at 5 μg/mL can bind Anti-PROM1 recombinant antibody (CSB-RA018751MA1HU), the EC50 is 0.4322-0.7189 ng/mL.
参考文献:
[1] Chen, Chen, et al. "Intracavity generation of glioma stem cell-specific CAR macrophages primes locoregional immunity for postoperative glioblastoma therapy." Science Translational Medicine 14.656 (2022): eabn1128.
[2] Weigmann, Anja, et al. "Prominin, a novel microvilli-specific polytopic membrane protein of the apical surface of epithelial cells, is targeted to plasmalemmal protrusions of non-epithelial cells." Proceedings of the National Academy of Sciences 94.23 (1997): 12425-12430.
[3] Barzegar Behrooz, Amir, Amir Syahir, and Syahida Ahmad. "CD133: beyond a cancer stem cell biomarker. "Journal of drug targeting 27.3 (2019): 257-269.
[4] Saha, Subbroto Kumar, et al. "PROM1 and PROM2 expression differentially modulates clinical prognosis of cancer: a multiomics analysis." Cancer gene therapy 27.3-4 (2020): 147-167.
[5] Miraglia, Sheri, et al. "A novel five-transmembrane hematopoietic stem cell antigen: isolation, characterization, and molecular cloning." Blood, The Journal of the American Society of Hematology 90.12 (1997): 5013-5021.
[6] Aghajani, Marjan, et al. "New emerging roles of CD133 in cancer stem cell: Signaling pathway and miRNA regulation." journal of cellular physiology 234.12 (2019): 21642-21661.
[7] Zhang, Hua, and SuYi Li. "Study progression of CD133 as a marker of cancer stem cells." Chin J Cancer 29.3 (2010): 243-247.
[8] Fukamachi, Hiroshi, et al. "CD133 is a marker of gland-forming cells in gastric tumors and Sox17 is involved in its regulation." Cancer science 102.7 (2011): 1313-1321.
[9] Matsumoto, Kazuko, et al. "mTOR signal and hypoxia-inducible factor-1α regulate CD133 expression in cancer cells." Cancer research 69.18 (2009): 7160 -7164.
[10] Shimozato, O., et al. "Receptor-type protein tyrosine phosphatase κ directly dephosphorylates CD133 and regulates downstream AKT activation." Oncogene 34.15 (2015): 1949-1960.
[11] Matsushita, Masashi, et al. "PTPRK suppresses progression and chemo-resistance of colon cancer cells via direct inhibition of pro -oncogenic CD 133." FEBS Open Bio 9.5 (2019): 935-946.
[12] You, Hanning, Wei Ding, and C. Bart Rountree. "Epigenetic regulation of cancer stem cell marker CD133 by transforming growth factor-β." Hepatology 51.5 (2010): 1635-1644.
[13] Grabovenko, F. I., et al. "Protein CD133 as a tumor stem cell marker." Zhurnal Voprosy Neirokhirurgii Imeni NN Burdenko 86.6 (2022): 113-120.
[14] Ahmed, Syed Ijlal, et al. "CD133 expression in glioblastoma multiforme: a literature review." Cureus 10.10 (2018).
[15] Chédeville, Agathe L., and Patricia A. Madureira. "The role of hypoxia in glioblastoma radiotherapy resistance. "Cancers 13.3 (2021): 542.
[16] Yiming, Li, et al. "CD133 overexpression correlates with clinicopathological features of gastric cancer patients and its impact on survival: a systematic review and meta-analysis." oncotarget 6.39 (2015): 42019-42027.
[17] Brugnoli, Federica, et al. "CD133 in breast cancer cells: more than a stem cell marker." journal of oncology 2019 (2019).
[18] Bauer, Nicola, et al. "New insights into the cell biology of hematopoietic progenitors by studying prominin-1 (CD133)." Cells Tissues Organs 188.1-2 (2008): 127-138.
[19] Akbari, Morteza, et al. "CD133: An emerging prognostic factor and therapeutic target in colorectal cancer." cell biology international 44.2 (2020): 368-380.
[20] Madjd, Zahra, et al. "Expression of CD133 cancer stem cell marker in melanoma: a systematic review and meta-analysis." the International journal of biological markers 31.2 (2016): 118-125.
[21] Zhou, Quan, et al. "Prognostic value of cancer stem cell marker CD133 in ovarian cancer: a meta-analysis." international journal of clinical and experimental medicine 8.3 (2015): 3080.
[22] Farini, Andrea, et al. "Cell based therapy for Duchenne muscular dystrophy." journal of cellular physiology 221.3 (2009): 526-534.
[23] Donndorf, Peter, and Gustav Steinhoff. "CD133-positive cells for cardiac stem cell therapy: current status and outlook." Prominin-1 (CD133): New Insights on Stem & Cancer Stem Cell Biology (2013): 215-227.
[24] Mohammad, Ghulam, et al. "Functional links between gelatinase B/matrix metalloproteinase-9 and prominin-1/CD133 in diabetic retinal vasculopathy and neuropathy." Progress in retinal and eye research 43 (2014): 76-91.
[25] Catalano, Veronica, et al. "CD133 as a target for colon cancer." Expert opinion on therapeutic targets 16.3 (2012): 259-267.
[26] Wen, Lei, et al. "Prognostic value of cancer stem cell marker CD133 expression in gastric cancer: a systematic review." ploS one 8.3 (2013): e59154.











