ULBP1蛋白:NKG2D配体潜力成员,多种血液和实体肿瘤CAR-T治疗靶点!
日期:2023-04-28 09:20:13
近日,一篇发表在血液瘤《The Lancet Haematology》知名杂志的研究报道,多剂CYAD-01治疗反复发作/难治性急性髓性白血病(AML)、骨髓增生异常综合征(MDS)或多发性骨髓瘤(MM)患者,显示出一定程度的疗效和安全性 [1]。CYAD-01是一种基于NKG2D受体的CAR-T细胞治疗,NKG2D受体可以识别表达在大多数实体瘤和血癌细胞表面的8种不同的配体(MICA、MICB;ULBP1-ULBP6),导致它可以同时靶向多种不同的癌症。
NKG2D配体(NKG2D Ligands,NKG2DL)在广泛的血液恶性肿瘤中过表达。据CYAD-01的I期临床数据显示,通过CAR T细胞疗法靶向NKG2D配体可提高对这些肿瘤的治疗效果。ULBP1,作为NKG2D配体成员之一,在多种血液和实体肿瘤中高表达,使用NKG2D CAR-T靶向方法,有望增强对高表达ULBP1的肿瘤细胞的抗肿瘤活性。今天,我们一起探究ULBP1作为NKG2D配体潜力成员,在癌症治疗中的新机遇!

1. 什么是NKG2D Ligands家族蛋白?
NKG2D ligands(NKG2DLs)家族蛋白即NKG2D所识别的配体,主要包括六种巨细胞病毒UL16结合蛋白1-6(ULBP1、ULBP2、ULBP3、ULBP4、ULBP5、ULBP6)和MHC I链相关分子A和B(MICA、MICB)[2]。正常情况下,NKG2DLs在健康细胞表面表达相对较低。当细胞发生应激,例如在感染或恶性转化,NK细胞就能通过NKG2D-NKG2DLs形式结合并杀伤应激细胞(图1)[3]。
大量研究已证实,NKG2D/NKG2DL轴参与NK细胞的抗肿瘤作用。因而,NKG2DLs成为肿瘤免疫治疗的分子潜力靶点。事实上,鉴于NKG2D配体在肿瘤组织表达的特异性,目前已开发出基于靶向NKG2D配体的CAR-T疗法,该CAR-T在临床前和临床试验中被应用于肿瘤的治疗,展现出了优越的抗肿瘤效果和良好的安全性 [4]。
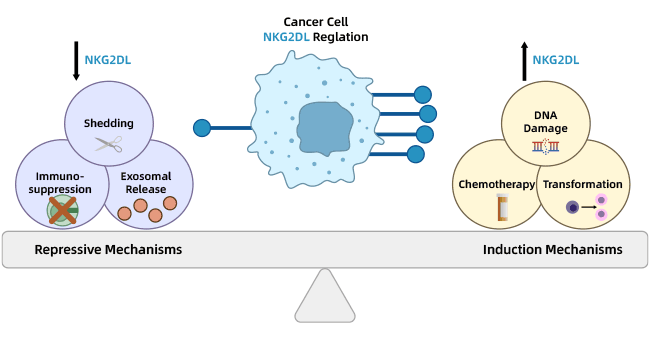
图1. NKG2DL在肿瘤中高表达 [3]
2. 什么是ULBP1?
UL16结合蛋白-1(UL16-binding protein 1,ULBP1)是NKG2D ligand家族蛋白的成员之一,亦称NKG2DL,属于MHC-I类相关分子的新家族。ULBP1编码基因位于6q24.2-6q25.3。ULBPs都具有相似的结构特征,包括一个信号肽序列、一个α1域、一个α2域和一个细胞膜锚定区域 (图2) [5]。ULBP1-4不含跨膜结构域,只能通过GPI与细胞膜相连。各ULBPs分子与受体NKG2D的亲和力不同。ULBP1蛋白可以通过结合NKG2D激活NK细胞、CD8+ T细胞和γδT细胞,从而参与免疫监视和免疫清除的过程。已有研究证实,NKG2D和ULBP1配体在多种肿瘤中相互作用,在免疫细胞靶向并杀伤细胞中起重要作用 [6]。
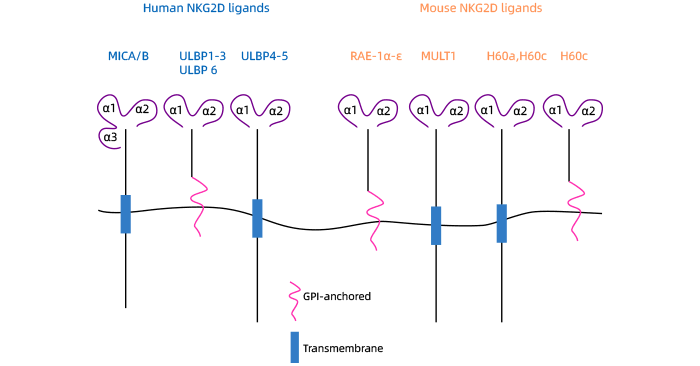
图2. 人和鼠NKG2D ligands的结构 [5]
3. ULBP1在NKG2D/NKG2DL系统中的作用机制
大量研究已揭示,NKG2D/NKG2DL系统在肿瘤免疫治疗中扮演重要作用。该系统可诱导癌细胞表达NKG2DL,使得这些细胞易受NK细胞杀伤,充分说明NKG2D/NKG2DL系统在肿瘤免疫排斥和监测中的作用,使该系统成为免疫治疗的重要靶点(点击查看“NKG2D,一个极具潜力的CAR-T和CAR-NK靶点”相关报道文章)。然而,NKG2DL诱导所涉及的机制在很大程度上是未知的。
为了解诱导癌细胞表达NKG2DL的机制,一项研究首次报道了ULBP1基因转录的调节功能特征。研究表明,Sp3和Sp1在ULBP1启动子活性和蛋白质表达中发挥着重要作用。这些转录因子在体外和体内都能与位于ULBP1基因最小启动子的CRE(1)位点结合,证明了ULBP1的表达严格依赖于Sp1/Sp3的活性 [7]。
此外,在HeLa和HEK293细胞中,突变或删除Sp1/Sp3结合位点会几乎完全抑制ULBP1启动子的活性,进而影响对癌细胞或感染细胞的免疫反应。研究结果还表明,ULBP1的表达可能受AP-2α的调节,AP-2α下调HeLa细胞中ULBP1的表达(图3) [7]。
另有研究发现,丙型肝炎病毒蛋白NS3/4A抑制了ULBP1启动子的活性,并且这一抑制作用随着NS3/4A表达量的增加而增加 [8]。此外,IL15可通过激活NK细胞ULBP1/NKG2D信号,抑制食管癌细胞的迁移和侵袭 [9-10]。
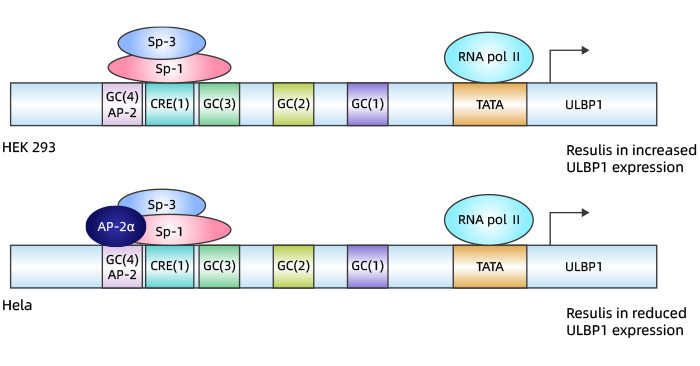
图3. ULBP1转录调控模型 [7]
4. ULBP1在肿瘤中的作用
NKG2DL的表达在特定肿瘤或感染细胞中存在显着差异,也就是说,不同的刺激或病理状态可能引起不同NKG2DL的表达。陆续研究表明,ULBP1在多种类型的肿瘤细胞,包括白血病、淋巴瘤、黑色素瘤、乳腺癌、肺癌和胃癌等表达上调 [11-13]。ULBP1与NK细胞和T细胞上的NKG2D的相互作用可以激活它们对肿瘤细胞的细胞毒性活动。
在原发性神经胶质瘤细胞中,存在MICA和ULBP1、ULBP2、ULBP3表达,但极少表达MICB [14-15]。在原发性白血病和恶性黑色素瘤中,主要表达ULBP分子。在卵巢癌细胞中,MICA、ULBP1、ULBP3低水平表达,而ULBP2表达水平较高 [16-17]。
在卵巢癌和头颈部鳞癌中,ULBP1表达水平与患者生存率呈正相关 [18-20];而在结直肠癌和胰腺癌中,ULBP1表达水平与患者生存率呈负相关 [21-22]。进一步研究提示,p53可以明显上调人NKG2D配体ULBP1、ULBP2在肿瘤细胞表面的表达,进而增强NK细胞的杀伤作用 [23]。
在白血病或淋巴瘤中,存在非常广泛的ULBP1表达水平。研究人员发现,淋巴瘤细胞表达高水平的ULBP1时更容易被γδ T细胞攻击。在不同的淋巴瘤患者中,ULBP1的表达水平存在很大差异,提示ULBP1可作为生物标志物,预测哪些患者会对γδ T细胞免疫疗法产生良好的反应 [24]。
5. ULBP1的临床在研药物
目前,一些针对ULBP1的临床在研药物已经进入到临床试验阶段 (表1)。例如,美国Celyad公司开发的靶向ULBP1的CAR-T药物(CYAD-01,又名CAR-T NKG2D)已处于临床2期。早期临床数据已显示,CYAD-01在针对复发难治性AML的临床试验中,出现第一个CR(完全缓解)的患者,其结果令人振奋。此外,抗ULBP1单抗也处于早期开发阶段,预计未来几年将进入临床试验。这些基于NKG2D/NKG2DL系统的靶向药物的成功研发和应用,将为血液肿瘤治疗提供新的方向和希望!
| 药物名称 | 靶点 | 作用机制 | 药物类型 | 在研适应症 | 在研机构 | 全球最高研发状态 |
|---|---|---|---|---|---|---|
| CYAD-01 | ULBP1 | ULBP1调节剂 | CAR-T | 骨髓增生性疾病; 急性髓性白血病; 多发性骨髓瘤; 骨髓增生异常综合征; 结直肠癌; 结肠癌肝转移; 结肠癌 |
Dartmouth College;Ono Pharmaceutical Co., Ltd.;Celyad Oncology SA | 临床2期 |
| Anti-NKG2DL gamma delta CAR-T cell therapy | ULBP1 | T淋巴细胞替代物;基因转移;ULBP1抑制剂 | CAR-T | 结直肠癌;鼻咽癌;肿瘤;前列腺癌;肉瘤;胃癌 | CytoMed Therapeutics Ltd. | 临床1期 |
| KYK-2.0 IgG1 (NCI) | ULBP1 | ULBP1抑制剂 | ULBP1抑制剂 | / | / | 药物发现 |
表1. ULBP1临床研究进展
为鼎力协助各药企针对ULBP1在血液及实体瘤临床中的研究,CUSABIO推出ULBP1活性蛋白产品(CSB-MP887177HU;CSB-MP887177HUj1-B),助力您在ULBP1机制方面的研究或其潜在临床价值的探索。
ULBP1 蛋白:
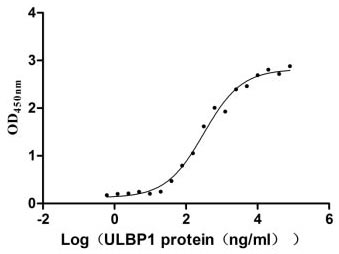
● Recombinant Human UL16-binding protein 1(ULBP1) (Active) (CSB-MP887177HU)

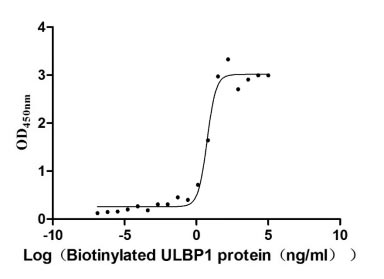
● RRecombinant Human UL16-binding protein 1(ULBP1),Biotinylated (Active) (CSB-MP887177HUj1-B)

参考文献:
[1] Sallman, David A., et al. "CYAD-01, an autologous NKG2D-based CAR T-cell therapy, in relapsed or refractory a cute myeloid leukaemia and myelodysplastic syndromes or multiple myeloma (THINK): haematological cohorts of the dose escalation segment of a phase 1 trial." The Lancet Haematology 10.3 (2023): e191-e202.
[2] Lanier, Lewis L. "NKG2D receptor and its ligands in host defense." cancer immunology research 3.6 (2015): 575-582.
[3] Jones, Amber B., et al. "Regulation of NKG2D stress ligands and its relevance in cancer progression." Cancers 14.9 (2022): 2339.
[4] Baumeister, Susanne H., et al. "Phase I Trial of Autologous CAR T Cells Targeting NKG2D Ligands in Patients with AML/MDS and Multiple MyelomaPhase I Trial of NKG2D-CAR T cells in AML/Myeloma." Cancer immunology research 7.1 (2019): 100-112.
[5] Wu, J., & Wang, X. (2011). NKG2D-Based Cancer Immunotherapy. inTech. doi: 10.5772/23523
[6] Cho, Hanbyoul, et al. "MICA/B and ULBP1 NKG2D ligands are independent predictors of good prognosis in cervical cancer." BMC cancer 14 (2014): 1-11.
[7] López-Soto, Alejandro, et al. "Transcriptional regulation of ULBP1, a human ligand of the NKG2D receptor." Journal of Biological Chemistry 281.41 ( 2006): 30419-30430.
[8] Ma, H. F., et al. "The construction of reporter plasmid of ULBP1 and preliminary studying on the influence of NS3/4A on transcription of ULBP1." Xi bao yu fen zi Mian yi xue za zhi= Chinese Journal of Cellular and Molecular Immunology 25.6 (2009): 483-485.
[9] Dong Liang, et al. "IL-15 inhibits migration and invasion of esophageal cancer cells by activating NK cell ULBP1/NKG2D signaling in co-culture system." Chinese Journal of Immunology 39.03: 466.
[10] Hu, Baoguang, et al. "Epithelial-mesenchymal transition may be involved in the immune evasion of circulating gastric tumor cells via downregulation of ULBP1." Cancer Medicine 9.8 (2020): 2686-2697.
[11] Qi, Feng, et al. "Tumor mutation burden-associated LINC00638/miR-4732-3p/ULBP1 axis promotes immune escape via PD-L1 in hepatocellular carcinoma." Frontiers in Oncology 11 (2021): 729340.
[12] Textor, Sonja, et al. "Human NK Cells Are Alerted to Induction of p53 in Cancer Cells by Upregulation of the NKG2D Ligands ULBP1 and ULBP2ULBP1 and ULBP2 Are Direct p53 Target Genes." Cancer research 71.18 (2011): 5998-6009.
[13] Nanbakhsh, Arash, et al. "c-Myc regulates expression of NKG2D ligands ULBP1/2/3 in AML and modulates their susceptibility to NK-mediated lysis." Blood , The Journal of the American Society of Hematology 123.23 (2014): 3585-3595.
[14] Jung, Tae-Young, et al. "Immunological characterization of glioblastoma cells for immunotherapy." Anticancer research 33.6 (2013): 2525-2533.
[15] Choi, Haeyoun, et al. "Human allogenic γδ T cells kill patient-derived glioblastoma cells expressing high levels of DNAM-1 ligands. "OncoImmunology 11.1 (2022): 2138152.
[16] Sutherland, Claire L., et al. "ULBPs, human ligands of the NKG2D receptor, stimulate tumor immunity with enhancement by IL-15." Blood 108.4 (2006): 1313 -1319.
[17] Morgado, Sara, et al. "NK cell recognition and killing of melanoma cells is controlled by multiple activating receptor-ligand interactions." Journal of innate immunity 3.4 (2011): 365-373.
[18] Cho, Hanbyoul, et al. "MICA/B and ULBP1 NKG2D ligands are independent predictors of good prognosis in cervical cancer." BMC cancer 14 (2014): 1-11.
[19] Carlsten, Mattias, et al. "DNAX accessory molecule-1 mediated recognition of freshly isolated ovarian carcinoma by resting natural killer cells." Cancer research 67.3 (2007): 1317-1325.
[20] Saito, Hiroki, et al. "A combined lymphokine-activated killer (LAK) cell immunotherapy and adenovirus-p53 gene therapy for head and neck squamous cell carcinoma." Anticancer research 34.7 (2014): 3365-3370.
[21] Kim, So-Jung, et al. "COX-2- and endoplasmic reticulum stress-independent induction of ULBP-1 and enhancement of sensitivity to NK cell-mediated cytotoxicity by celecoxib in colon cancer cells." Experimental Cell Research 330.2 (2015): 451-459.
[22] Chen, Jiong, et al. "Expression and prognostic significance of unique ULBPs in pancreatic cancer." OncoTargets and therapy (2016): 5271-5279.
[23] Textor, Sonja, et al. "Human NK Cells Are Alerted to Induction of p53 in Cancer Cells by Upregulation of the NKG2D Ligands ULBP1 and ULBP2ULBP1 and ULBP2 Are Direct p53 Target Genes." Cancer research 71.18 (2011): 5998-6009.
[24] Lanca, Telma, et al. "The MHC class Ib protein ULBP1 is a nonredundant determinant of leukemia/lymphoma susceptibility to γδ T-cell cytotoxicity." Blood, The Journal of the American Society of Hematology 115.12 (2010): 2407-2411.











