两种类型的巨噬细胞:M1型和M2型巨噬细胞
日期:2023-11-28 09:18:56
巨噬细胞是常见的噬菌细胞,属于免疫细胞的一种。它是一种分布在组织中的白细胞,起源于单核细胞。巨噬细胞具有可塑性和多功能性的特点。它在清除老化或凋亡细胞、吞噬与免疫相关的复合物和病原体,以及维持体内稳态方面发挥着重要作用。巨噬细胞的表型和功能可能会受到微环境的极化影响。

图1. 巨噬细胞的可塑性
1. 巨噬细胞分类
根据巨噬细胞的活化状态和功能,它们可以分为M1型(经典活化巨噬细胞)和M2型(替代活化巨噬细胞)[1] [2]。
IFN-γ可以将巨噬细胞分化为促炎性的M1巨噬细胞。与IFN-γ不同,Th2细胞产生的IL-4 [3]可以将巨噬细胞转化为抑制炎症的M2型巨噬细胞。
M1巨噬细胞的作用是分泌促炎性细胞因子和趋化因子,呈递抗原,从而参与积极的免疫应答,作为免疫监视的功能。它产生的主要促炎细胞因子是IL-6、IL-12和TNF-alpha。
M2巨噬细胞主要分泌Arginase-I、IL-10 [4] [5] 和TGF-β等抗炎细胞因子,具有减少炎症和促进肿瘤生长及免疫抑制功能 [6]。它在伤口愈合和组织修复中发挥重要作用。
总之,巨噬细胞是一把“双刃剑”,它既可以阻止癌细胞的扩散,也可以帮助癌细胞的生长和扩散。在特定的微环境中,M1和M2巨噬细胞也可以相互转化 [7]。
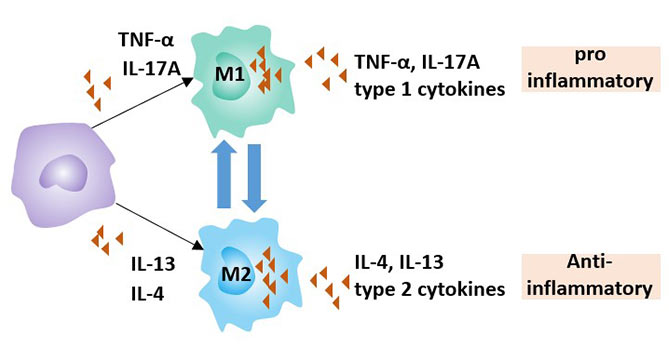
图2. 巨噬细胞的类型
2. 巨噬细胞功能的两个方面
巨噬细胞在肿瘤杀伤方面的积极作用:活化的巨噬细胞产生TNF、水解蛋白酶、干扰素和过氧化物,直接杀伤或抑制肿瘤细胞的生长。活化的巨噬细胞分泌IL-1并激活T细胞产生各种抗肿瘤的细胞毒性淋巴细胞,这些细胞可以直接杀伤肿瘤,或者通过活化的LAK细胞、肿瘤浸润淋巴细胞或NK细胞与巨噬细胞合作来杀伤肿瘤。
巨噬细胞促进肿瘤生长和转移:巨噬细胞促进肿瘤生长和转移的机制是,巨噬细胞产生肿瘤生长促进物质,如肿瘤血管生长因子、人类肿瘤单克隆细胞生长因子和一些酶和激活因子,可以分别导致肿瘤血管生成和促进肿瘤细胞扩张。
另一方面,巨噬细胞分泌的酶破坏了肿瘤周围的组织,促进了肿瘤细胞的增殖和转移。巨噬细胞的恶性转化也导致肿瘤转移。
3. 影响巨噬细胞极化的转录因子和信号通路
巨噬细胞的表型和功能极化受多种因素调控。影响巨噬细胞极化的信号传导体和转录活化因子如下:STATs、干扰调节因子(IRFs)、核因子(NF-kappab)、激活蛋白(AP1)、过氧化物酶体增殖激活受体(PPAR-gamma)和cAMP响应元结合蛋白(CREB)。它们相互作用以调节巨噬细胞的表型。
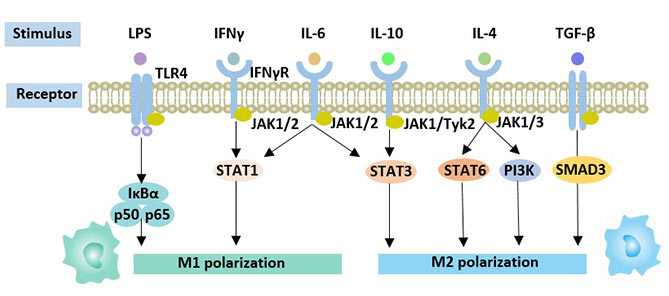
图3. 影响巨噬细胞极化的因素
Notch通路通过控制基因表达调控巨噬细胞极化,从而调节免疫应答。
髓源性巨噬细胞在LPS和toll样受体的刺激下激活Notch1和NF-kappab,从而使m1型巨噬细胞极化。Notch1依赖性M1极化的一种分子机制是NICD1对M1型基因的反激活,从而产生Notch1激活的效应 [8]。此外,IRF5与M1巨噬细胞极化有关,可被动脉粥样硬化中的炎症刺激 [9],IRF5蛋白的硝化作用可抑制IRF5靶向的M1巨噬细胞信号基因激活 [10]。
JAK-STAT信号通路也与巨噬细胞的表型活性密切相关 [11]。IFN(干扰素)通过这一信号通路起作用。IFN-γ可诱导M1巨噬细胞极化。IFN-α/IFN-β介导的信号通路在巨噬细胞极化中的作用尚不清楚,但已知在一定条件下可增强抗炎作用。
PI3K通路在巨噬细胞的存活中起着重要作用 [12]。不同AKt激酶对巨噬细胞极化的影响不同。其中,AKt1可被PI3K激活,AKt1消融导致m1型巨噬细胞极化,AKt2消融导致m2型巨噬细胞极化 [13][14]。
除了上述信号通路外,线粒体生物合成在巨噬细胞极化过程中也起着重要作用 [15]。此外,HGF通过激活JAK2/STAT3信号通路,促进巨噬细胞从M1向M2的转化。但其分子机制尚不清楚。
4. 跨度巨噬细胞标记
CD68和CD11b是巨噬细胞的总标记。对于M1和M2巨噬细胞,它们有特定的标记。
4.1 M1巨噬细胞标记
M1巨噬细胞可以选择CD80、CD86、CD64、CD16和CD32作为标记。此外,M1中的一氧化氮合酶(iNOS)的表达也可以作为表型标记。
● CD80
CD80,又称B7、B7.1或BB1,是T淋巴细胞激活抗原。它的分子量为60 kD。它与CD86协同作用,激活T淋巴细胞,在自身免疫监测、体液免疫应答和移植应答中发挥重要作用。
● CD86
CD86,又称B7.2,是T淋巴细胞激活抗原,分子量为80 kD,可以在树突状细胞、单核细胞、T淋巴细胞和B淋巴细胞中表达。CD86与其配体CD28和CTLA4相互作用,诱导T淋巴细胞增殖并产生IL-2。
● CD64
CD64,又称高亲和力免疫球蛋白γ Fc受体Ⅰ,具有先天免疫反应和适应性免疫反应的功能。
● CD32
CD32也称为低亲和力免疫球蛋白γ Fc区域受体Ⅱ-b,参与免疫复合物的吞噬和B细胞对抗体生成的调控。
4.2 M2巨噬细胞标记
CD163和CD206是鉴定M2巨噬细胞的主要标记 [16] [17] [18]。与M2型细胞相关的表面标记还包括CD68。与标记CD68相比,CD163对巨噬细胞更具选择性,因此CD163可以作为M2型巨噬细胞的高度特异性标记 [19]。
此外,精氨酸酶1(Arg1)[20]和DECTIN-1也是用于鉴定M2巨噬细胞的理想表型指标。
研究还显示,FIZZ1、Ym1和Ly6C [21] [22]也可以用作与M1或M2巨噬细胞亚群相关的表面标记。
● CD206
CD206,也称为甘露糖受体1,是一种主要存在于巨噬细胞和未成熟树突状细胞中的C型凝集素。它促进巨噬细胞的活化、抗原呈递和免疫反应 [23]。
● CD163
CD163是高度特异的M2型肿瘤相关巨噬细胞标记,主要在单核细胞和巨噬细胞表面表达。CD163属于富含半胱氨酸的B家族类蛋白。它仅在单核巨噬细胞系中表达。
CD163不仅可以抵抗炎症,还作为肿瘤相关巨噬细胞家族成员,在肿瘤增殖和转移方面发挥重要作用。研究表明,CD163与乳腺癌、膀胱癌、肺癌、结直肠癌等恶性肿瘤密切相关 [24]。CD163的浸润程度影响肿瘤的增殖、侵袭、转移和预后。
● CD68
CD68参与巨噬细胞的吞噬活性。从内体和溶酶体快速循环到质膜上,这可能允许在选择素底物或其他细胞上识别它。
最近的研究表明,仅在髓系细胞中表达MS4A4A,且在单核细胞衍生的M1和M2巨噬细胞中调节不同 [25],可以用作区分M1和M2巨噬细胞的标记。
在M1或M2巨噬细胞中最显著的基因中,CD38、Gpr18和Fpr2是新的M1标记,而Egr2和C-MYC是M2标记。基于CD38/Egr2的流式细胞术可以区分M1和M2巨噬细胞,并且在经典的iNOS、精氨酸酶-1和CD206表型标记方面具有优势 [26]。
5. 巨噬细胞与疾病
巨噬细胞参与组织中病原体的清除。当激活时,巨噬细胞可以吞噬和杀灭病原微生物,释放促炎因子,并收集和激活淋巴细胞以诱导适应性免疫反应。
巨噬细胞功能异常可能导致多种疾病。M1型巨噬细胞不仅与传染病和炎症性疾病有关,还与动脉硬化和胰岛素抵抗等代谢性疾病有关。M2巨噬细胞也与多种疾病的发展有关。
6. 相关产品
● j9九游会登录入口首页生物精选重组蛋白
Code: CSB-BP624104HU(M)
-AC1.jpg)
-SDS.jpg)
Measured by its binding ability in a functional ELISA. Immobilized Human IL17A at 2 μg/ml can bind Anti-IL17A recombinant antibody (CSB-RA624104MA1HU), the EC50 is 1.818-2.170 ng/mL.
Code: CSB-YP011664HU
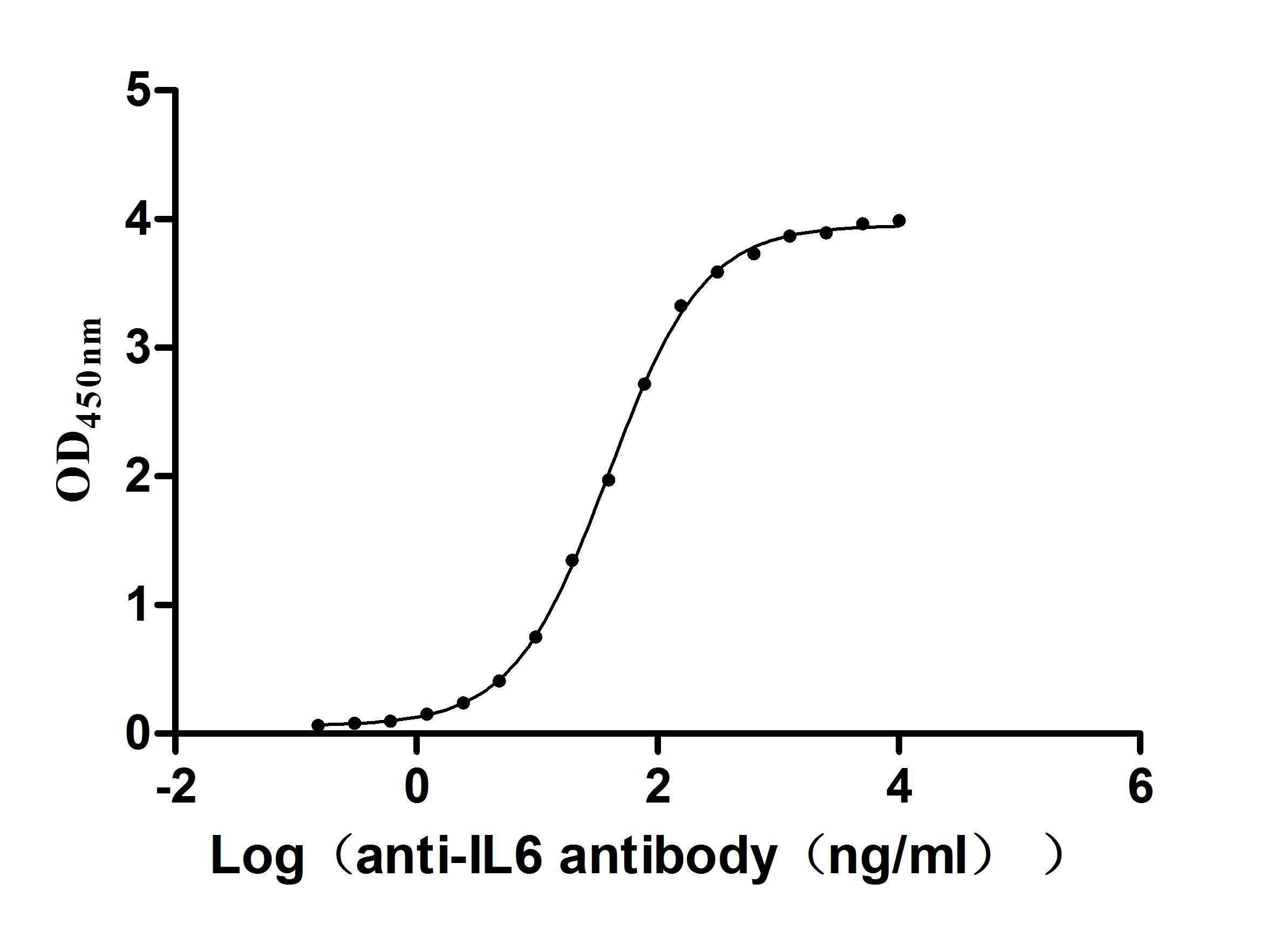
Measured by its binding ability in a functional ELISA. Immobilized Human IL6 at 2μg/mL can bind Anti-IL6 recombinant antibody (CSB-RA011664MA1HU),the EC50 is 35.80-41.82 ng/mL
● j9九游会登录入口首页生物精选抗体
CSB-RA801238A0HU
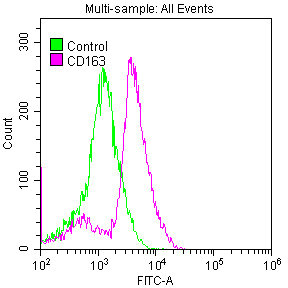
Overlay histogram showing Raw264.7 cells stained with CSB-RA801238A0HU (red line) at 1:50.
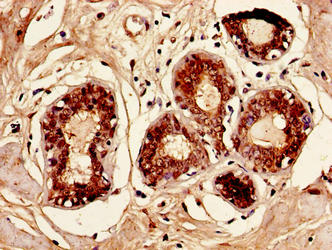
Immunohistochemistry of paraffin-embedded human breast cancer using CSB-PA05865A0Rb at dilution of 1:100
CSB-MA015943A0m
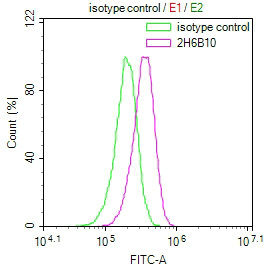
Overlay Peak curve showing HepG2 cells stained with CSB-MA015943A0m (red line) at 1:50.
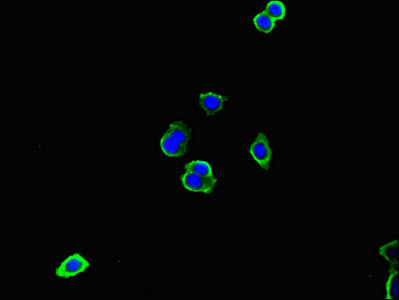
Immunofluorescent analysis of HepG2 cells using CSB-PA011590LA01HU at dilution of 1:100.
● j9九游会登录入口首页生物精选ELISA试剂盒
检测范围:
6.25 pg/mL-400 pg/mL
检测范围:
15.6 pg/ml-1000 pg/ml
检测范围:
7.8 pg/mL-500 pg/mL
检测范围:
7.8 pg/mL-500 pg/mL
参考文献:
[1] Germano G, Frapolli R, Belgiovine C, et al. Role of Macrophage Targeting in the Antitumor Activity of Trabectedin [J]. Cancer cell, 2013, 23(2): 249-262.
[2] Mosser D M, Edwards J P. Exploring the full spectrum of macrophage activation [J]. NATURE REVIEWS IMMUNOLOGY, 2008, 8(12): 958-969.
[3] Abramson S L, Gallin J I. IL-4 inhibits superoxide production by human mononuclear phagocytes [J]. Journal of Immunology, 1990, 144(2): 625-630.
[4] Biswas S K, Mantovani A. Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm [J]. Nature Immunology, 2010, 11(10): 889-896.
[5] Grohmann U, Belladonna M L, Vacca C, et al. Positive Regulatory Role of IL-12 in Macrophages and Modulation by IFN-γ [J]. The Journal of Immunology, 2001, 167(1): 221-227.
[6] Ginderachter J A V, Movahedi K, Ghassabeh G H, et al. Classical and alternative activation of mononuclear phagocytes: Picking the best of both worlds for tumor promotion [J]. 2006, 211(6-8): 0-501.
[7] Wynn T A, Chawla A, Pollard J W. Macrophage biology in development, homeostasis and disease [J]. Nature, 2013, 496(7446): 445-455.
[8] Xu J, Chi F, Tsukamoto H. Notch signaling and M1 macrophage activation in obesity-alcohol synergism [J]. Clinics and Research in Hepatology and Gastroenterology, 2015, 39: S24-S28.
[9] Saliba D, Heger A, Eames H, et al. IRF5: RelA Interaction Targets Inflammatory Genes in Macrophages [J]. Cell Reports, 2014, 8(5): 1308-1317.
[10] Lu G, Zhang R, Geng S, et al. Myeloid cell-derived inducible nitric oxide synthase suppresses M1 macrophage polarization [J]. Nature Communications, 2015, 6: 6676.
[11] Hall C J, Boyle R H, Astin J W, et al. Immunoresponsive gene 1 augments bactericidal activity of macrophage-lineage cells by regulating β-oxidation-dependent mitochondrial ROS production [J]. Cell Metabolism, 2013, 18(2): 265-278.
[12] Zizzo G, Cohen P L. IL-17 Stimulates Differentiation of Human Anti-Inflammatory Macrophages and Phagocytosis of Apoptotic Neutrophils in Response to IL-10 and Glucocorticoids [J]. The Journal of Immunology, 2013, 190(10): 5237-5246.
[13] Arranz A, Doxaki C, Vergadi E, et al. Akt1 and Akt2 protein kinases differentially contribute to macrophage polarization [J]. Proceedings of the National Academy of Sciences, 2012, 109(24): 9517-9522.
[14] Xu F, Kang Y, Zhang H, et al. Akt1-Mediated Regulation of Macrophage Polarization in a Murine Model of Staphylococcus aureus Pulmonary Infection [J]. Journal of Infectious Diseases, 2013, 208(3): 528-538.
[15] Macgarvey N C, Suliman H B, Bartz R R, et al. Activation of mitochondrial biogenesis by heme oxygenase-1-mediated NF-E2-related factor-2 induction rescues mice from lethal Staphylococcus aureus sepsis [J]. American Journal of Respiratory & Critical Care Medicine, 2012, 185(8): 851-61.
[16] Tedescoa S, Bolegoa C, Tonioloa A, et al. Phenotypic activation and pharmacological outcomes of spontaneously differentiated human monocyte-derived macrophages [J]. Immunobiology, 2015, 220(5): 545-554.
[17] Rebelo S P, Pinto C, Martins T R, et al. 3D-3-culture: A tool to unveil macrophage plasticity in the tumour microenvironment [J]. Biomaterials, 2018.
[18] Wang S, Zhang J, Sui L, et al. Antibiotics induce polarization of pleural macrophages to M2-like phenotype in patients with tuberculous pleuritis [J]. Scientific Reports, 2017, 7(1).
[19] Shabo I, Svanvik J. Expression of macrophage antigens by tumor cells [J]. Oxygen Transport to Tissue XXXIII, 2011, 714: 141-150.
[20] Stoermer K A, Burrack A, Oko L, et al. Genetic Ablation of Arginase 1 in Macrophages and Neutrophils Enhances Clearance of an Arthritogenic Alphavirus [J]. The Journal of Immunology, 2012, 189(8): 4047-4059.
[21] Raes G, Baetselier P D, Wim No?l, et al. Differential expression of FIZZ1 and Ym1 in alternatively versus classically activated macrophages [J]. Journal of Leukocyte Biology, 2002, 71(4): 597.
[22] Dragomir A C D, Sun R, Choi H, et al. Role of Galectin-3 in Classical and Alternative Macrophage Activation in the Liver following Acetaminophen Intoxication [J]. The Journal of Immunology, 2012, 189(12): 5934-5941.
[23] Lawrence T, Natoli G. Transcriptional regulation of macrophage polarization: enabling diversity with identity [J]. NATURE REVIEWS IMMUNOLOGY, 2011, 11(11): 750-761.
[24] Shabo I, Olsson H, Elkarim R, et al. Macrophage Infiltration in Tumor Stroma is Related to Tumor Cell Expression of CD163 in Colorectal Cancer [J]. Cancer Microenvironment, 2014, 7(1-2): 61-69.
[25] Sanyal R, Polyak M J, Zuccolo J, et al. MS4A4A: a novel cell surface marker for M2 macrophages and plasma cells [J]. Immunology and Cell Biology, 2017.
[26] Jablonski K A, Amici S A, Webb L M, et al. Novel Markers to Delineate Murine M1 and M2 Macrophages [J]. PLOS ONE, 2015, 10(12): e0145342-.
上一篇: 胶质纤维酸性蛋白-胶质细胞特异性标记物
下一篇: 淋巴细胞的表面标志物











