TMPRSS2,SARS-CoV-2入侵激活因子
日期:2023-12-12 16:09:20
随着COVID-19在全球范围内传播,科学家们努力探索SARS-CoV-2侵入机制。已经报道了许多SARS-CoV-2与宿主相互作用的靶点,例如ACE2、TMPRSS2和CD147。SARS-CoV-2与TMPRSS2之间的关系首次在题为“新型冠状病毒2019(2019-nCoV)使用SARS冠状病毒受体1 ACE2和细胞蛋白酶TMPRSS2进入目标细胞”的研究中得到了报道[1]。此后,关于TMPRSS2的研究越来越多地被发表。那么,TMPRSS2是什么?SARS-CoV-2如何通过TMPRSS2侵入人体?
1. TMPRSS2的定义
跨膜蛋白酶丝氨酸酶2,也称为TMPRSS2,是跨膜蛋白酶丝氨酸酶(TMPRSSs)家族的成员,这是一类在细胞膜上具有保守的丝氨酸蛋白酶结构域的蛋白质。TMPRSSs的基本结构相似。C末端的蛋白酶结构域位于细胞外,N末端位于细胞内,并且还具有单一的跨膜结构域。区别在于骨架区域。
正如图1所示,TMPRSS2基因位于人类染色体21:41, 464, 551-41, 531, 116。TMPRSS2基因的一个显著特征是多个雄激素受体元件(AREs)位于转录起始位点和第一个内含子的上游[2] [3]。
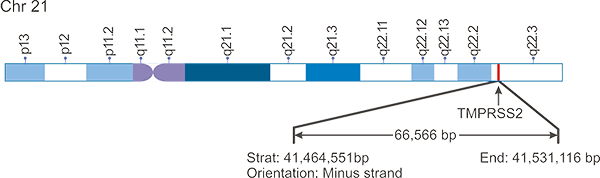
图1. TMPRSS2基因组定位示意图
*图片来源于Biochimie发表的一篇文章 [2]
由TMPRSS2基因编码的TMPRSS2蛋白质由492个氨基酸组成,可锚定到细胞质膜。正如图2所示,它通过Arg255和Ile256之间的自体催化剪切转化为其形式。剪切后,成熟的蛋白酶大多数都与膜结合,但其中有相当一部分可以释放到细胞外环境中。蛋白酶催化域含有一个催化三联体,由氨基酸残基His296,Asp345和Ser441组成,相应于胰蛋白酶原的His57,Asp102和Ser195 [4]。
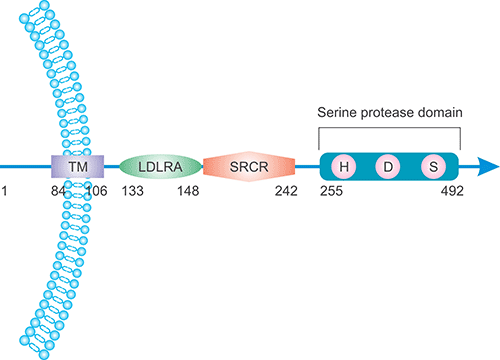
图2. TMPRSS2蛋白的定位和结构
*图片来源于Biochimie发表的一篇文章 [2]
2. TMPRSS2的分布情况
TMPRSS2的表达具有明显的组织特异性。人类TMPRSS2是一个雄激素调控的、II型跨膜丝氨酸蛋白酶,在前列腺中表达最为丰富,而在肺部、结肠、肝脏、肾脏和胰腺中表达较低水平。根据对小鼠胚胎和成体组织的原位杂交分析,小鼠TMPRSS2也在胃肠道、泌尿生殖道和呼吸道上皮细胞中表达,这表明TMPRSS2在小鼠和人类中的表达分布非常相似。这种组织特异性的表达也暗示,由异常TMPRSS2引起的疾病可能更偏向于男性而不是女性。
3. TMPRSS2的功能
TMPRSS2与前列腺癌密切相关。在2005年,大多数前列腺癌(高达70%)被发现具有TMPRSS2和雌激素调控基因(ERG)的融合,它们都位于染色体21上。此后不久,还发现了其他红细胞生成特异性(ETS)变异基因(ETV)家族的成员具有基因融合,尽管频率要低得多,包括ETV1(染色体7)、ETV4(染色体17)、ETV5(染色体3)和ETS结构域含蛋白基因(ELK4,染色体1)。
以TMPRSS2和ERG融合为例,基因融合,也称为基因重排,常常导致某些基因的异常激活。如图3所示,基因重排包括在同一染色体上两个基因之间实际的基因物质丧失;请注意在染色体21上TMPRSS2和ERG之间中间基因的缺失。融合的第二种形式是由于易位,即一个基因移动到同一染色体或不同染色体上的另一个位置。这两种机制都适用于前列腺癌中的基因重排。鉴于前列腺癌的高发病率,这种融合基因可能是人类癌症中最常见的融合基因。此外,TMPRSS2-ERG可以作为前列腺癌的诊断标志物。
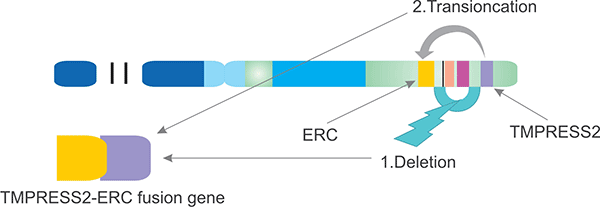
图3. TMPRESS2-ERG融合机制(21号染色体)
*图片来源于BJU Int上发表的文章 [5]
另外,除了在前列腺癌中的作用,TMPRSS2还与病毒有关。我们将在下一节中阐述这一功能。
4. TMPRSS2与病毒的联系
2019年,岩田佳奈子(Naoko Iwata-Yoshikawa)等人的研究显示,TMPRSS2激活高致病性人类冠状病毒的刺突蛋白,如严重急性呼吸综合症相关冠状病毒(SARS-CoV)和中东呼吸综合症相关冠状病毒(MERS-CoV)。体外实验中,TMPRSS2的激活诱导病毒与细胞膜在细胞表面融合。在这项研究中,他们使用SARS-CoV和MERS-CoV感染的动物模型研究了TMPRSS2的作用。结果显示,在呼吸道缺乏TMPRSS2可以减轻SARS-CoV和MERS-CoV感染后肺部病理的严重程度 [6]。
实际上,早在2011年,Ilona Glowacka和其他来自德国汉诺威医学院的研究人员就评估了TMPRSS2是否通过其进行SARS-CoV的S蛋白质的蛋白水解。在这项研究中,Western blot分析的结果显示,TMPRSS2的共表达(顺式裂解)和SARS S表达细胞与TMPRSS2阳性细胞接触(反式裂解)时,SARS S被裂解成几个片段。顺式裂解导致SARS S片段释放到细胞上清液中,并抑制抗体介导的中和作用。反式裂解激活了效应细胞上的SARS S与靶细胞融合。这表明TMPRSS2可能通过减少病毒被中和抗体识别以及激活SARS S进行细胞间和病毒细胞融合来促进病毒传播和病理进程 [7]。
5. SARS-CoV-2通过TMPRSS2侵入人体的途径
SARS-CoV-2,一种冠状病毒,与SARS-CoV具有相似的中心生物特性和类似的结构。关于冠状病毒通过涉及TMPRSS2进入细胞的方式,早在2013年就有两项研究报告。其中一种方式是细胞表面通过TMPRSS2介导,另一种方式是通过细胞核中的蛋白酶L介导。Stefanie Gierer等人发现TMPRSS2和半胱氨酸蛋白酶B和L可以激活新型人冠状病毒EMC(hCoV-EMC)并与靶细胞融合。因此,TMPRSS2和半胱氨酸蛋白酶已成为控制hCoV-EMC的潜在靶点 [8] [9]。2014年,Adeline Heurich和其他人再次证明了TMPRSS2和HAT在冠状病毒中的作用。他们发现这两种酶可以裂解并激活SARS-CoV的刺突蛋白以进行膜融合。此外,这些酶还可以裂解SARS-CoV受体ACE2 [10]。
在2020年,随着COVID-19在全球爆发,Markus Hoffmann等人进一步证明了冠状病毒使用其刺突蛋白来选择和进入靶细胞,并且SARS-CoV-2刺突(S)驱动的入侵机制可能有助于评估大流行潜力并揭示治疗靶点。在他们的研究中,他们证明SARS-CoV-2-S使用SARS-CoV受体ACE2进入,而使用细胞蛋白酶TMPRSS2进行SARS-CoV-2-S的初级加工。TMPRSS2抑制剂可以阻止入侵,可能成为一种治疗选择。这些结果揭示了SARS-CoV-2和SARS-CoV感染之间的重要共同点,可能转化为类似的传播能力和疾病发病机制 [1] [11]。
6. TMPRSS2研究的最新进展
在本节中,我们列出了TMPRSS2和SARS-CoV-2研究的一些最新进展,如下所示:
• 2021年4月12日,斯坦福大学和爱荷华大学团队创建了一种名为3DPhyloFold的基于结构的系统演化计算工具,以系统地识别具有已知治疗性抑制剂的结构相似的丝氨酸蛋白酶(TMPRSS2),并在体外和体内展示了对SARS-CoV-2感染的有效抑制作用 [12]。
• 2021年3月19日,乌尔姆大学医学中心团队报告称,急性相蛋白α1AT是TMPRSS2和SARS-CoV-2入侵的抑制剂,可能在对抗新型冠状病毒的先天免疫防御中发挥重要作用 [13]。
• 2021年3月11日,长庚大学团队揭示,暴露于空气污染和潜在的IPF(特发性肺纤维化)增加了SARS-CoV-2感染和COVID-19疾病严重程度的风险。这可能通过在肺纤维母细胞中上调ACE2和TMPRSS2并通过阻断IL-8/CXCR1/2途径来实现 [14]。
• 2021年1月26日,意大利圣马泰奥大学医学中心团队证明,来自不同人体组织的间充质干细胞(MSCs)不会对SARS-CoV-2感染具有感受性,这支持MSCs作为COVID-19潜在治疗方法的安全性 [15]。
• 2021年1月,北海道大学的研究团队的研究数据表明,它们无法利用与宿主II型跨膜丝氨酸蛋白酶TMPRSS2介导的直接融合入侵途径。这项研究证明S蛋白多碱性裂解基序是决定SARS-CoV-2入侵和细胞病毒组织特异性的关键因素 [16]。
7. 面向SARS-CoV-2治疗的靶向TMPRSS2的药物
越来越多的证据表明,TMPRSS2是SARS-CoV-2(COVID-19)治疗中的一个重要靶点。我们将以下列方式搜集了针对SARS-CoV-2治疗的靶向TMPRSS2的药物的最新临床数据:
| 标题 | 药物类型 | 适应症 | 阶段 | 单位名称 | 最后更新日期 |
|---|---|---|---|---|---|
| Low-dose Hydroxychloroquine and Bromhexine: a Novel Regimen for COVID-19 Prophylaxis in Healthcare Professionals (ELEVATE Trial) | 有机杂环类药物 | 羟氯喹;抗疟药; 酶抑制剂; Antirheumatic Agents | 1期早期 |
国家康复研究所 | 2021年4月5日 |
| Randomized Trial of Bicalutamide to Block TMPRSS2 in Males With COVID-19 Infection | 有机杂环类药物 | 2019冠状病毒病 | 3期 | 佛罗里达大学 | 2021年1月27日 |
| RECOVER: Phase 2 Randomized, Double-Blind Trial TREating Hospitalized Patients With COVID-19 With Camostat MesilatE, a TMPRSS2 Inhibitor | 有机杂环类药物 | 严重急性呼吸系统综合症 | 2期 | 艾伦•布莱斯 | 2021年1月11日 |
| An Exploratory Analysis of the Expression of Receptors and Activating Proteases Mediating SARS-CoV-2 Entry and the Association Between HSD3B1 Gene Polymorphisms With Outcomes in SARS-CoV-2 Infected Patients | / | Covid19 | N/A | 艾伦•布莱斯 | 2020年8月18日 |
| RAndomized Clinical Trial in COvid19 Patients to Assess the Efficacy of the Transmembrane Protease Serine 2 (TMPRSS2) Inhibitor NAfamostat (RACONA Study) | 有机杂环类药物 | COVID19 | 2期/3期 | 帕多瓦大学医院 | 2020年4月20日 |
| Efficacy of Aerosol Combination Therapy of 13 Cis Retinoic Acid and Captopril for Treating Covid-19 Patients Via Indirect Inhibition of Transmembrane Protease, Serine 2 (TMPRSS2) | 有机杂环类药物 | Covid19 | 2期 | Kafrelsheikh 大学 | 2020年10月26日 |
参考文献:
[1] Markus Hoffmann, Hannah Kleine-Weber, et al. The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular protease TMPRSS2 for entry into target cells [J]. bioRxiv. 2020.
[2] Li Wen Shen, Hui Juan Mao, et al. TMPRSS2: A potential target for treatment of influenza virus and coronavirus infections [J]. Biochimie. 2017.
[3] Y. Park. TMPRSS2 (transmembrane protease, serine 2) [J]. Atlas. Genet. Cytogenet. Oncol. Haematol. 2010, 14: 1163−1165.
[4] B. Lin, C. Ferguson, et al. Prostate-localized and androgen-regulated expression of the membrane-bound serine protease TMPRSS2 [J]. Cancer Res. 1999, 59:4180−4184.
[5] Deloar Hossain and David G. Bostwick. Significance of the TMPRSS2: ERG gene fusion in prostate cancer [J]. BJU Int. 2013.
[6] Naoko Iwata-Yoshikawa, Tadashi Okamura, et al. TMPRSS2 Contributes to Virus Spread and Immunopathology in the Airways of Murine Models After Coronavirus Infection [J]. J Virol. 2019, 93(6):e01815-18.
[7] Ilona Glowacka, Stephanie Bertram, et al. Evidence That TMPRSS2 Activates the Severe Acute Respiratory Syndrome Coronavirus Spike Protein for Membrane Fusion and Reduces Viral Control by the Humoral Immune Response [J]. J Virol. 2011, 85(9):4122-34.
[8] Gierer S, Bertram S, et al. The spike protein of the emerging betacoronavirus EMC uses a novel coronavirus receptor for entry, can be activated by TMPRSS2, and is targeted by neutralizing antibodies [J]. J Virol. 2013, 87(10):5502-11.
[9] Bertram S, Dijkman R, et al. TMPRSS2 activates the human coronavirus 229E for cathepsin-independent host cell entry and is expressed in viral target cells in the respiratory epithelium [J]. J Virol. 2013, 87(11):6150-60.
[10] Heurich A, Hofmann-Winkler H, et al. TMPRSS2 and ADAM17 cleave ACE2 differentially and only proteolysis by TMPRSS2 augments entry driven by the severe acute respiratory syndrome coronavirus spike protein [J]. J Virol. 2014, 88(2):1293-307.
[11] Markus Hoffmann, Hannah Kleine-Weber, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor [J]. Cell. 2020, 181(2):271-280.
[12] Sun YJ, Velez G, Parsons DE, et al. Structure-based phylogeny identifies Avoralstat as a TMPRSS2 inhibitor that prevents SARS-CoV-2 infection in mice [J]. J Clin Invest. 2021, 147973.
[13] Wettstein L, Weil T, Conzelmann C, et al. Alpha-1 antitrypsin inhibits TMPRSS2 protease activity and SARS-CoV-2 infection [J]. Nat Commun. 2021;12(1):1726.
[14] Li HH, Liu CC, Hsu TW, et al. Upregulation of ACE2 and TMPRSS2 by particulate matter and idiopathic pulmonary fibrosis: a potential role in severe COVID-19 [J]. Part Fibre Toxicol. 2021, 18(1):11.
[15] Avanzini MA, Mura M, Percivalle E, et al. Human mesenchymal stromal cells do not express ACE2 and TMPRSS2 and are not permissive to SARS-CoV-2 infection [J]. Stem Cells Transl Med. 2021, 10(4):636-642.
[16] Sasaki M, Uemura K, Sato A, et al. SARS-CoV-2 variants with mutations at the S1/S2 cleavage site are generated in vitro during propagation in TMPRSS2-deficient cells [J]. PLoS Pathog. 2021, 17(1):e1009233.
下一篇: 不可小觑的流感











