抗体药物偶联物:全面指南
抗体药物偶联物(ADCs)是化疗和免疫疗法的一种强大组合。这个概念最早由德国科学家保罗·埃尔利希在100多年前提出。他将ADCs比作“魔法子弹”,因为它们可以特异性地识别目标(癌细胞),而不会对机体造成伤害,就像“狙击手”一样。近年来,随着越来越多的ADCs获得批准并上市,这种药物已成为当前全球生物技术药物研发中最热门的技术领域之一。那么,ADCs为什么如此令人惊奇?它们是如何实现“精准引导”的?本文收集了ADCs的一些常见问题,包括:
1. 什么是抗体药物偶联物?
抗体药物偶联物(ADCs)是一种新型生物药物,它将单克隆抗体药物的高特异性与小分子细胞毒药物的高活性结合在一起,以提高肿瘤药物的靶向性并减少毒性和副作用。
2. 抗体药物偶联物的结构
ADCs由三个主要部分组成:抗体负责选择性地识别癌细胞表面抗原,药物负责杀死癌细胞,连接剂用于将抗体与药物负载物连接在一起。
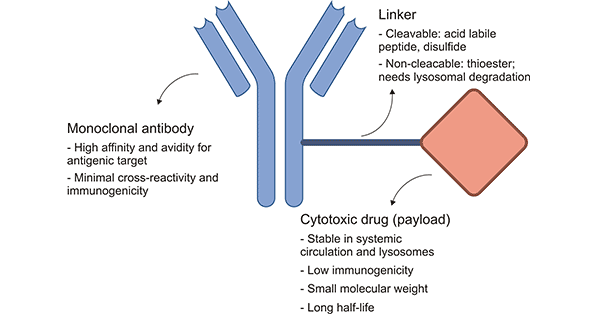
图1. ADCs的结构 [1]
3. 抗体药物偶联物是如何起作用的?
首先,将ADCs注射到体内后,经过许多障碍物后,它们会与目标细胞的抗原结合,形成ADCs-抗原复合物,并通过网格介导的内吞作用进入细胞。复合物进入细胞后,溶酶体与内体融合导致细胞内连接剂的裂解,释放和激活小分子细胞毒药物。药物释放到细胞质后,可以插入DNA或抑制微管聚合,杀死肿瘤细胞并导致靶细胞凋亡。当目标细胞死亡时,活性负荷还可能杀死周围的肿瘤细胞,这也被称为旁观效应。
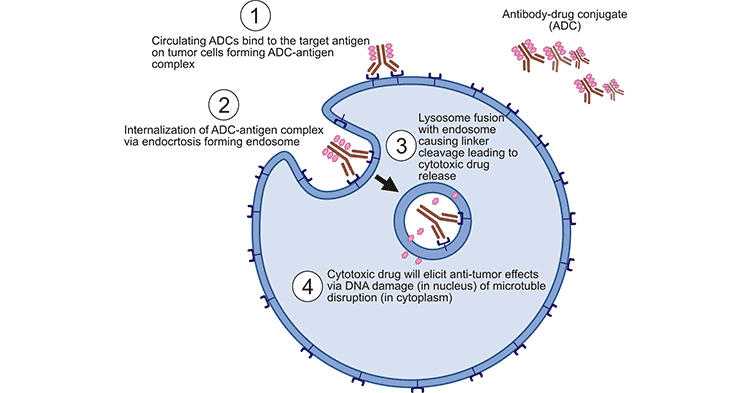
图1. ADCs的工作机制 [1]
4. 抗体药物偶联物的组成成分
4.1 靶点的选择
ADCs的成功开发取决于抗体对靶点的特异性结合。理想的ADCs靶点应在肿瘤细胞表面高表达,在正常细胞中低表达或不表达,并尽量减少对目标细胞和非肿瘤组织的毒性。除了特异性和足够的表达量外,最好的靶点还应该引起高效的内吞作用效应。
Target antigens in approved ADCs and selected
ADCs in late-stage clinical development
Target antigens regulated from
driver oncogenes
- HER2
- EGFR
Target antigens in the tumor
vasculature and stroma
图3. 正在开发和临床开发的adc靶点
4.2 抗体的选择
抗体应具有高的抗原亲和力和长的循环半衰期,以便在肿瘤部位特异性富集细胞毒素。考虑到不同IgG类型抗体的半衰期、结构稳定性、Fc段的免疫功能和偶联方便性,ADCs主要选择IgG1,但很少使用IgG4。根据抗体的免疫原性,它们可分为全人源化抗体、人源化抗体和嵌合抗体。为了减少免疫反应,通常选择完全人源化或人源化抗体。
4.3 药物负荷的选择
毒素分子(药物负荷)是ADCs研究和开发成功的关键因素。由于ADCs从进入人体到最终释放细胞毒素需要经历多个步骤,考虑到每个步骤的效率,药物负荷应具有高的抗肿瘤活性,因此纳摩尔水平(IC50值为0.01-0.1 nM)的毒性分子是合适的药物负荷。此外,药物负荷还必须具有适当的可偶联的功能基团、强大的细胞毒性、适当的亲水性-疏水性平衡以及高稳定性。
4.4 连接剂的选择
连接剂作为ADCs的桥梁,通过可裂解连接剂或不可裂解连接剂与抗体连接。连接剂需要精心设计,既需要在生理状态下具有稳定性,以防止链断裂,又需要在特定部位具有高释放效率。
5. 抗体药物偶联物的优势
与传统的完全或部分人源化抗体或抗体片段相比,ADCs具有更高的理论治疗效果,因为它们可以在肿瘤组织中释放高活性的细胞毒素。另一方面,ADCs的耐受性更高,副作用较低,与融合蛋白相比。它们可以精确识别目标并不影响正常细胞,大大提高了疗效并减少了毒性和副作用,因此在药物研发领域引起了人们的关注。
6. 抗体药物偶联物有哪些弱点?
ADCs的结构复杂,设计多样,这给与CMC研究相关的生产和质量控制带来了困难。同时,ADCs与体内复杂的生物过程叠加,也使非临床研究和临床研究面临多重挑战。由于ADCs的生产大多涉及高活性细胞毒性药物,因此需要高度的硬件设备、流程设计和人员培训,并需要大量的资本投入和技术储备,因此生产门槛较高。
目前,抗体药物偶联物的发展面临三个主要挑战和机遇:
6.1 连接剂的不稳定性
这种不稳定性可能导致药物提前释放到血液中,导致ADCs的非特异性摄取和错靶毒性。
6.2 非特异性内吞作用
亲水性将促进ADCs的聚集和非特异性内吞作用,尤其是DAR(药物-抗体比)较高的ADCs,导致错靶效应。DAR较高的ADCs还会被其他具有非特异性和强大内吞作用能力的细胞清除。因此,优化DAR也是改善治疗指数(TI)的重要策略。
6.3 受体介导的摄取机制
由Fcγ受体介导的ADC的错靶毒性主要表现为血液毒性。血液毒性是含有Auristatin(MAME、MMAF)、Calicheamicin和Maytansinoid(DM-1)的ADCs最常见的非特异性错靶剂量限制毒性(DLTs)。
7. 获得FDA批准的抗体药物偶联物
在获得批准上市的十种ADCs中,有六种用于治疗血液肿瘤,其他的用于固体肿瘤(表1)。目前,有超过80种ADCs正在进行积极的临床试验,其中大部分处于I期和I/II期。超过80%的临床试验研究ADCs在各种固体肿瘤中的安全性和有效性,而其余涉及血液恶性肿瘤。这表明,在早期T-DM1的成功和最近对sacituzumab govitecan和Loncastuximab tesirine的批准后,近年来ADCs的研究逐渐转向固体肿瘤。
表1.FDA批准的ADC
| 药物名称 | 商品名 | 公司 | 靶点 | 有效负载 | 适应症 | 审批年度 |
|---|---|---|---|---|---|---|
| 琼妥珠单抗奥唑加霉素 | Mylotarg | 辉瑞/惠氏 | CD33 | Calicheamicin | AML | 2000 2017 |
| 布伦妥昔单抗 | Adcetris | 西雅图遗传学公司, 武田肿瘤 | CD30 | MMAE | cHL、sALCL、PTCL | 2011 |
| 曲妥珠单抗 | Kadcyla | 基因泰克/罗氏 | HER2 | DM1 | mBC | 2013 |
| 伊诺妥珠单抗奥唑加霉素 | Besponsa | 辉瑞/惠氏 | CD22 | Calicheamicin | ALL | 2017 |
| 泊洛妥珠单抗 | Polivy | 基因泰克/罗氏 | CD79b | MMAE | r/r DLBCL | 2019 |
| 恩诺单抗 | Padcev | 安斯泰来/西雅图遗传学公司 | Nectin-4 | MMAE | mUC | 2019 |
| 曲妥珠单抗 | Enhertu | 阿斯利康/ 第一三共株式会社 | HER2 | Dxd | mBC、mGC | 2019 |
| 戈沙妥珠单抗 | Trodelvy | Immunomedics | TROP2 | SN-38 | mTNBC | 2020 |
| 马贝兰他单抗 | Blenrep | 葛兰素史克 | BCMA | MMAF | MM | 2020 |
| 朗妥昔单抗 | Zynlonta | ADC疗法 | CD19 | SG3199 | r/r DLBCL | 2021 |
自从“生物导弹”的概念提出以来,ADCs一直在不断创新和优化,并得到了极大的改进,使其成为癌症治疗领域的重要手段之一。随着越来越多的ADCs进入临床阶段,该行业正逐渐从传统技术转向更具创新性的技术来开发这种复杂产品,其中包括探索新的肿瘤抗原、新的抗体结构、新的药物负荷、新的连接剂和先进的偶联方法。随着对ADCs的深入研究,ADCs的分子结构设计将更加合理,均一性将大大提高,体内稳定性将不断改善,从而减少毒性和副作用,提高疗效和活性,扩大治疗窗口,为肿瘤患者带来新的希望。
8. j9九游会登录入口首页生物ADC靶点蛋白
目前,ADC在研靶点有128个,其中有2条及以上在研管线的59个。j9九游会登录入口首页生物已经针对各种热门靶点开发了一系列具有不同物种和标签的产品,适用于免疫、抗体筛选、SPR、细胞活性检测等实验。j9九游会登录入口首页生物致力于协助您的药物研发工作,并且所有活性测试方案都可以免费获取。此外,j9九游会登录入口首页生物还提供相关的研究用抗体和ELISA试剂盒。如果您没有找到所需的靶点,您可以通过留言或在线聊天与我们联系。
- AXL
- CD19
- CD22
- CD274
- CD276
- CD33
- CD37
- CD38
- CD47
- CD70
- CD74
- CD79B
- CD99
- CEACAM5
- CLDN6
- CLEC12A
- CLDN18
- DLK1
- DLL3
- EGFR
- ERBB2
- ERBB3
- FAP
- FLT1
- FOLH1
- FOLR1
- FUT3
- GPRC5D
- GUCY2C
- IL3RA
- KIT
- MET
- MRC2
- MS4A1
- MSLN
- MUC1
- NCAM1
- NECTIN4
- POLL
- PTK7
- PTPRC
- ROR1
- ROR2
- SLC39A6
- STING1
- TACSTD2
- TLR7
- TLR8
- TLR9
- TNFRSF10B
- TNFRSF17
- TNFRSF8
- TPBG
- VTCN1
● 部分ADC靶点蛋白活性验证数据
CSB-MP023072HU1
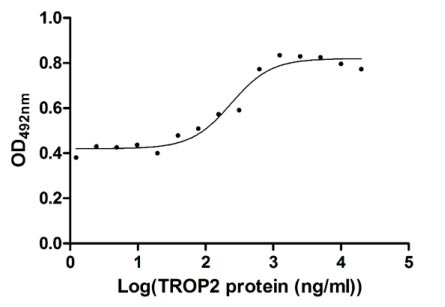
Measured in cell activity assay using U937 cells, the EC50 for this effect is 190.2-298.6 ng/ml.
CSB-MP007479HU
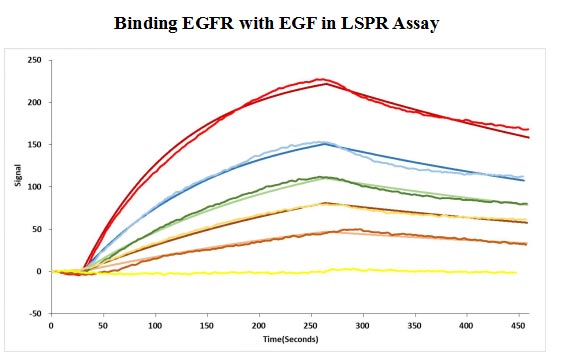
Human EGF protein captured on COOH chip can bind Human EGFR protein, his and Myc tag (CSB-MP007479HU) with an affinity constant of 11.9nM as detected by LSPR Assay.
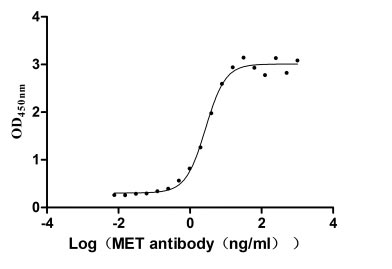
Measured by its binding ability in a functional ELISA. Immobilized MET at 2 μg/ml can bind Anti-MET recombinant antibody, the EC50 is 2.379-3.094 ng/ml.
CSB-MP024093HUb0
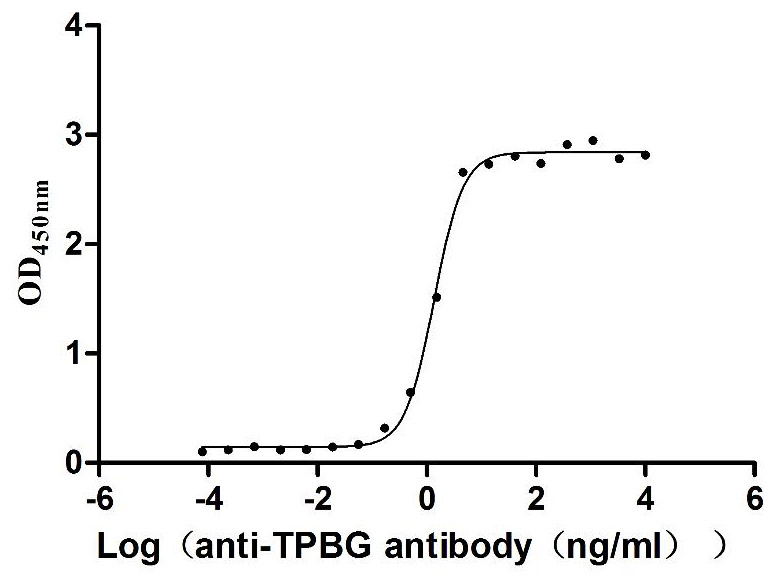
Measured by its binding ability in a functional ELISA. Immobilized Human TPBG at 2 μg/mL can bind Anti-TPBG recombinant antibody (CSB-RA024093MA1HU), the EC50 is 1.230-1.519 ng/mL.
CSB-MP822274HU
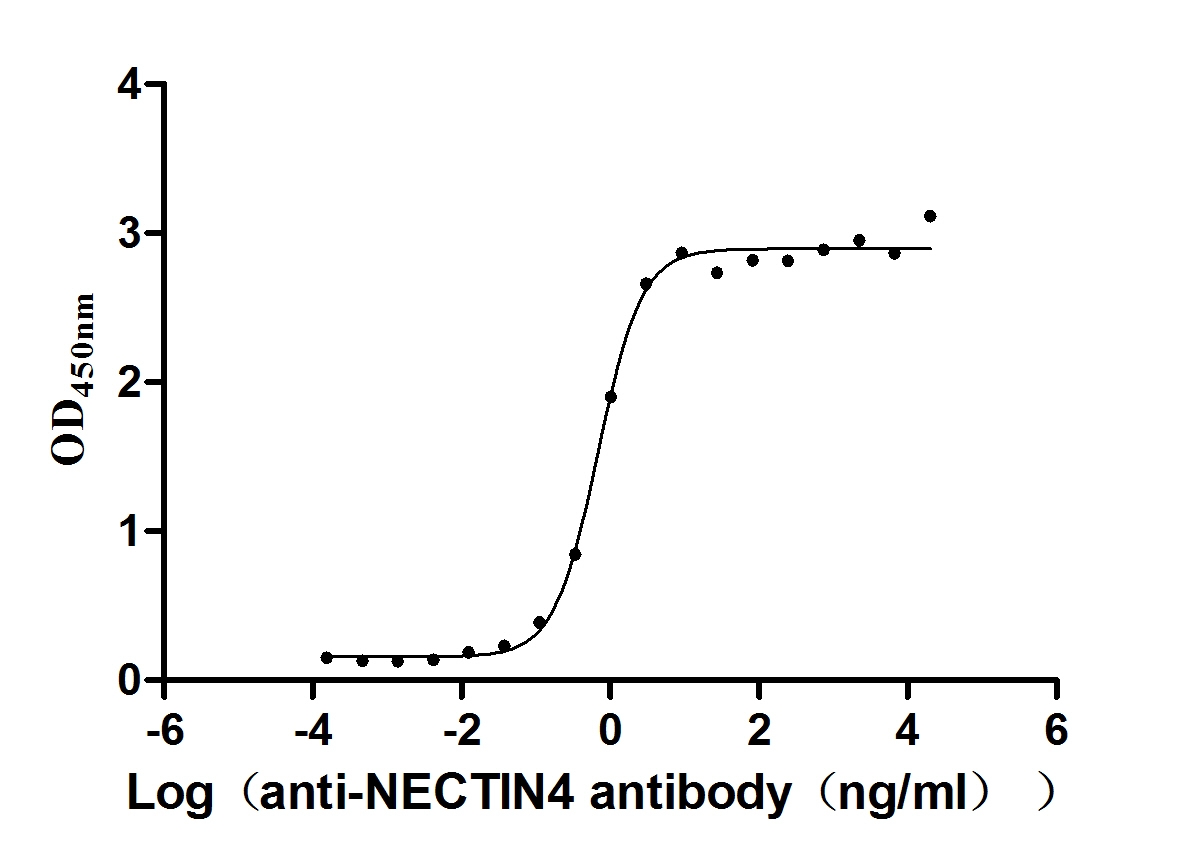
Measured by its binding ability in a functional ELISA. Immobilized NECTIN4 at 2 μg/ml can bind anti-NECTIN4 antibody (CSB-RA822274A0HU) (enfortumab vedotin-like), the EC50 is 0.6029-0.7837 ng/mL.
CSB-MP733578HU
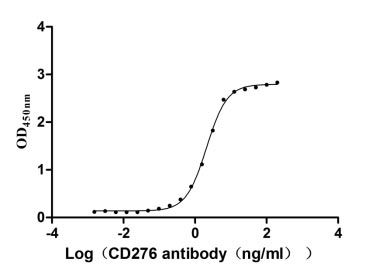
Measured by its binding ability in a functional ELISA. Immobilized CD276 at 2 μg/ml can bind Anti-CD276 rabbit monoclonal antibody, the EC50 of human CD276 protein is 1.961-2.243 ng/ml.
CSB-MP015044HUc9
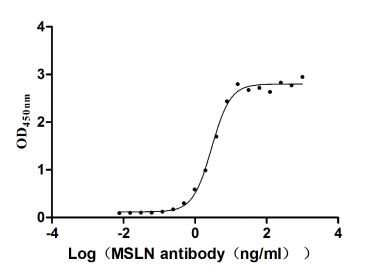
Measured by its binding ability in a functional ELISA. Immobilized MSLN at 2 μg/ml can bind Anti-MSLN rabbit monoclonal antibody, the EC50 of the MSLN protein is 2.657-3.177 ng/ml.
CSB-MP004954HU1
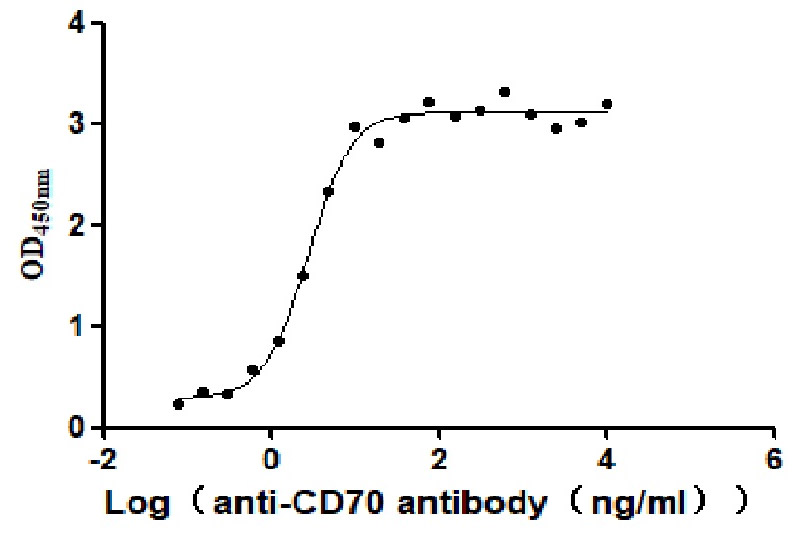
Measured by its binding ability in a functional ELISA. Immobilized Human CD70 at 2 μg/ml can bind Anti-CD70 antibody, the EC50 is 2.414-3.196 ng/mL.
● j9九游会登录入口首页生物ADC靶点蛋白产品列表
参考文献:
[1] Abuhelwa Z, Alloghbi A, Nagasaka M. A comprehensive review on antibody-drug conjugates (ADCs) in the treatment landscape of non-small cell lung cancer (NSCLC)[J]. Cancer treatment reviews, 2022, 106.











