膀胱癌
膀胱癌是一种在膀胱细胞中发生的,在泌尿系统中发病率较高的恶性肿瘤。膀胱是位于下腹部的空心肌性器官,用于储存尿液。根据膀胱癌起源的细胞类型,膀胱癌可以分为三类:尿路上皮癌、鳞状细胞癌和腺癌。尿路上皮细胞是膀胱内壁的细胞,膀胱癌大多起源于这些细胞。
膀胱癌是研究免疫逃避和改善免疫反应机制的理想疾病状态,因为它具有几个已建立的特征 [1]。癌症进展的一个标志是形成免疫抑制和耐受性的肿瘤微环境(图1)[2]。
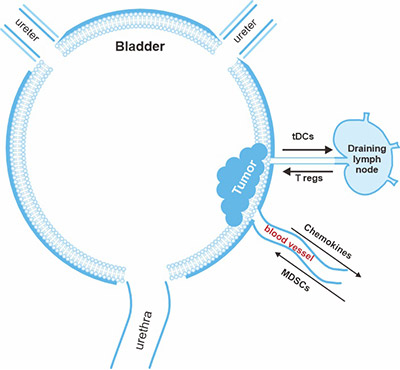
图1. 膀胱肿瘤诱导的免疫抑制促进恶性膀胱上皮细胞从免疫系统逃逸
*此图表来自《癌症免疫学》[2] 杂志
此外,基因改变在膀胱癌的进展中也起着重要作用。Lucie C Kompier等人的研究发现,原发肿瘤中64%的肿瘤为FGFR3突变,11%为RAS突变,24%为PIK3CA突变,26%为p53突变 [3]。在本文中,我们根据NCG提供的信息,列出了参与膀胱癌的部分蛋白质。NCG是一个用于分析癌症基因的复制能力、同源性和网络特性的网络资源。
本文就膀胱癌发生机制中的几个关键靶点进行综述,包括:
● STAG2(基质抗原2),是辊环蛋白复合物的四个组成部分之一,介导DNA复制后姐妹染色单体之间的结合,确保染色体的正确分离 [4]。STAG2是最常见的辊环蛋白亚单位突变,最近被发现是膀胱癌中常见的改变基因 [5]。Alana Lelo等人发现,在非肌层侵袭性膀胱癌(NMIBC)中,STAG2突变更为普遍存在(约32%),而在进展为肌层侵袭的肿瘤中突变率较低 [6] [7]。
● EP300(E1A结合蛋白P300),也称为P300,作为组蛋白乙酰转移酶,通过减少组蛋白与DNA的紧密结合,调节基因的转录,并通过染色质重塑来发挥作用。该蛋白在调控细胞生长和分裂、促使细胞成熟并承担专门功能方面起着重要作用。EP300在膀胱癌中经常发生突变,其突变与增加的肿瘤突变负荷(TMB)和促进抗肿瘤免疫有关,这可能作为预测免疫反应的生物标志物 [8]。
● FGFR3(成纤维细胞生长因子受体3),也称为CD333,在细胞增殖、分化和凋亡调节中发挥着重要作用。FGFR3信号通路的变化在膀胱癌中的发生频率比其他任何癌症类型都要高。受体的异常活化可以通过多种机制发生。这些机制与肿瘤的分期和分级有关,并对下游信号转导和表型产生不同的影响 [9]。
● KDM6A(特异性去甲基化酶6A)广泛存在于人体的多个器官和组织中,并在催化去甲基化三/二甲基化组蛋白H3的过程中发挥作用。在膀胱癌中,KDM6A是经常发生突变的组蛋白修饰酶。Kohei Kobatake等人的研究表明,Kdm6a缺乏会激活细胞因子和趋化因子途径,促进M2型巨噬细胞极化,增加癌症干细胞,并与p53单倍不全协同导致膀胱癌 [10]。
● ARID1A(AT丰富互作结构域蛋白1A)是一个称为SWI/SNF的蛋白复合体的一部分,它通过染色质重塑的过程调控基因活性(表达)。SWI/SNF复合体在人类癌症中的突变率约为20%。Stefan Garczyk等人报告称,在膀胱癌中,ARID1A截短突变是SWI/SNF遗传变异中最常见的一种,可能导致高级别膀胱癌中ARID1A蛋白的缺失 [11]。
参考文献:
[1] Alegrezza MJ, Conejo-Garcia JR. Targeted therapy and immunosuppression in the tumor microenvironment [J]. Trends Cancer. 2017, 3(1):19–27.
[2] Paul L. Crispen & Sergei Kusmartsev. Mechanisms of immune evasion in bladder cancer [J]. Cancer Immunology. 2020, 3–14.
[3] Lucie C Kompier, Irene Lurkin, Madelon N M van der Aa et al. FGFR3, HRAS, KRAS, NRAS and PIK3CA mutations in bladder cancer and their potential as biomarkers for surveillance and therapy [J]. PLoS One. 2010, 5(11):e13821.
[4] Claire F. Taylor, Fiona M. Platt and Carolyn D. Hurst. Frequent inactivating mutations of STAG2 in bladder cancer are associated with low tumour grade and stage and inversely related to chromosomal copy number changes [J]. Hum Mol Genet. 2014, 23(8): 1964–1974.
[5] Lanni Aquila, Joyce Ohm and Anna Woloszynska. The role of STAG2 in bladder cancer [J]. Pharmacological Research. 2019, 142:143-149.
[6] Solomon DA, Kim JS, Bondaruk J et al. Frequent truncating mutations of STAG2 in bladder cancer [J]. Nat Genet. 2013, 45:1428–30.
[7] Alana Lelo, Frederik Prip, Brent T. Harris et al. STAG2 Is a Biomarker for Prediction of Recurrence and Progression in Papillary Non–Muscle-Invasive Bladder Cancer [J]. Clin Cancer Res. 2018, (24) (17):4145-4153.
[8] Gongmin Zhu, Lijiao Pei, Yuan Li et al. EP300 mutation is associated with tumor mutation burden and promotes antitumor immunity in bladder cancer patients [J]. Aging (Albany NY). 2020, 12(3):2132-2141.
[9] Knowles and Margaret A. FGFR3 – a Central Player in Bladder Cancer Pathogenesis [J]? Bladder Cancer. 2020, 6(4):403-423.
[10] Kohei Kobatake, Ken-ichiro Ikeda, Yuichiro Nakata et al. Kdm6a Deficiency Activates Inflammatory Pathways, Promotes M2 Macrophage Polarization, and Causes Bladder Cancer in Cooperation with p53 Dysfunction [J]. Clin Cancer Res. 2020, 26:2065–79.
[11] Garczyk S, Schneider U, Lurje I et al. ARID1A-deficiency in urothelial bladder cancer: No predictive biomarker for EZH2-inhibitor treatment response [J]? 2018, PLoS ONE. 13(8): e0202965.






