肝细胞癌
肝细胞癌是世界上第五常见的癌症,也是最常见的原发性肝癌类型。长期患有肝病的人群患肝细胞癌的风险较高。目前,乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)仍然是全球最重要的HCC风险因素,但在未来几年内它们的重要性可能会下降 [1]。肝细胞癌的发病率正在上升,这主要归因于丙型肝炎感染的增加。
慢性肝病患者存在持续的肝脏炎症、纤维化和异常肝细胞再生。这些异常可以导致肝硬化,并促进一系列基因和表观遗传事件的发生,最终导致非典型结节的形成 [2]。肝细胞癌细胞积累体细胞DNA变异,包括突变和染色体异常。人类肝癌发生过程中的关键分子和组织学改变如图1所示。星号(*)表示高水平的DNA扩增。在非增殖类别中,CTNNB1突变的肿瘤富集了免疫排除。AFP代表α-胎蛋白,HBV代表乙型肝炎病毒,HCV代表丙型肝炎病毒。
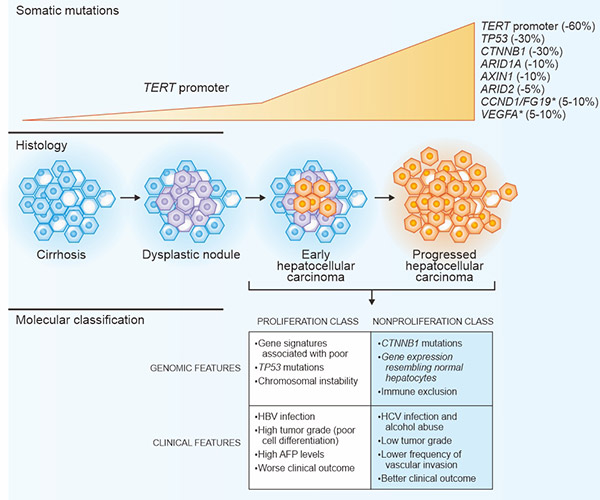
图1. 肝细胞癌的主要遗传学改变和分子分型
*此图表来自N Engl J Med [2] 的出版物
如图1所示,TERT启动子的突变是最常见的遗传改变,约占[3]病例的60%。它们可在不典型增生结节中检出,且TERT启动子是反复出现的。本文根据NCG(分析癌基因的可重复性、同源性和网络特性)提供的信息,列出了与肝细胞癌相关的部分蛋白。
在此,我们展示了参与肝细胞癌发生机制的几个关键靶点,包括:
● TP53(肿瘤蛋白P53)被描述为"基因组的守护者",因为它在保持稳定性方面起着重要作用,可以防止基因组突变。p53基因的突变会使其正常功能丧失,导致基因组不稳定和失控生长。许多研究表明,在肝细胞癌中p53经常发生突变 [4-6]。
● ARID2(AT-rich interactive domain 2)是SWI/SNF复合物的组成部分,它在染色质重塑复合物中发挥作用,促进基因转录 [7]。肝细胞癌是经常发生ARID2突变的癌症类型。对139例肝细胞癌的外显子测序发现了先前描述的基因如CTNNB1或TP53中的预期突变,并且还意外发现了ARID2的缺失突变。ARID2的突变包括诱导移码插入或缺失、无义突变和剪切位点突变,没有主要的热点突变区域 [8]。
● ARID1A(AT-rich interactive domain-containing protein 1A)是SWI/SNF染色质重塑复合物的一个组成部分,最近被认为是一个肿瘤抑制基因,在肝细胞癌中经常发生突变 [9]。胡超波等人已经证明,ARID1A缺失会激活Ang2依赖性血管生成,促进肝细胞癌的进展。在肝细胞癌中丧失ARID1A会增加对Ang2阻断和索拉非尼治疗的敏感性 [10]。
● CTNNB1(β-连环蛋白)是一种具有双重功能的蛋白,参与细胞间粘附和基因转录的调节和协调。新的证据表明,在肝细胞癌(HCC)中CTNNB1基因的突变与免疫排斥有关,携带CTNNB1突变的HCC患者倾向于对抗PD1疗法表现出主要的耐药性 [11]。
● AXIN1(轴抑制蛋白1)是β-连环蛋白破坏复合物的一个组成部分,通过磷酸化和泛素化调节CTNNB1的水平,调控Wnt信号通路 [12]。AXIN1是Wnt/β-连环蛋白通路的成员,在肝细胞癌(HCC)中最常见的通路异常。AXIN1的突变占HCC突变的约10% [13]。
参考文献:
[1] Katherine A McGlynn, Jessica L Petrick, Hashem B El-Serag et al. Epidemiology of Hepatocellular Carcinoma [J]. Hepatology. 2020. 10.1002.
[2] Augusto Villanueva. Hepatocellular Carcinoma [J]. N Engl J Med. 2019, 380:1450-62.
[3] Schulze K, Nault J-C, Villanueva A. Genetic profiling of hepatocellular carcinoma using next-generation sequencing [J]. J Hepatol. 2016, 65:1031-42.
[4] Jeng KS, Sheen IS, Chen BF, et al. Is the p53 gene mutation of prognostic value in hepatocellular carcinoma after resection [J]? Arch Surg. 2000, 135:1329-1333.
[5] Katiyar S, Dash BC, Thakur V et al. p53 tumor suppressor gene mutations in hepatocellular carcinoma patients in India[J]. Cancer. 2000, 88:1565-1573.
[6] George G. Chen, Juanita L. Merchant, Paul B. S. Lai, et al. Mutation of p53 in Recurrent Hepatocellular Carcinoma and Its Association with the Expression of ZBP-89 [J]. Am J Pathol. 2003. 162(6): 1823–1829.
[7] Atsushi Oba, Shu Shimada, Yoshimitsu Akiyama et al. ARID2 modulates DNA damage response in human hepatocellular carcinoma cells [J]. J Hepatol. 2017, 66(5):942-951.
[8] Robin Loesch, Linda Chenane and Sabine Colnot. Settings ARID2 Chromatin Remodeler in Hepatocellular Carcinoma [J]. Cells. 2020, 9(10), 2152.
[9] Sheng Cheng, Lan Wang, Chuan-Huai Deng et al. ARID1A represses hepatocellular carcinoma cell proliferation and migration through lncRNA MVIH [J]. Biochemical and Biophysical Research Communications. 2017, 1(491):178-182.
[10] Chaobo Hu, Weiping Li, Feng Tian et al. Arid1a regulates response to anti-angiogenic therapy in advanced hepatocellular carcinoma [J]. J Hepatol. 2018, 68(3):465-475.
[11] Xuelian Xiao, Huanye Mo, Kangsheng Tu. CTNNB1 mutation suppresses infiltration of immune cells in hepatocellular carcinoma through miRNA-mediated regulation of chemokine expression [J]. International Immunopharmacology. 2020, 89: 107043.
[12] Shuichi Kusano, Nancy Raab-Traub. I-mfa domain proteins interact with Axin and affect its regulation of the Wnt and c-Jun N-terminal kinase signaling pathways [J]. Mol Cell Biol. 2002, 22(18):6393-405.
[13] Shirley Abitbol, Rajae Dahmani, Cédric Coulouarn et al. AXIN deficiency in human and mouse hepatocytes induces hepatocellular carcinoma in the absence of β-catenin activation [J]. J Hepatol. 2018, 68(6):1203-1213.






