二维细胞培养动物模型
关于体外细胞培养最早可以追溯到1885年,W.ROUX将鸡的胚胎在恒温NaCl溶液中成功培养了数天[1]。1907年,Harrion建立了第一个蛙神经纤维原代细胞培养物 [2]。1912年,Carrelenew研发出无菌培养组织技术。随后Rous 和 Jones 在 1916 年使用胰蛋白酶从外植体周围的生长物中获得细胞悬浮液,然后将其接种到新的培养容器中。 W. EARLE 于 1943 年建立了第一个小鼠纤维原细胞谱系,1951 年GEY 培育出第一个人类细胞系。 1955 年,EAGLE 建立了确定的细胞培养基。 1998 年,THOMSON 成功分离出人类胚胎干细胞 [2,3]。细胞培养弥补了体内实验的不足,使细胞功能和过程的研究更具可操作性。
1、原代细胞
1.1 什么是原代细胞?
原代细胞是指直接从有机生命体活检样本或者血液中通过酶解或物理方法获得单细胞并进行体外培养,一般将培养到第1代至第10代的原代细胞统称为原代细胞培养。在人工创造的环境下原代细胞可以存活、生长、繁殖和传代,并用于细胞生命过程、细胞癌变、细胞工程等问题的研究。
1.2 原代细胞优缺点
原代细胞经历最小的群体倍增,因此保留其原始组织的表型和基因型特征,包括生长和衰老。它们最接近也最能反映体内生长特性,适合于药物敏感性试验和细胞分化等实验研究。
然而,从组织中分离原代细胞既费时又费力,而且每种细胞类型对营养和生长因子需求都不同。此外,原代细胞自我更新和分化的潜力有限,它们的形态和功能可能在培养过程中随着时间的变化代谢缓慢,因此建议使用处于细胞分裂早期的原代细胞。
1.3 初代培养
原代细胞培养又称原代培养,是对供体组织细胞进行体外培养的第一步,也是建立细胞系的基本技术首步。
● 组织块培养法
组织块培养是一种常用的、简单的、成功的原代培养方法。基本方法是将消化酶切下的小组织块接种于培养瓶中,培养瓶壁可预先涂上一层薄薄的胶原蛋白,促进组织块与瓶壁粘附,进一步促进周围细胞沿瓶壁向外生长。
● 悬浮细胞培养法
悬浮生长的细胞,如白血病细胞、淋巴细胞、骨髓细胞、癌细胞、胸膜和腹水中的免疫细胞,不需要消化。可直接采用低速离心培养,也可在淋巴细胞分离后接种培养。
● 器官培养
从供体获得的器官或组织块直接在特定的环境条件下体外培养,不需要组织隔离。这种培养方法称为器官培养。器官培养可以保持器官组织的相对完整性,可用于重点观察器官组织的细微连接、排列和相互作用,以及对局部环境的生物调节。
2、细胞系
2.1 什么是细胞系?
细胞系是指原代细胞首次培养成功并可以长时间传代繁殖的细胞群。在其生存过程中,具有最高生长能力的细胞将占主导地位,从而产生可以达到某种基因型和表型的细胞群。
细胞系可分为有限细胞系和无限细胞系。有限细胞系的寿命有限,在衰老前可以传代 20-80 次。无限细胞系具有无限繁殖的能力,即永生化。 来源于宫颈癌细胞的HeLa细胞系是最著名的永生细胞系,也是医学研究的重要工具。
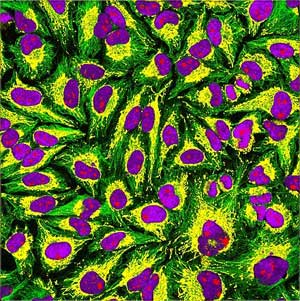
图1. HeLa细胞(免疫荧光显示绿色为微管,黄色为线粒体,红色为核仁,紫色为DNA核)
图片引自维基百科
细胞系已成为广泛应用的有价值的工具,包括药物代谢和细胞毒性测试、基因功能研究、疫苗生产、抗体、人造组织的产生和生物化合物的合成[4-6]。
2.2 优缺点
细胞系是在原代细胞培养的基础上,通过传代和选择获得。常用的细胞系是通过筛选获得的稳定的细胞群,其特性可以保证在进行连续实验时得到更稳定的结果。
它们供应充足且相当容易培养,通常具有克隆性和高度同质性,解决了原代细胞培养中寿命短和扩增受限的问题。研究中常使用永生细胞系替代原代细胞,它们具有成本效益且易于使用,可提供无限量的材料供应,并避免了与使用动物和人体组织相关的伦理问题。
然而,细胞系的缺点也是非常明显的,细胞系容易发生自发突变与诱导突变。多次传代后,细胞系可能会发生一些基因型甚至表型的变化。一旦细胞系发生突变,与原始供体细胞相比,它们将变得完全无法识别。另一个问题是细胞污染。全世界使用的细胞系中约有 15-20% 被错误识别或被其他细胞类型污染。
2.3 细胞谱系的错误识别及污染
实际上,一些细胞系与原代细胞仅表现出较小相似性是由于基因型和表型经过连续传代和增殖发生变异。细胞系是由基因操纵的,但是外部因素的刺激可能会导致其表型、原生功能等此产生响应性改变。与原代细胞相比,永生细胞系存在重要的表型差异,并且可能因修饰和传代而失去生理特性。尽管如此,作为一种简单有效的工具,细胞系仍然是学术界和制药业的主要研究手段。不得不说,永生癌细胞系是研究癌症生物学和测试抗癌疗法的宝贵模型。
3、干细胞
近年来在生物制药领域,学者们的研究思路逐渐从基于原代细胞和细胞系系统转向更加稳健、现实和个性化的干细胞系统。
干细胞是指未分化的但可以在身体需要时变成特定的细胞。与原代细胞和细胞系相比,它们具有无限的增殖能力和可塑性,可以产生各种细胞类型和自我更新的能力,在发育生物学、疾病建模和细胞治疗方面显示出巨大的潜力。
根据干细胞的发育潜能,可以将其分为三种类型:全能干细胞、多能干细胞和单能干细胞。按照发育阶段,干细胞可分为两类:胚胎干细胞,成体干细胞。
常见的干细胞类型主要有以下几种
3.1 胚胎干细胞
胚胎干细胞(ESCs)是指通过体外抑制培养从胚胎内细胞团或原始生殖细胞中选出的细胞。 1998 年,研究人员在囊胚阶段从内细胞团中分离出第一个人类胚胎干细胞系。 2007 年,成人细胞被重新编程为多能干细胞,称为人类诱导的多能干细胞 (iPSC)。
在未分化状态下,多能干细胞也是发育毒理学的重要体外模型。众所周知,胚胎发育是一个特别易受药物和有毒化合物侵害的时期,动物模型很难概括药物对人类发育早期事件的影响,而多能干细胞由于其特性,为研究胚胎发生过程中的药物毒性提供了一个独特且可行的平台。
此外,多能干细胞分化成所有细胞类型的能力对于研究稀有或难以分离的细胞类型(如神经元或心肌细胞)非常有价值。相关研究表明,多能干细胞在疾病建模、药物筛选和毒性测试方面有很大帮助。最后,人类诱导的多能干细胞还可以创建疾病个性化的细胞模型,以帮助研究糖尿病、囊性纤维化、帕金森病和精神分裂症等疾病。例如,来自家族性自主神经功能障碍患者的 iPSC 的神经嵴前体细胞,这是一种影响神经嵴细胞谱系生成的罕见、致命的遗传疾病,前体细胞用于筛选新药,帮助设计更安全、更有效治疗。
胚胎干细胞的相关靶点:
- CD15
- CD24
- CD29
- CD31
- CD59
- CD9
- c-kit
- c-Myc
- Cripto
- E-Cadherin
- Frizzled 5
- Integrin alpha 6
- KIF4A
- Lin28A
- LIN28B
- Nanog
- SOX2
- SSEA-3
- SSEA-4
- v-Myc
3.2 成体干细胞
成体干细胞是存在于分化组织中的未分化细胞,能够自我更新并专门形成构成该类型组织的细胞。骨髓间充质干细胞 (BM-MSCs) 和造血干细胞 (HSCs) 是从成人组织中分离出来的具有自我更新能力的成人干细胞。这些多能成体干细胞被广泛用作预测药物毒性的体外细胞模型。
3.3 多能干细胞(hPCGs)
人类胚胎干细胞和诱导多能干细胞统称为多能干细胞,具有自我更新能力并且可以分化为三个胚层(内胚层、中胚层和外胚层)细胞类型。这些特性使它们成为评估药物和有毒化合物的有力工具。多能干细胞具有无限的增殖和发育潜力,在三个胚层中均产生类器官。多能干细胞衍生的类器官可以进行大规模研究,例如代谢分析和药物筛选。 人体胚胎干细胞(hESCs)来自囊胚,是受精后 5-6 天发育中的胚胎。至于 诱导多能干细胞(hiPSC),它们来源于多能因子异位表达的重编程体细胞,例如: OSKM (OCT4/SOX2/KLF4/C-MYC)。
多能干细胞的相关靶点:
参考文献:
[1] Hudu S. A., Alshrari A. S., et al. (2016). Cell culture, technology: Enhancing the culture of diagnosing human diseases [J]. J. Clin. Diagnost. Res. 10 DE01–DE05.
[2] Jedrzejczak-Silicka M. (2017). “History of Cell Culture,” in New Insights into Cell Culture Technology [J]. eds Joghi S., Gowder T. (London: IntechOpen; ).
[3] Ledur P. F., Onzi G. R., et al. (2017). Culture conditions defining glioblastoma cells behavior: what is the impact for novel discoveries [J]? Oncotarget 8 69185–69197.
[4] Go´mez-Lecho´n MJ, Donato MT, et al. Human hepatocytes as a tool for studying toxicity and drug metabolism [J]. Curr Drug Metab. 2003;4:292–312.
[5] MacDonald C. Development of new cell lines for animal cell biotechnology [J]. Crit Rev Biotechnol. 1990;10:155–78.
[6] Schurr MJ, Foster KN, et al. Phase I/II clinical evaluation of StrataGraft: a consistent, pathogen-free human skin substitute [J]. J Trauma. 2009;66:866–73, discussion 873-4.






