肠类器官
2007年Clevers研究组在小鼠模型中证明Lgr5+上皮细胞是真正的肠上皮干细胞后[1],肠干细胞领域的研究在接下来的几年中取得了很大的进展。该领域最具影响力的突破之一是建立了肠道干细胞体外3D培养系统。 Clevers 和他的同事于 2009 年在 Matrigel 中进行了 3D 培养,从成人肠道干细胞中生成了肠道类器官 [2]。这是对肠道类器官培养首次使用小鼠小肠段进行描述。
3D 肠道类器官由一个封闭的循环空腔组成,空腔内衬一层肠上皮细胞系。肠上皮的分化细胞谱系,包括肠上皮细胞、肠内分泌细胞和杯状 (Paneth) 细胞,排列在绒毛区。肠道类器官可以来源于器官限制性成体干细胞 (ASCs) 和多能干细胞 (PSCs)。这两种干细胞产生的类器官包含体内发现的所有肠上皮细胞类型,比例和排列相似。它们可以更大程度地模拟肠道组织,因此被称为“迷你肠道”。大肠肿瘤细胞也可以用这个 3D 系统培养,以获得肿瘤样器官。总的来说,肠道类器官是研究肠道营养运输、药物吸收、胃肠癌和肠道胰高血糖素激素分泌的宝贵模型。
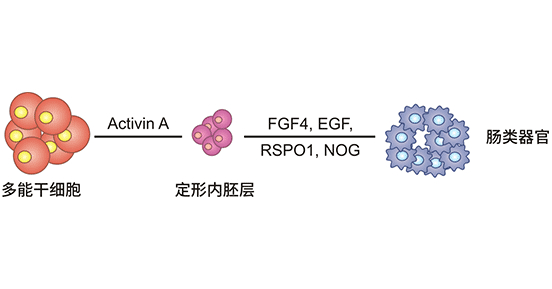
图1. 肠类器官建立过程
肠道类器官现在被广泛用于人类疾病研究。与以往的肠道疾病模型包括细胞系培养或体内动物实验相比,类器官培养具有培养成功率高、培养周期短、组织差异小、易于建立低恶性肿瘤模型等明显优势。与传统的实验模型(二维细胞系培养和动物模型)相比,肠道类器官具有诸多优势。体外构建的肠类器官模型包含所有类型的肠上皮细胞,具有单细胞系无法比拟的水、铁吸收和运输等生理功能。此外,动物模型与人体模型存在较大的物种差异,无法完全模拟人体肠道的真实生理反应,而来源于人体组织的肠道类器官可以更准确地反映人体的生理和病理变化。
1、肠道类器官的最新研究
Yui等人在2012年报道小鼠实验证实体外培养的肠类器官可以通过肛门灌肠修复DSS(Dextransulfatesodium)诱导的结肠炎,并且这些培养出来的肠道类器官可以准确到达受伤的上皮部位,修复受损的肠上皮组织[3] 。
Laween Meran等人使用完整的纳米结构脱细胞人肠基质作为生物支架[4]。蛋白质组学和拉曼光谱分析揭示了人类小肠和结肠支架的高度相似的生化特征,表明它们可以互换用作肠道工程的平台。然后,研究人员将体外扩张的空肠类器官植入任何类型的支架上,以有效重建具有消化和吸收等生理功能的中空移植物。移植物被移植到小鼠肾囊或皮下,可以存活并形成管腔结构。该研究为在肠衰竭儿童患者使用特异性空肠移植疗法提供了概念验证数据,并推进了治疗肠衰竭儿童的临床试验过程。
2020年7月3日,类器官研究先驱 Hans Clevers 及其团队在《Science》杂志上发表了题为《SARS-CoV-2 productively infects human gut enterocytes》的文章,发现在小肠类器官中,SARS-CoV-2 很容易感染肠道细胞。上皮细胞,受感染肠上皮细胞的病毒应答基因显著上调[5]。这项研究提供了肠道上皮细胞支持 SARS-CoV-2 复制的证据,表明人类肠道类器官可以作为病毒感染和生物学研究的实验模型。
Ana C Silva 等人使用多种 iPSC 衍生的类器官,概括了体内心脏和肠道的协调发育和成熟,证明类器官中内胚层组织(肠道/肠)的存在有助于心脏组织的发育和成熟 [6]。这项研究表明,来自许多种系的合作组织可以在单个类器官模型中产生和成熟,这一突破将有助于研究发育、生理成熟和疾病过程中的多组织相互作用。
Satoshi Watanabe等人使用柔性导管将大约 1,000 个类器官注入结肠,其中上皮损伤最严重 [7]。培养的类器官的上皮细胞附着在受损表面并与宿主的上皮组织(结肠内的细胞层)结合,最终形成完整的上皮组织,其中部分受损上皮层已被类器官上皮细胞取代,这项研究为使用结肠类器官移植治疗严重溃疡性结肠炎的人体临床试验奠定了基础。今天,本研究中开发的方案已转化为临床实践,科学界和临床界都对未来的临床应用感到兴奋。
2、结肠类器官培养细胞因子
- EGF
- Noggin
- R-spondin 1
- Wnt-3a
3、肠道疾病研究靶点
参考文献:
[1] Barker N, van Es J H, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 2007, 449: 1003–1007.
[2] Sato, T., Vries, R. G., et al. (2009). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche [J]. Nature 459, 262–265.
[3] Yui S, Nakamura T, Sato T, et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5+ stem cell. Nat Med, 2012, 18: 618–623.
[4] Laween Meran, Isobel Massie,et al. Engineering transplantable jejunal mucosal grafts using patient-derived organoids from children with intestinal failure [J]. Nature Medicine volume 26, pages1593–1601 (2020).
[5] Mart M. Lamers, Joep Beumer, et al. SARS-CoV-2 productively infects human gut enterocytes [J]. Science. 2020 May 1 : eabc1669.
[6] Ana C Silva, Oriane B Matthys, et al. Co-emergence of cardiac and gut tissues promotes cardiomyocyte maturation within human iPSC-derived organoids [J]. Cell Stem Cell. 2021 Dec 2;28(12):2137-2152.e6.
[7] Satoshi Watanabe, Sakurako Kobayashi, et al. Transplantation of intestinal organoids into a mouse model of colitis [J]. Nat Protoc. 2022 Mar;17(3):649-671.






