肺类器官
肺部系统由气道和肺泡腔两部分组成,组织和细胞的复杂性确保了肺的免疫防御和气体交换功能。传统的体外细胞实验和动物模型在今天已被广泛用于阐释人肺发育、生理和发病机制,但这些模型都不能准确再现人肺环境与细胞之间的相互作用。研究表明,肺类器官是目前最接近人体肺系统的模型,以肺类器官为代表的体外肺模型也成为研究肺发育、功能和疾病病理学的更容易获得的工具。
1、肺类器官的应用
肺类器官再现了人类气道的特征,例如黏膜分泌、纤毛运动和再生。利用这种生物学相关性,肺类器官可用于研究肺损伤的修复/再生机制以及肺病的表型变化,也可用于毒性评估或药物测试。
肺类器官结构是中空的,内部空腔,因此容易透光,可以用3D 生物分子和共聚焦成像方法定量分析细胞内容物、细胞存活评估和特定标记物的细胞分选。
由肺细胞产生的类器官也可用于研究早期肺癌以及识别和测试潜在的治疗方法。肺癌类器官模型可以在保留亲本肿瘤基因组变化的基础上,模拟肿瘤复杂的细胞结构和生物学行为。因此,肺癌类器官被广泛应用于信号转导、生物标志物研究以及肺癌药物筛选和疗效预测等方面。近年来,肺癌类器官模型已成为肿瘤研究领域重要的临床前模型。
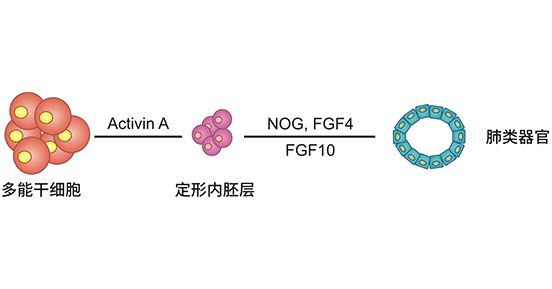
图1. 肺类器官的建立
2、肺类器官研究现状
1993 年,Puchelle 及其同事在胶原蛋白中描述了成人气道上皮的第一个自组织 3D 结构 [1]。 Rossant 及其同事首先描述了从人类 iPSC 中生成肺类器官的过程,其中包括使用 CFTR 突变 iPS 细胞作为模拟囊性纤维化 (CF) 的概念验证 [2]。Dye 等人采用改良后的方法来产生具有基底细胞、纤毛细胞和棒状细胞的成熟肺类器官 [3]。
2017年,Hans 和他的同事使用hiPSCs方法获得肺类器官,这是首批与人类肺组织类似且包含分支气道和肺泡结构的培养物 [4]。研究人员用呼吸道合胞病毒 (RSV) 感染了肺部类器官,导致小气道阻塞和细支气管炎,这与在人体肺部环境观察到的情况一致。谭等人使用成人原代支气管上皮细胞、肺成纤维细胞和肺微血管内皮细胞的 3D 组合成功研发出气道类器官 [5]。
2021年,美国德克萨斯大学泰勒医学中心的Ji Honglong教授在靶向治疗领域的知名期刊《Signal Transduction and Targeted Therapy》上发表了题为《Fibrinolytic niche is required for alveolar type 2 cell-mediated alveologenesis via a uPA-A6-CD44+-ENaC signal cascade》的文章。这项研究是国际上首次发现尿激酶uPA通过A6-CD44+-ENaC信号轴调控肺上皮干细胞再生的新机制[6]。通过肺泡类器官的体外培养,首次证明纤溶系统对ENaC的调节作用,揭示纤溶系统可能作为肺泡干细胞修复再生的新干预靶点。
类器官在 SARS-CoV-2 的研究中也发挥着关键作用,COVID-19 正在全球范围内升级。为了获得与患者感染 SARS-CoV-2 后的情况非常相似的结果,研究人员将肺类器官与其他类器官混合 [7]。肺部类器官的 SARS-CoV-2 感染高度概括了现实世界患者的肺部感染,并显示了不同细胞类型在受感染的肺部发挥的特殊功能。肺和其他类器官,以及多组织器官芯片平台,可用于识别 SARS-CoV-2 感染后器官的病理过程,筛选候选药物以及开发和评估疫苗安全性和有效性 [8-10]。
4、肺类疾病研究靶点
- ACE
- ACE2
- Axin2
- BMP4
- CD24
- CD31
- CD45
- CD49f
- CD104
- CLDN4
- CFTR
- EGF
- EpCAM
- FGF2
- FGF4
- FGF7
- FGF10
- FOXJ1
- GRHL2
- Grhl2
- Gli2
- Gli3
- HPS1
- HER2
- IL-6
- IL-13
- Krt5
- Krt8
- Krt14
- KRAS
- Lgr6
- MUC5B
- Muc5AC
- Noggin
- Notch2
- Ngfr
- PDGFRα
- R-spondin1
- Shh
- Scgb1a1
- Scgb3a2
- Splunc1
- STAT3
- SOX2
- SOX9
- SFTPA
- SFTPB
- SFTPC
- TNFα
- Trp63
- telomerase (TERT)
- ZNF750
参考文献:
[1] Benali R, Tournier JM, et al. (1993) Tubule formation by human surface respiratory epithelial cells cultured in a three-dimensional collagen lattice [J]. Am J Physiol 264: L183–L192.
[2] Wong AP, Bear CE, et al. (2012) Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein [J]. Nat Biotechnol 30: 876–882.
[3] Dye BR, Hill DR, et al. (2015) In vitro generation of human pluripotent stem cell derived lung organoids [J]. Elife 4: e05098.
[4] Chen, YW., Huang, S., de Carvalho, A. et al. A three-dimensional model of human lung development and disease from pluripotent stem cells [J]. Nat Cell Biol 19, 542–549 (2017).
[5] Tan Q, Choi KM, Sicard D, Tschumperlin DJ. (2017) Human airway organoid engineering as a step toward lung regeneration and disease modeling [J]. Biomaterials 113: 118–132.
[6] Gibran Ali, Mo Zhang, et al. Fibrinolytic niche is required for alveolar type 2 cell-mediated alveologenesis via a uPA-A6-CD44+-ENaC signal cascade [J]. Signal Transduction and Targeted Therapy 6, Article number: 97 (2021).
[7] Han Y, Duan X, et al. Identification of SARS-CoV-2 inhibitors using lung and colonic organoids [J]. Nature. 2020;589(7841):270–75.
[8] Zhao B, Ni C, Gao R, et al. Recapitulation of SARS-CoV-2 infection and cholangiocyte damage with human liver ductal organoids [J]. Protein Cell. 2020;11(10):771–5.
[9] Meyer-Berg H, Zhou Yang L, et al. Identification of aav serotypes for lung gene therapy in human embryonic stem cell-derived lung organoids [J]. Stem Cell Res Ther. 2020;11(1):448.
[10] Katsura H, Sontake V, et al. Human lung stem cell-based alveolospheres provide insights into SARS-CoV-2-mediated interferon responses and pneumocyte dysfunction [J]. Cell Stem Cell. 2020;27(6):890–904.






