胃类器官
胃是一个复杂的生理必需器官,在食物的储存和消化中起着重要的作用。小鼠和人类胃之间生理学的巨大差异使利用小鼠胃组织进行的生理学发现和药物筛选的转化这一研究存在阻碍。随着医学和科技的进步,胃类器官出现了。
胃类器官是由胃干细胞或多能干细胞衍生而来的类器官模型,其实质是在体外模拟胃上皮微环境,借此培养胃干细胞或多能干细胞及其衍生的各类胃上皮细胞。分化的胃类器官包括所有类型的终末分化的胃上皮细胞,包括主细胞、壁细胞、表面粘液细胞、宫颈粘液细胞和内分泌细胞[1-3]。胃类器官在细胞成分、组织结构和特定功能方面与胃上皮组织高度相似,能够在体外复制胃上皮组织。胃类器官是很好的基础实验模型,在很多方面优于动物实验模型和常规细胞培养模型。尤其是人源性胃类器官,为体外了解人体胃的真实状况打开了新的“窗口”。
目前,胃类器官已应用于胃形成与生理学、幽门螺杆菌感染相关疾病、致病基因研究、药物筛选与开发、再生医学等领域。胃癌源性类器官模型作为新一代临床前肿瘤模型,在研究胃癌的生物学性和机制以及筛选抗肿瘤药物方面发挥了突出的作用。
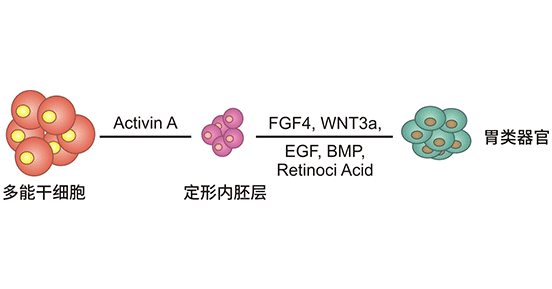
图1. 胃类器官建立过程
1、胃类器官研究进展
2010年,Barker等人在前人对小肠类器官培养体系和消化道干细胞调控信号等一系列研究的基础上利用小鼠LGR5+胃干细胞构建胃类器官[4]。这是关于体外培养胃类器官的首次报道。
McCracken等人于2014年[5]首次描述了基于ipsc的胃类器官构建方法。其实质是在体外模拟胚胎肠的发育过程,通过一系列信号刺激诱导iPSC定向分化为胃组织[6]。
McCracken 等人利用胃类器官进行研究,发现阻断Wnt/β-catenin信号通路可导致胃底上皮细胞型向胃窦上皮细胞型转变,而β-catenin的激活可使构建的胃器官更接近胃底上皮细胞型,表明胃类器官是研究胃上皮细胞分化调控机制的理想模型[7]。对含有间充质细胞的胃类器官的研究使人民人们对上皮-间质相互作用有深入了解,并进一步了解了胃的形成 [8,9]。
Sebrell等人的研究结果表明,胃类器官不是静止的,而是在原地不断滚动。此外,他们观察到类器官长出了类似伪足结构,这可能是类器官旋转的根本原因 [10]。
Morey等发现幽门螺杆菌(Hp)感染通过介导CagA磷酸化来降低胃黏膜上皮细胞胆固醇水平,进而阻断IFNG信号通路,最终促进Hp免疫缺失和胃癌的发生[11]。这些结果有望进一步揭示Hp在感染相关胃病发生发展中的作用。
Seidlitz 等人将p53基因突变引入正常小鼠的胃上皮器官中,成功建立小鼠胃癌模型。结果表明,突变的胃器官表现出肿瘤细胞的特征[12]。Nadauld等人发现TGFBR2突变的类器官组织移植到小鼠体内后可以长成弥漫性肿瘤组织,这表明了TGFBR2基因的突变与胃癌的遗传易感性有关[13]。
2、胃类疾病研究相关靶点
参考文献:
[1] Pompaiah M, Bartfeld S. Gastric Organoids:An emerging model system to study helicobacter pylori pathogenesis [J]. Curr Top Microbiol Immunol, 2017,400:149-168.
[2] Munera JO, Wells JM. Generation of gastrointestinal organoids from human pluripotent stem cells [J]. Methods Mol Biol, 2017,1597: 167-177.
[3] Merker SR, Weitz J. Stange DE. Gastrointestinal organoids: How they gut it out [J]. Dev Biol, 2016,420 (2) : 239-250.
[4] Barker N, Huch M, et al. Lgr5+ve Stem Cells Drive Self-Renewal in the Stomach and Build Long-Lived Gastric Units In Vitro. Cell Stem Cell. 2010;6:25–36.
[5] McCracken KW, Catd EM, Crawford CM, et al. Modelling human development and disease in pluripotent stem-cell-derived gastric organoids [J]. Nature, 2014,516(7531) : 400-404.
[6] Bartfeld S, Clevers H. Organoids as model for infectious diseases: culture of human and murine stomach organoids and microinjection of helicobacter pylori [J]. J Vis Exp (105): 53359, 2015.
[7] McCracken KW, Aihara E, Martin B, et al. Wnt/β-catenin promotes gastric fundus specification in mice and humans [J].Nature, 2017,541 (7636) : 182-187.
[8] Kim TH, Shivdasani RA. Stomach development, stem cells and disease [J]. Development, 2016, 143(4) :554-565.
[9] Dedhia PH, Bertaux-Skeirik N, Zavros Y, et al. Organoid model of human gastrointestinal development and disease [J]. Gastroenterology, 2016. 150 (5): 1098-1112.
[10] Sebrell TA, Sidar B, Bruns R, et al. Live imaging analysis of human gastric epithelial spheroids reveals spontaneous rupture, rotation and fusion events [J]. Cell Tissue Res, 2018,371 (2):293-307.
[11] Morey P, Pfannkuch L, Pang E, et al. Helicobacter pylori Depletes Cholesterol in Gastric Glands to Prevent InterferonGamma Signaling and Escape the Inflammatory Response [J]. Gastroenterology, 2018, 154 (5): 1391-1404.e9.
[12] Seidlitz T, Merker SR, Rothe A, et al. Human gastrie cancer modeling using organoids [J]. Gut, 2018, In press.
[13] Nadauld LD, Garcia S, Natsoulis G, et al. Metastatic tumor evolution and organoid modeling implicate TGFBR2 as a cancer driver in diffuse gastric cancer [J]. Genome Biol, 2014, 15(8):428.






