肝类器官
肝脏在调节能量平衡和药物代谢过程中起着重要的作用,它能产生包括胆汁在内的人体所需的数千种物质和酶,并能解毒各种有毒物质。药物引起的肝中毒与肝的代谢密切相关,肝脏研究一直是专家们研究的热点。
虽然肝脏细胞在人体内再生能力不受限制,但如果脱离人体环境只能存活2-3天,肝细胞独特的再生功能也会消失。随着细胞生物学的迅速发展,研究发现3D培养体系可以显著促进肝细胞体外成熟功能,提供了肝细胞的空间位置、压力信号和基质粘附信息,在肝细胞的生存和功能中起重要作用。
肝脏类器官能更好地模拟肝脏的代谢和合成功能,如糖原代谢、脂质代谢、类固醇代谢、药物代谢、白蛋白分泌、尿素合成等,并能高度表达肝细胞相关药物代谢酶、核受体和肝脏特异性标志物,例如ALB, AAT, HNF-4α, HNF-3β等。
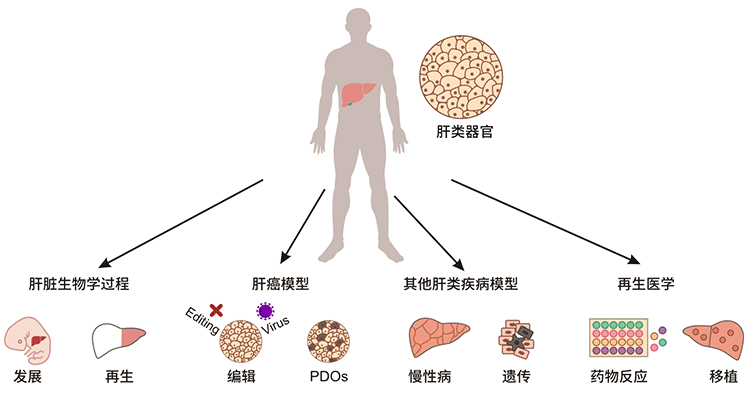
图1. 肾类器官的应用
1、肝脏类器官的研究
来自健康供体的肝脏类器官是了解肝脏发育和再生等肝脏生物学过程、模拟肝癌和其他肝脏疾病(如慢性和遗传性疾病)以及应用于再生医学(包括药物反应和移植)的理想模型。基因编辑、病毒感染和药物引入肝脏类器官可以模拟疾病的发生和发展过程。正常肝脏类器官是临床药物筛选、转化研究以及解毒和代谢研究的理想模型。来自患病样本的类器官,包括癌症类器官,概括了患者的原始特征。
| 肝类器官的来源 | 作用 |
|---|---|
| iPSC | 分泌白蛋白,药物代谢强 |
| MSC | 肝脏标志化合物的早期表达 |
| iPSC, matrix cell | 肝脏特异性基因表达,白蛋白和尿素分泌,细胞色素P450活性 |
| iPSC, SWISS, 3T3 cell | 肝细胞相关基因表达、白蛋白分泌、尿素生成 |
| MSC, HUVEC | 肝脏特异性基因表达及白蛋白分泌 |
| Hepatocyte | 白蛋白分泌,肝脏特异性基因高表达 |
| Hepatoma carcinoma cell, MSC, HUVEC | 肝脏特异性基因的高表达和尿素的形成 |
| iPSC, MSC, HUVEC | 白蛋白、管状蛋白和其他与紧密连接相关的功能标志物的高表达 |
| Hepatocyte, MSC, HUVEC | 肝脏特异蛋白表达及白蛋白分泌 |
| Hepatocyte, MSC, colon cancer HCT116 cell | 白蛋白分泌,尿素生成 |
| Hepatoma carcinoma cell | 血管生成生长因子高表达 |
2、肝细胞研究进展
2013年,Takebe等人使用 iPSC 产生的类肝细胞与人的脐静脉内皮细胞一级人骨髓间充质干细胞在 Matrigel 涂层板上共同培养,生成类似于人肝芽组织的 3D 聚合物,这是 iPSC 衍生的的第一个肝细胞类器官原型。 2013 年,Hans Clevers 等人对人类肝脏类器官进行了首次研究。他们发现,通过激活Wnt信号通路,利用Lgr5+肝干细胞,可以成功构建肝类器官。并通过分化和移植实验证明这些肝脏类器官具有肝细胞的功能活性[1]。构建的肝脏类器官虽然只具备肝脏的部分基本功能,但为后续研发奠定了基础。
2016年,马宣义等利用3D生物打印技术构建了ipsc衍生的肝类器官[2]。
肝癌类器官于 2017 年应用于疾病建模和药物筛选 [3]。肝脏是一个功能复杂的多细胞器官,单细胞类器官不能完全概括肝脏功能。 2017 年,Guan 等人。首次使用 iPSCs 实现肝胆细胞的共分化,从而产生肝胆类器官。在同一时期,Laura Broutier 等人。从肝癌患者的肝癌组织中成功培养出8个原发性肝癌(PLC)类器官。该模型不仅可以包含亲本肿瘤的组织结构、表达谱、基因组谱系和体内致瘤性,还可以作为生物标志物鉴定和药物筛选的模型。它直接表明类器官可用于识别肝癌新治疗靶点的基因和潜在预后价值。
2018年,胡等人利用原发性肝组织培养具有小胆管结构的肝脏类器官。同年Sandro Nuciforo 等人成功从晚期肝癌患者穿刺样本中培养出肝癌类器官,并在连续培养32周后成功鉴定[4]。研究结果发现肝癌类器官仍保持原发肿瘤的基因组特征和遗传异质性。
2019 年,Takebe 等人在国际上首次利用iPSC成功构建了肝脏、胰腺和胆管三个相互连接的类器官,为研究人体器官早期形成复杂的相互作用过程提供了可能[5]。 2019 年,Sun等人使用具有灭活 p53 和 Rb 的重组人干细胞培养具有肝脏结构和功能的类器官[6]。并且通过基因工程技术观察到c-Myc的过度表达会导致肝脏类器官的致癌作用。通过分析人类肝内胆管癌细胞中的富集突变,他们证明联合抑制 Notch 和 JAK-STAT 可防止 RAS 诱导的肝细胞向肝内胆管癌细胞的转变。
2020年,关等人通过肝脏类器官建模,确定了一种对早期肝脏发育至关重要的途径,即磷脂酰乙醇胺生物合成 [7]。基于这一发现,他们研发了一种治疗原发性肝癌的新型联合药物。
4、肠道疾病研究靶点
参考文献:
[1] Meritxell Huch, Craig Dorrell, Hans Clevers, et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration [J]. Nature. 2013 Feb 14; 494(7436): 247–250.
[2] Ma Xuanyi, Qu Xin, Zhu Wei, et al. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting [J]. Proc Natl Acad Sci, 2016, 113: 2206-2211.
[3] Broutier L, Mastrogiovanni G, Verstegen MM, et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening [J]. Nature Medicine, 2017, 23(12): 1424-1435.
[4] Sandro, N., et al. Organoid Models of Human Liver Cancers Derived from Tumor Needle Biopsies [J]. Cell Reports, 2018. 24(5): p. 1363-1376.
[5] Koike H, Iwasawa K, Ouchi R, et al. Modelling human hepatobiliary-pancreatic organogenesis from the foregut-midgut boundary [J]. Nature, 2019, 574(7776) : 112-116.
[6] Sun, L., et al. Modelling liver cancer initiation with organoids derived from directly reprogrammed human hepatocytes [J]. Nature Cell Biology, 2019. 21(8): p. 1015-1026.
[7] Guan Yuan, Chen Xinyu, Wu Manhong, et al. The phosphatidylethanolamine biosynthesis pathway provides a new target for cancer chemotherapy [J]. Hepatology, 2020, 72(4): 746-760.






